江苏省届高三化学各地名校月考试题汇编实验探究2Word文档格式.docx
《江苏省届高三化学各地名校月考试题汇编实验探究2Word文档格式.docx》由会员分享,可在线阅读,更多相关《江苏省届高三化学各地名校月考试题汇编实验探究2Word文档格式.docx(20页珍藏版)》请在冰豆网上搜索。
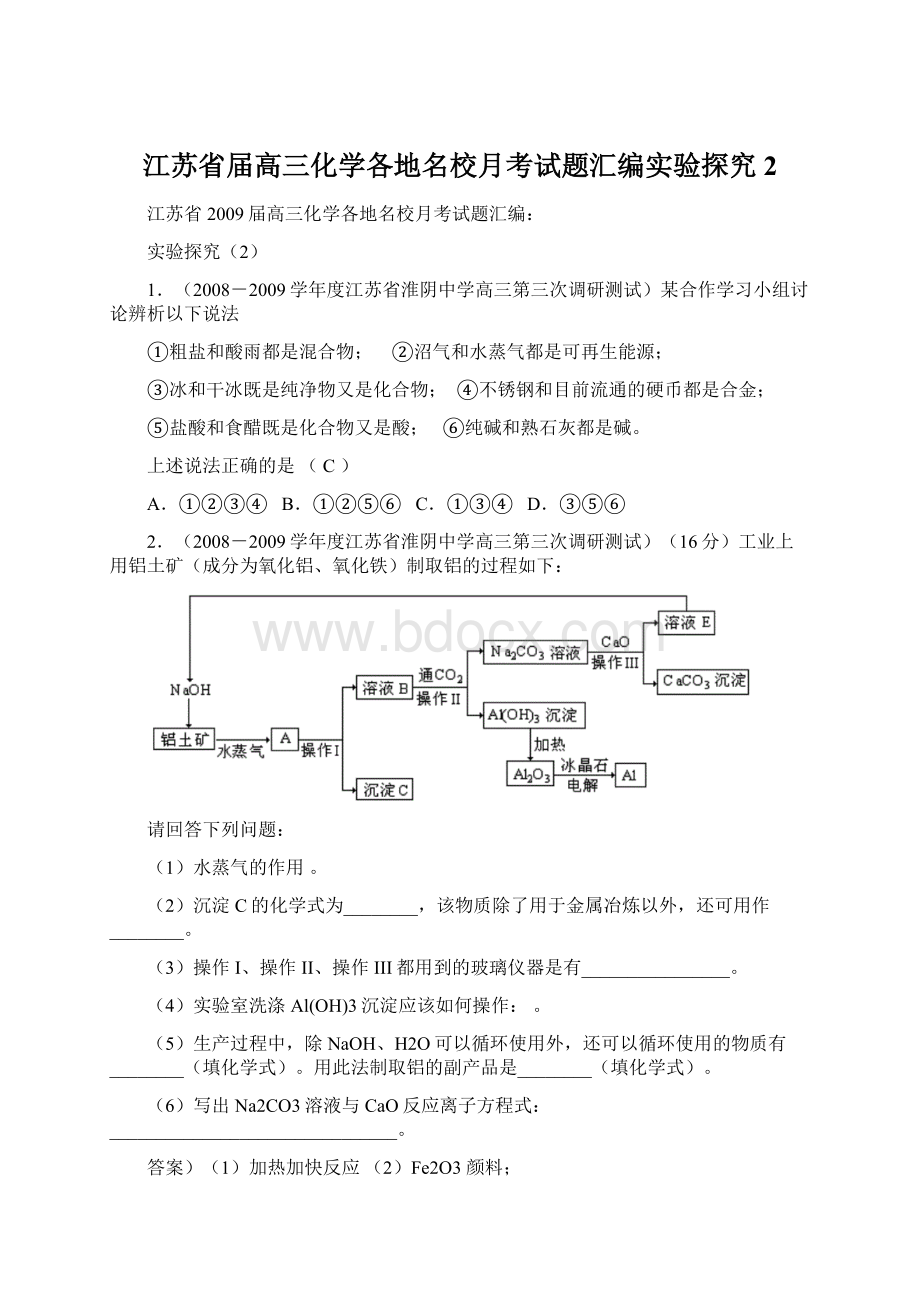
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
:
(填写序号)
①都褪色②都不褪色③B褪色,D不褪色④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:
,D:
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快。
为了探讨SO2和Cl2按1:
1通入的漂白效果,他们设计了如下实验装置:
①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
答案)
(1)在D中装水漫过导管一段距离,关闭分液漏斗活塞,用酒精灯加热烧瓶,看到D中有气泡冒出,停止加热有液柱回流,则说明气密性良好。
(2分)
(2)H
SO
+Na
=Na
+SO
↑+H
O(2分);
分液漏斗盖子未打开(2分)
(3)①(2分)B:
由无色变为红色(2分)D:
无明显现象(2分)
(4)①品红未褪色(2分)
②SO
+Cl
+2H
O=4H
+2Cl
(2分)
4.(淮阳一高09高三一轮复习月考(11月份)(15分)某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(N2和O2的用量可自由控制,气体液化温度:
NO221℃;
NO—152℃)
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭K1、K2、K3,将D中的烧瓶从烧杯中拿出,观察到的现象并给出合理的解释
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
答案).
(1)EDF(2分)
(2)排尽装置中的空气,防止NO被氧化(2分)
(3)D中烧瓶内通入O2后,无色气体变成红棕色(2分)
(4)4NO2+O2+4NaOH=4NaNO3(3分)
(5)气体颜色变浅(1分),烧瓶拿出后,气体温度降低,平衡2NO2
N2O4;
△H<
0向右移动,NO2的浓度减小,气体颜色变浅。
(2分)
(6)a/4mol<n<a/2mol(3分)
5.(淮安市2009届高三年级十月四校联考)(8分)铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。
若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。
可选用的试剂是(选填序号);
a.Cl2b.Fec.HNO3d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。
精矿在阳极浸出的反应比较复杂,其中有一主要反应:
CuFeS2+4Fe3+=Cu2++5Fe2++2S。
(CuFeS2中S为-2价)
则下列说法正确的是(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,有46gCuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:
1,试配平下列方程式:
FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。
高铁酸钾作为水处理剂发挥的作用是_______、_________。
答案)
(1)d(2分);
(2)d(2分);
(3)2、6、2、2、2、1(2分)
(4)净水、消毒(各1分,共2分)。
6.(淮安市2009届高三年级十月四校联考)(14分)某化学兴趣小组的同学买来一瓶“84”消毒液,请大家与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:
“本品为无色液体,呈碱性……”,请你推测它的有效成分_______(填序号):
A.Cl2B.H2O2C.NaClOD.KMnO4
(2)该化学兴趣小组的同学在瓷碗中盛放20mL的“84”消毒液,露置在阳光充足的室内,他们对“84”消毒液的消毒效果和组成成分的变化进行了研究。
得出数据如下
从数据图1和图2可得知“84”消毒液暴露在空气中半小时后,“84”消毒液中的主要溶质是_____,用化学方程式或离子方程式表示其中变化的主要原因 、
、 。
(3)该化学兴趣小组的同学备选了紫色石蕊试液对“84”消毒液的性质进行实验检验请你帮助他们完成实验报告:
实验操作
预期现象
结论
(4)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:
有一家庭主妇把抗SARS用的“84”消毒液和清洁济(呈酸性、含Cl-)都倒出一些混合在一起,进行刷洗。
一会儿,她就晕倒在房间里。
这几位同学感到迷惑不解。
请你用离子方程式帮助他们解开这一悬念
答案)
(1)C(2分)
(2)氯化钠(或NaCl)(1分)
2NaClO+CO2+H2O=2HClO+Na2CO3 2HClO=2HCl+O2↑ 2HCl+Na2CO3=CO2↑+H2O+2NaCl(每个方程式2分,写离子方程式也可)
(3)(操作、现象、结论各1分,共3分)
取一干净试管,加入1-2毫升“84”消毒液,然后滴加几滴紫色石蕊试液
先变蓝后褪色
“84”消毒液具有碱性和氧化性(或漂白性)
(4)ClO-+Cl-+2H+=Cl2↑+H2O(2分)
7.(淮安市2009届高三年级十月四校联考)(9分)化肥中的氮肥主要是“铵肥”和尿素。
某化学兴趣小组对某“铵肥”化肥进行了专项研究:
(1)预测:
根据已有知识和“铵”的名称,该小组预测该“铵肥”是_____(至少填2种不同的“某”酸)铵盐。
(2)验证和探究:
①NH4+的验证:
取少量固体药品于试管中,然后
②阴离子的探究:
a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。
观察到的现象是:
溴水无明显变化,澄清石灰水变浑浊。
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
初步结论:
“铵肥”是的铵盐。
b.要进一步确定“铵肥”的成分还需要补做如下实验:
取适量“铵肥”配制成溶液,取试液于一支洁净的试管中,加
答案
(1)碳酸、硫酸、亚硫酸、硝酸等任写两个
8.(淮安市2009届高三年级十月四校联考)某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案
:
铜铝混合物测定生成气体的体积
铜铝混合物测定剩余固体的质量
列有关判断中不正确的是[B]
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案II更便于实施
9.(淮安市2009届高三年级十月四校联考)科学的假设与猜想是科学探究的先导和价值所在。
在下列假设(猜想)引导下的探究肯定没有意义的选项是[B]
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应生成的气体可能是O2
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuO
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
10.(江苏省口岸中学09届秋学期高三年级第二次月考)(10分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。
在工业生产上规定:
空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:
cm3/min)外,还需要测定。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:
准确移取50mL5×
10-4mol/L的标准碘水溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。
在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_______________________________________________________________。
③丙同学认为:
乙同学的实验方案需要抽气的次数太多,操作麻烦。
与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用(选填:
①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
答案)⑴溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
⑵①800②抽气速度过快,或装置气密性较差
③将50mL5×
10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④
11.(常州一中2009届12月高三化学月考)(12分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。
为测定甲、乙两瓶溶液的成分及物质的量浓度,进行如下实验:
量取25.00mL甲溶液,向其中缓缓滴入乙溶液15.00mL,共收集到224mL(标准状况)气体。
量取15.00mL乙溶液,向其中缓缓滴入甲溶液25.00mL,共收集到112mL(标准状况)气体。
(1)判断:
甲是___________溶液,乙是____________溶液。
(2)实验②中所发生的反应的离子方程式为______________________。
(3)甲溶液的物质的量浓度为_________,乙溶液的物质的量浓度为_________。
(4)将nmL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为VmL(标准状况),则V的取值范围是________________。
答案)
(1)盐酸,碳酸钠溶液;
(2)CO
H
HCO
、HCO
+H
O+CO
↑
(3)0.8mol/L、1.0mol/L;
(4)0~8.96n
12、(常州一中2009届12月高三化学月考)(12分)
某氯化铁样品含有少量FeCl2杂质。
现要测定其中铁元素的质量分数,实验按以下步骤
进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、,(填仪器名称)
操作II必须用到的仪器是。
(填下列编号)
A.50mL烧杯B.50mL量筒 C.100mL量筒D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式,
加入氨水要过量的原因是。
(3)检验沉淀是否已经洗涤干净的操作是。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是(列出原始算式,不需化简);
若称量准确,最终测量的结果偏大,则造成误差的原因可能是(写出一种原因即可)
答案)
(1)250mL容量瓶、胶头滴管-------------(各1分)D-----------------------(1分)
(2)2Fe2++Br2=2Fe3++2Br--------(1分)使Fe3+充分沉淀----------(1分)
(3)取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净(合理的答案均可得分)--------------------------(2分)
(4)再次加热冷却并称量,直至两次质量差小于0.1g--------------------------------------(2分)
(5)铁元素的质量分数是
-------------------------------------------(2分)
原因可能是:
固体加热时未充分反应变为Fe2O3-------------------------------------(1分)。
13.(09江苏赣榆海头中学高三化学第二次月考)(10分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。
在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。
请写出反应器中发生反应的化学方程式:
;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
温度/℃
20
40
60
80
KIO3g/100g水
8.08
12.6
18.3
24.8
【问题2】已知:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。
用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×
10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。
则加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
操作步骤
实验现象
取1g纯净的NaCl,加3mL水配成溶液。
溶液无变化
滴入5滴淀粉溶液和1mL0.1mol/LKI溶液,振荡。
然后再滴入1滴1mol/L的H2SO4,振荡。
溶液变蓝色
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:
答案)
【问题1】
(1)6I2+KCLO3+3H2O=6KH(IO3)=5KCL+3CL2↑(2分)
(2)蒸发结晶(1分)
【问题2】
(1)分液漏斗(多选烧杯玻璃棒等合理答案不扣分)(1分)
(2)1270/3W(423.33/W)(2分)
(3)①4I-=4H++O2=2I2+2H2O(2分)
②学生乙实验结果会偏大(2分)
14.(常州市第二中学09高三化学期中质量检测试卷)(B)
【实验化学】
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.请回答下列问题:
(1).滴定反应达到终点的现象是.
(2).实施滴定的溶液以呈(选填“酸性”、“中性”或“碱性”)为佳,加入
(填化学式)试剂可达到这一目的.
(3).在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Clˉ)的测定结果(选填“偏高”、“偏低”或“无影响”).
(4).到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n(Clˉ)测定值偏低,这说明两者的溶解度:
AgClAgSCN(填“>”或“<”).
(5).若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为.
答案).B.
(1).溶液由无色变为血红色(2分)
(2).酸性HNO3(各1分)
(3).偏高(2分)(4).>(2分)
(5).0.2mol·
L―1(2分)(6).79.5%(2分)
15(常州市第二中学09高三化学期中质量检测试卷).(16分)
(1).化学实验设计和操作中必须十分重视安全问题和环境保护问题.下列实验问题处理方法不正确的是_________________.
①.制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②.在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声
③.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
④.给试管中的液体加热时,不时移动试管或加入碎瓷片,以免暴沸伤人
⑤.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑥.配制硫酸时,可先在烧杯中加入一定体积的水,再边搅拌边加入浓硫酸
(2).用如右图所示装置进行实验,将A逐滴加入B中:
a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式________________.然后往烧杯中加入沸水,可观察到试管C中的现象.
b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入少量葡萄糖溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是(填名称),C是(填化学式).与葡萄糖溶液混合后,该溶液中反应的化学方程式_________.仪器D在此实验中的作用是.
(3).某固体混合物中含有Na+、K+、Mg2+和Cl-、Br-五种微粒.
Ⅰ.欲将钠、钾、镁三元素大致分离开来,并将氯、溴两元素大致分离开来,有以下方法和操作步骤可供选择(其中有的步骤可选两次).
.溶于水制成稀溶液;
.溶于水制成浓溶液;
.通入足量CO2;
.加入足量氯水;
.通入足量氨气;
.过滤;
.用四氯化碳萃取.
选取最合理的方法和步骤:
(按顺序先后填写编号).
Ⅱ.分离后剩余的水溶液中所含的主要物质是.
Ⅲ.在上述分离过程中分离出一种化合物晶体.欲得到干燥的该化合物固体,有两种方法可供选择:
.加热蒸发掉水分;
.将过滤得到的固体物质自然风干.正确的方法应选择_____.
答案)
(1).②③(2分)(选对1个得1分,选错1个扣1分,但不出现负分)
(2).a.C6H5O-+H2O+CO2C6H5OH+HCO3-浑浊变澄清
b.氨水AgNO3
CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]OHCH2(OH)(CHOH)4COONH4+2Ag+3NH3+H2O防倒吸(方程式每个2分,其余每空各1分)
(3).Ⅰ.
Ⅱ.KCl、NH4ClⅢ.②(每空各2分)
16.(江苏省盐城市重点中学高中2009届第一协作片联考)科学的假设与猜想是科学探究的先导和价值所在。
在下列假设(猜想)引导下的探究肯定没有意义的选项是[BC]
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是Cu(OH)2
17.(泰兴市第一高级中学2009届高三年级第五次周考)(10分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。
_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
KIO3+5KI+3H2S