高考化学三轮复习之图形题中水溶液中的离子平衡专题解析版Word文件下载.docx
《高考化学三轮复习之图形题中水溶液中的离子平衡专题解析版Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学三轮复习之图形题中水溶液中的离子平衡专题解析版Word文件下载.docx(12页珍藏版)》请在冰豆网上搜索。
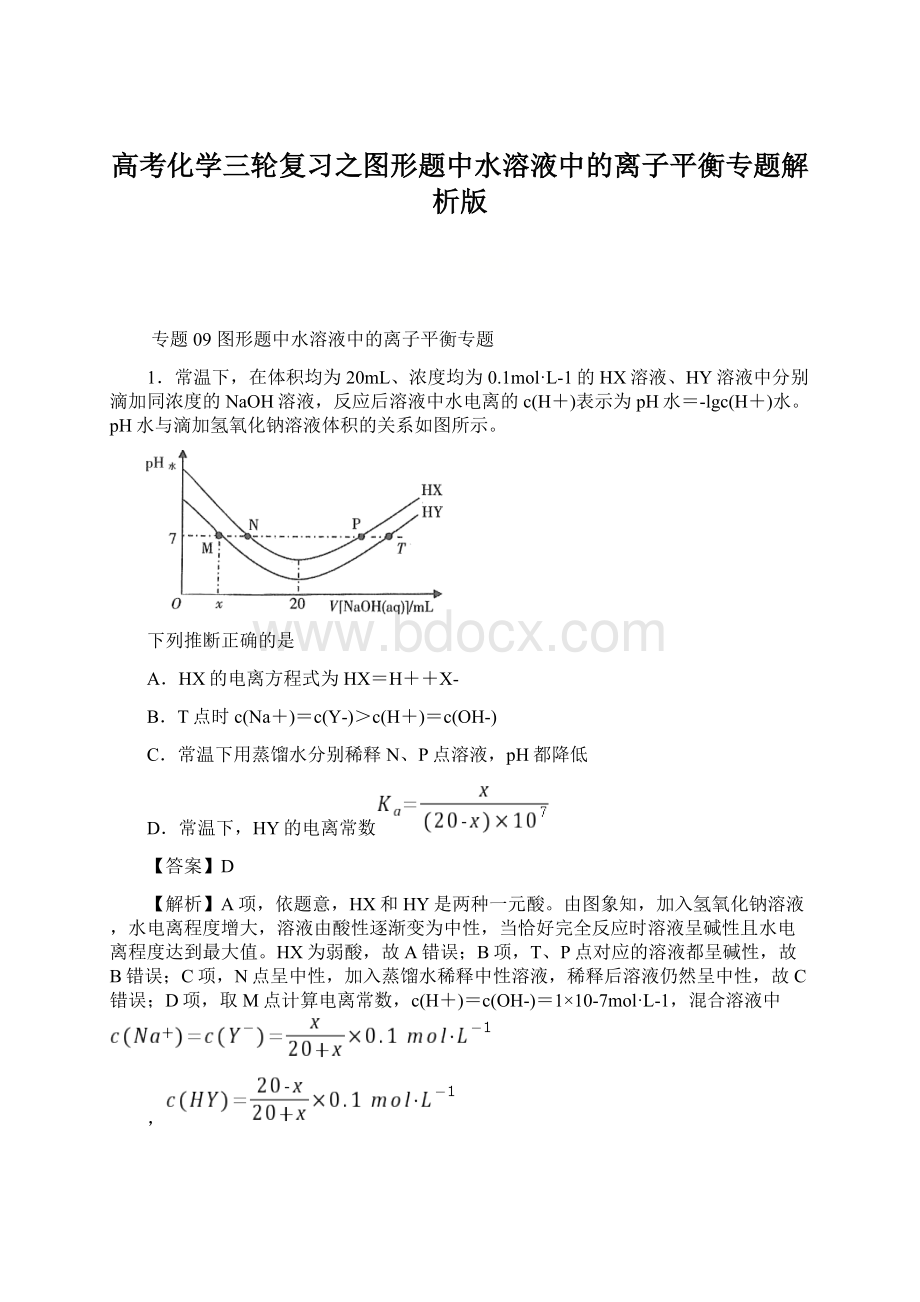
NOH,且两次滴定时均可用酚酞作为指示剂
C.滴定NOH,当加入盐酸体积为10mL时,溶液中必有:
c(Cl-)+c(H+)=c(OH-)+c(NOH)
D.当两溶液均恰好滴定完全时,两溶液中的离子总数相等
【答案】C
【解析】A项,由起始时pH值的大小可知,NOH一定为弱碱,MOH可能是强碱也可能是弱碱,由起始得,NOH溶液中c(OH―)=10-3mol•L-1,故Kb(NOH)≈10-5,A错误;
B项,用强酸滴定时,对于NOH来说,滴定终点为强酸弱碱盐,溶液呈酸性,对MOH来说,终点可能是酸性也可能是中性,故均可选用甲基橙作为指示剂,不宜用酚酞,B项不正确;
C项,当滴定到加入HCl为10mL时,由电荷守恒:
c(N+)+c(H+)=c(Cl―)+c(OH―),由物料守恒:
2c(Cl―)=c(N+)+c(NOH),两式相加得:
c(Cl―)+c(H+)=c(OH―)+c(NOH),C项正确;
D项,滴定至恰好完全反应时,均消耗盐酸20mL,两溶液中由电荷守恒均有c(R+)+c(H+)=c(Cl―)+c(OH―)(R为N或M),两溶液中c(Cl―)相等,但c(OH―)不相等,所以离子总浓度不相等,离子总数也不相等,D错误。
3.常温下0.1mol·
L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示。
下列说法不正确的是
A.由图中数据可计算得到常温下亚硫酸溶液的Ka2
B.在0.1mol·
L-1H2SO3溶液中,存在:
c2(H+)=c(H+)·
c(HSO3-)+2c(H+)·
c(SO32-)+Kw
C.向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化
D.在pH=2.0溶液中:
c(H2SO3)>
c(HSO3-)>
c(H+)>
c(OH-)
【解析】A项,H2SO3是二元弱酸,在溶液中电离是分步进行的,亚硫酸的第一步电离方程式为:
H2SO3
H++HSO3-,根据图象可知,pH=7时,亚硫酸氢根离子浓度等于亚硫酸根离子浓度,Ka1=c(H+)=10-7,故A正确;
B项,在0.10mol•L-1H2SO3溶液中,根据电荷守恒可得:
c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:
c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+c(H+)•c(OH-),Kw=c(H+)•c(OH-),所以c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C项,溶液的pH=7时显中性,所以c(OH-)=c(H+),根据图象知,溶液中含有SO32-和HSO3-,存在水解平衡和电离平衡,是缓冲溶液加入少量稀盐酸,溶液pH的变化较小,pH为4.0的溶液中只存在HSO3-的电离,滴入相同量稀盐酸造成的溶液pH变化较大,故C正确;
D项,在pH=2.0的溶液中,根据图象曲线可知c(HSO3-)>c(H2SO3),正确的离子浓度大小为:
c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故D错误;
4.常温下,向1L0.1mol·
L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·
H2O电离平衡常数K=1.76×
10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述正确的是
A.0.1mol·
L-1HR溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)]逐渐增大
C.当通入0.1molNH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D.当c(R-)=c(HR)时,溶液必为中性
【解析】A项,pH=5时c(H+)=10-5,由图可得此时
=0,又因为一元酸HR溶液为0.1mol·
L-1,所以c(R-)=c(HR)=0.05mol·
L-1,所以此时c(R-)≠c(H+),则0.1mol·
L-1HR溶液的pH不是5,故A错误;
B项,由已知HR溶液中存在着HR分子,所以HR为弱酸,
=
=Ka/Kw,温度不变时Ka/Kw的值不变,故B错误;
C项,pH=5时c(H+)=10-5,由图可得此时
=0,则Ka=
=10-5,当通入0.1molNH3时,恰好反应生成NH4R,又因为常温下NH3·
10-5,所以NH4R溶液中R-水解程度大于NH4+水解程度,NH4R溶液呈碱性,则c(NH4+)>c(R-)>c(OH-)>c(H+),故C正确;
D项,由前面对A项的分析知,当c(R-)=c(HR)时,pH=5,所以溶液显酸性,故D错误。
5.室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.lmol·
L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是
A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系:
pH(NaA)>pH(NaB)>PH(NaD)
B.滴定至P点时,溶液中:
c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:
c(A-)>c(B-)>c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【解析】A项,浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,酸越弱,电离出的H+越少,起始时pH值越大,根据图象,则三种酸的强弱为:
HA>HB>HD,酸越强,电离出的H+越多,对水的抑制作用越大,则三种溶液中,由水电离产生的c(H+)的关系为:
HA<HB<HD,故A错误;
B项,滴定至P点时,此时中和百分数为50%,对于HB溶液,此时溶液中的起始组分为c(HB):
c(NaB)=1:
1,显酸性,则c(H+)>c(OH-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(B-),由于c(H+)>c(OH-),则c(B-)>c(Na+),考虑到溶液显酸性,则以HB的电离为主导,但始终是微弱的,而HB的电离又会抑制水的电离,因此c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C项,pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,对于HA溶液,c(Na+)=c(A-),对于HB溶液,c(Na+)=c(B-),对于HD溶液,c(Na+)=c(D-),由图可知,中和到相同pH时,中和分数HA>HB>HD,即加入氢氧化钠的量HA>HB>HD,则三种溶液中:
c(A-)>c(B-)>c(D-),故C正确;
D项,当中和百分数达100%时,三种溶液分别恰好存在等量的NaA、NaB、NaD,三种溶液混合,则起始时c(NaA):
c(NaB):
c(NaD)=1:
1:
1,根据质子守恒,c(HA)+c(HB)+c(HD)+c(H+)=c(OH-),则有c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),故D错误;
故选C。
6.25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。
已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。
下列有关说法不正确的是
A.溶液的导电性:
点a弱于点b
B.离子浓度c(R2-):
点c小于点d
C.H2R+R2-=2HR-平衡常数>
105,反应趋于完全
D.点b时,y<
7且
<
1
【解析】A项,b点是向20mL0.1mol•L-1H2R(二元弱酸)溶液中滴加0.1mol•L-1NaOH溶液20mL,得到浓度为0.05mol/L的NaHR溶液;
a点是向20mL0.1mol•L-1H2R(二元弱酸)溶液中滴加0.1mol•L-1NaOH溶液10mL,得到浓度均为0.1/3mol/L的NaHR和H2R的混合溶液,由于阴离子的水解和电离程度均很小,因此b点溶液中的离子浓度大于a点,导电能力点a弱于点b,故A正确;
B项,c点溶液溶质为等物质的量的Na2R、NaHR,浓度均为0.03mol/L,d点溶液中溶质为0.1/3mol/LNa2R,R2-水解但程度较小,HR-既电离又水解但程度均很小,因此离子浓度c(R2-):
点c小于点d,故B正确;
C项,H2R+R2-=2HR-平衡常数K>
105,说明反应进行的程度很大,反应趋于完全,故C正确;
D项,b点时所得溶液为0.05mol/L的NaHR溶液,pKa2=7.21,Ka2=10-7.21,则HR-的电离程度大于水解程度,溶液呈酸性,y<7,pKa1=1.89,则Ka1=10-1.89,Ka1=
,同理Ka2=
,则Ka1×
Ka2=
×
,因此
=
=
=104.9>1,故D错误;
7.用0.1mol·
L-1NaOH溶液滴定20mL0.1mol·
L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。
下列叙述不正确的是
A.Ka2(H2SO3)的数量级为10-8
B.若滴定到第一、二反应终点,应该分别用甲基橙和本酚酞作指示剂
D.图中Y点对应的溶液中:
3c(SO32-)=c(Na+)+c(H+)-c(OH-)
C.图中溶液中水的电离程度:
W<X<Y<Z<M
【解析】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO4溶液,由于H2SO3是二元酸,滴定过程中存在两个化学计量点,滴定反应为:
NaOH+H2SO3═NaHSO3+H2O,NaHSO3+NaOH═Na2SO3+H2O,完全滴定需要消耗NaOH溶液的体积为80mL,结合溶液中的守恒思想分析判断。
A项,由图像可知,当溶液中c(HSO3-)=c(SO32-)时,此时pH=7.19,即c(H+)=10-7.19mol/L,则H2SO3的Ka2=
=c(H+),所以H2SO3的Ka2=1×
10-7.19,Ka2(H2SO3)的数量级为10-8,故A正确;
B项,第一反应终点时,溶液中恰好存在NaHSO3,根据图像,此时溶液pH=4.25,甲基橙的变色范围为3.1~4.4,可用甲基橙作指示剂,第二反应终点时,溶液中恰好存在Na2SO3,根据图像,此时溶液pH=9.86,甲基橙的变色范围为8.0~10.0,可用酚酞作指示剂,故B正确;
C项,根据图像,Y点溶液中c(HSO3-)=c(SO32-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),由于c(HSO3-)=c(SO32-),所以3c(SO32-)=c(Na+)+c(H+)-c(OH-),故C正确;
D项,随着NaOH溶液的不断加入,溶液中的酸性减弱,碱性增加,水的电离程度增大,当达到Z点为第二反应终点,此时溶液中恰好存在Na2SO3,水的电离程度达到最大,到了M点,NaOH溶液过量,抑制了水的电离,故D错误。
8.25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數)与pH的关系如下图所示。
A.新制的pH=1的氯水中,c(C13-)>
c(HClO)>
c(H+)
B.新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C.25℃时,HClO
H++ClO-的电离常数Ka的对数值为lgKa=-6.46
D.pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
【解析】A项,由电荷守恒:
c(H+)=c(OH-)+c(C13-),c(H+)>
c(C13-),A错误;
B项,Cl2+SO2+2H2O=H2SO4+2HCl,pH不断变小,溶液颜色不加深,B错误;
C项,25℃时,HClO
H++ClO-的电离常数Ka=
=10-7.54,对数值为lgKa=-7.54,C错误;
D项,由图增大pH,HClO的浓度变小,是反应物,ClO-增大,是生成物,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O,D正确。
9.已知10-3.4≈3.98×
10-4,常温下CH3COOH和NH3·
H2O的电离常数相等,现向10mL浓度为0.0100mol/L的氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加CH3COOH溶液的体积关系如图所示。
下列说法错误的是( )
A.n=7
B.水的电离程度先增大再减小
C.常温下,0.0100mol/L的氨水中NH3·
H2O的电离度为3.98%
D.Y点对应的溶液中c(NH3·
H2O)+c(OH-)=c(CH3COO-)+c(H+)
【答案】D
【解析】X点,氨水和醋酸恰好完全反应生成醋酸铵和水,由常温下CH3COOH和NH3·
H2O的电离常数相等,可推知铵根离子和醋酸根离子的水解程度相同,所以溶液显中性,即n=7,A正确;
氨水显碱性,NH3·
H2O抑制水的电离,随着CH3COOH溶液的加入,生成醋酸铵,醋酸铵水解,促进水的电离,当CH3COOH溶液过量,溶液显酸性时,CH3COOH抑制水的电离,所以水的电离程度先增大再减小,B正确;
常温下,0.0100mol/L的氨水的pH=10.6,则c(OH-)=10-3.4mol/L,NH3·
H2O
N
+OH-,NH3·
H2O电离出的c(N
)和c(OH-)相等,则氨水中NH3·
H2O的电离度≈
100%≈3.98%,C正确;
Y点对应溶液的溶质为等浓度的醋酸铵和NH3·
H2O,溶液中物料守恒关系式为c(NH3·
H2O)+c(N
)=2c(CH3COOH)+2c(CH3COO-),电荷守恒关系式为c(N
)+c(H+)=c(CH3COO-)+c(OH-),联立两个式子消去c(N
)可得c(NH3·
H2O)+c(OH-)=2c(CH3COOH)+c(CH3COO-)+c(H+),D错误。
10.[结合图像考查电离常数、电离度、水的离子积常数的应用]常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×
10-4,lg5≈0.7。
电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。
常温下,用0.02mol·
L-1盐酸分别滴定20.00mL浓度均为0.02mol·
L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。
下列推断正确的是( )
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:
c(Cl-)>
c(CH3N
)>
C.常温下,E、F点对应的溶液中水电离的c(H+)·
c(OH-)=1.0×
10-14
D.常温下,F点对应的溶液的pH≈6.3
【解析】曲线Ⅰ在滴定前电导率较大,说明对应的电解质溶液中离子浓度较大,氢氧化钠溶液和甲胺溶液的起始浓度相等,故曲线Ⅰ代表氢氧化钠的滴定曲线,H点对应的溶液中含有Na+、H+、Cl-、OH-、H2O,存在水的电离平衡,A项错误。
G点对应的溶液中溶质是CH3NH3Cl、HCl,酸碱中和滴定反应为CH3NH2+HCl
CH3NH3Cl,则过量的HCl的物质的量是CH3NH3Cl的
弱碱阳离子水解程度很小,所以G点对应的溶液中离子浓度大小为c(Cl-)>
c(OH-),B项错误。
E点对应的溶液为NaCl溶液,呈中性,F点对应的溶液为CH3NH3Cl溶液,呈酸性,CH3N
水解促进水的电离,故F点对应溶液中水电离的c(H+)·
c(OH-)大于水的离子积,C项错误。
F点对应的溶液中酸碱恰好完全反应,溶液中溶质为CH3NH3Cl,浓度为0.01mol·
L-1,溶液中存在水解平衡CH3N
+H2O
CH3NH2·
H2O+H+,Kh=
10-10。
设0.01mol·
L-1CH3NH3Cl溶液中c(H+)=xmol·
L-1,有
10-10,x≈5×
10-7,得溶液的pH≈6.3,D项正确。
11.常温下,用0.1000mol·
L-1NaOH溶液滴定20.00mL0.1000mol·
L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。
下列说法正确的是[已知δ(X)=
]( )
.
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):
a点>
b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
【答案】.A
【解析】由HA
H++A-可知Ka(HA)=
当pH=4.7时,c(HA)=c(A-),所以Ka(HA)=c(H+)=10-4.7=100.3×
10-5≈2.00×
10-5,数量级为10-5,A项正确;
a点c(HA)>
c(NaA),b点c(NaA)>
c(HA),HA电离出的氢离子抑制水的电离,NaA水解促进水的电离,所以b点溶液中由水电离出的c(H+)大,B项错误;
当pH=4.7时,c(HA)=c(A-)、c(OH-)<
c(H+),故c(A-)+c(OH-)<
c(HA)+c(H+),C项错误;
当加入NaOH溶液的体积为20.00mL时,恰好与HA溶液完全反应,由于HA是弱酸,故生成的NaA为强碱弱酸盐,其水溶液显碱性,pH>
7,D项错误。