上海中学复旦附中等八校届高三联合调研化学文档格式.docx
《上海中学复旦附中等八校届高三联合调研化学文档格式.docx》由会员分享,可在线阅读,更多相关《上海中学复旦附中等八校届高三联合调研化学文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
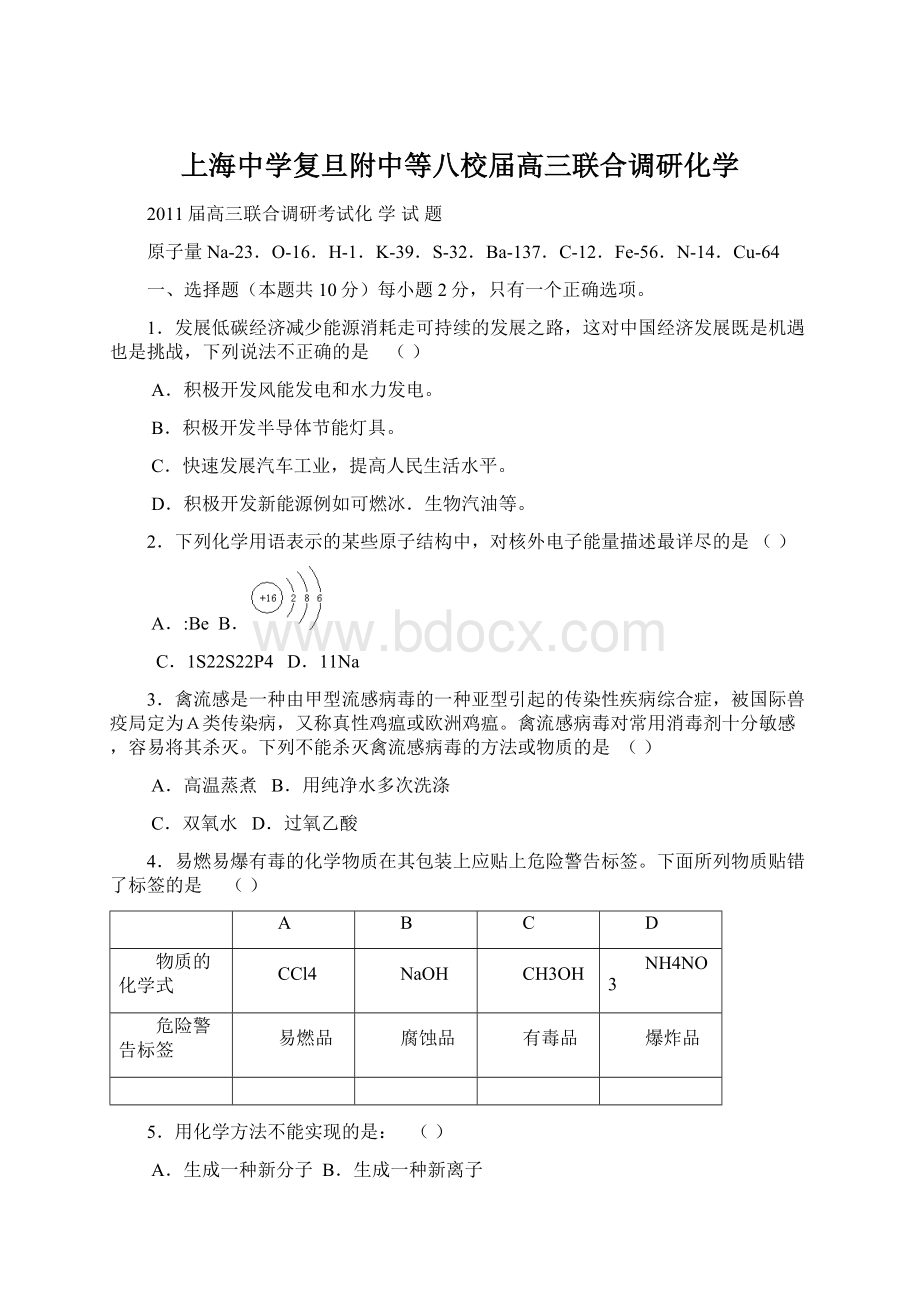
NH4NO3
危险警告标签
易燃品
腐蚀品
有毒品
爆炸品
5.用化学方法不能实现的是:
()
A.生成一种新分子B.生成一种新离子
C.生成一种新同位素D.生成一种新单质
二、选择题(本题36分),每小题3分,只有一个正确选项。
6.NO2-既有氧化性,又有还原性。
NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化为Fe3+,正常的血红蛋白转化为高铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。
下列各组试剂不能检验NO2-的是()
A.AgNO3.HNO3B.FeCl2.KSCNC.KMnO4.H2SO4D.KI.淀粉
7.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是()
A.Na2OB.Na2O2C.Na2O和Na2O2D.NaOH
8.若NA表示阿佛加德罗常数,下列说法正确的是()
A.1molCl2作为氧化剂得到的电子数为NA
B.25℃时,lLpH=13的Ba(OH)2溶液中含有Ba2+的数目为0.1NA
C.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
D.在标准状况下,22.4L空气中约有NA个气体分子
9.磷酸毗醛素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如右图,下列说法错误的是()
A.能与金属钠反应
B.能使石蕊试液变红
C.能发生银镜反应
D.1mol该酯与NaOH溶液反应,最多消耗3molNaOH
10.对于H—+H20→H2+OH—说法正确的是()
A.该反应属于置换反应。
B.若该反应中有1mol电子转移,则生成H2一定是22.4升
C.水是氧化剂。
D.H2只是氧化产物。
11.共价化合物含C.H.N三种元素。
分子内有四个N原子,且排成四面体,每两个N原子之间都含有1个C原子。
又知分子中无C一C键和C=C键,则该化合物的分子式()
A.C3H8N4B.C6H12N4C.C6H10N4D.C4H8N4
12..按下图装置,持续通入气态物质X,可以看到a处有红色物质生成,b处变蓝,c处得到无色液体,则X可能是()
A.H2B.CH3CH2OH(g)C.NH3D.CO和H2
13.下列说法正确的是()
A.用米汤检验食盐是否加碘B.共价分子构成了共价化合物
C.分子晶体中一定存在化学键D.用小苏打焙制糕点
14.下列实验过程中,始终无明显现象的是()
A.HCl通入Fe(NO3)2溶液中B.SO2通入溴水中
C.NH3通入CuSO4溶液中D.CO2通入Ba(NO3)2
15.下图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。
观察:
开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
以下有关解释合理的是()
A.生铁片中的碳是原电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:
O2+2H2O+4e→4OH—
D.具支试管中溶液pH逐渐减小
16.下列有关反应能量变化图像的判断错误的是()
IⅡⅢⅣ
A.I可表示需加热的放热反应B.Ⅱ可表示需加热的放热反应
C.Ⅲ表示爆炸反应D.Ⅳ表示醋酸和碱的中和反应
17.向100mL0.1mol·
L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·
L-1Ba(OH)2溶液。
随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。
则下列说法中正确的是()
A.a点的溶液呈中性
B.b点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH—→Al(OH)3↓+2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200mL
D.c点溶液呈碱性
三、选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。
只有一个正确选项的,多选不给分;
有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18.下列实验装置科学合理的是()
A.溴苯的制取B.硝基苯的制取
19.下列离子方程式,一定正确的是()
A.硫化亚铁与稀硝酸反应:
FeS+2H+→Fe2++H2S
B.将标准状况下112mL氯气通入10mL1mol/L的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl-
C.过量的NaHSO4与Ba(OH)2溶液反应:
Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O
D.将少量SO2气体通入Ca(ClO)2溶液中:
SO2+Ca2++2ClO-+H2O→CaSO3↓+2HClO
20.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比大于1∶3,其原因可能是()
A.两溶液的体积相同,酸是多元强酸
B.酸溶液的体积可能是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
21.由一种阳离子与两种酸根离子组成的盐称为混盐。
混盐CaOCl2在酸性条件下可以产生Cl2。
下列关于混盐CaOCl2的有关判断正确的是()
A.该混盐中氯元素的化合价为负一价
B.该混盐的水溶液呈中性
C.该混盐与硝酸反应产生1molCl2时转移1mol电子
D.该混盐具有和漂白粉相似的化学性质
22.滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用T(M1/M2)表示,T(HCl/NaOH)=0.04g/ml,表示每毫升标准盐酸溶液恰好与0.04克NaOH完全反应。
现有含Na2CO3的混合物样品,用上述标准盐酸滴定,若以酚酞为指示剂测得该样品的滴定度为0.073g/ml.则该样品中可能还含有的物质是()
A.NaOH.KOHB.K2CO3.NaHCO3
C.Na2SO4.KHCO3D.KOH.Ba(OH)2
第Ⅱ卷(共84分)
四、(本题共24分)
23.原子核内无中子的元素可放在元素周期表的族,又根据最高正化合价和负化合价的绝对值相等可放在族,该元素还可放在元素周期表的族。
它和氧元素可形成的化合物为。
科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。
AB
则A、B两幅图中能表示“热冰”的示意图为。
使水结成“热冰”采用“弱电场”的条件,说明水分子是分子。
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+)由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与H2S的水溶液反应的离子方程式;
该反应破坏的化学键是。
24.将25.02克绿矾溶于硫酸中,加入3..03克KNO3恰好将其中的亚铁离子全部反应。
(1)该反应的氧化剂是。
反应中硫酸的作用是。
(2)该反应的还原产物是。
(3)写出该反应的化学方程式。
。
(4)当有1.01克KNO3完全反应则生成的还原产物为升(标准状态)。
转移的电子为mol。
25.1100OC时,在恒容密闭容器中,发生可逆反应:
Na2SO4(s)+4H2(g)
Na2S(s)+4H2O(g)
并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K=。
降低温度,K值减小,则正反应为(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
(填“正向移动”.“逆向移动”或“不发生移动”)
①加入少量Na2SO4,则平衡:
②加入少量灼热的Fe3O4,则平衡:
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则达平衡时该容器内固体的总质量是。
(4)若将平衡体系温度降低100OC,下述图象中能正确反映平衡移动过程中容器变化情况的是
五、(本题共24分)
26.硫酸铜是一种应用极其广泛的化工原料。
铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发.结晶得到硫酸铜晶体(装置如图1.2所示)。
(1)图1中A仪器的名称,烧瓶中发生的离子反应方程式为:
(2)图2是图1的改进装置,其优点有:
①;
②。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:
以空气为氧化剂法
方案1:
以空气为氧化剂。
将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成
氧化铜,再将氧化铜与稀硫酸反应。
方案2:
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不
反应。
向反应液中加FeSO4或Fe2(SO4)3,即发生反应。
反应完全后向其中加物
质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤.蒸发.结晶,滤渣作催化剂循
环使用。
(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7.6.4。
)
请回答下列问题:
①方案1中的B仪器名称是。
②方案2中甲物质是(填字母序号)。
a.CaOb.CuCO3c.CaCO3d.NH3▪H2O
第二组:
过氧化氢为氧化剂法
将3.2g铜丝放到45mL1.5mol/L的稀硫酸中,控温在50℃。
加入18mL10%的
H2O2,反应0.5小时后,升温到60℃,持续反应1小时后,过滤.蒸发结晶.减
压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·
5H2O10.6g。
③加热时温度不宜过高的原因是,晶体采用酒精淋洗的
优点是。
④上述两种氧化法中,更符合绿色化学理念的是(填“第一组”或“第二组”),
理由是..。
27.二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
(1)以甲酸和碳酸钾为原料生产二甲酸钾,实验测得反应条件对产品回收率的影响如下:
表1反应温度对产品回收率的影响
反应温度(℃)
20
30
40
50
60
70
80
产品回收率(%)
75.6
78.4
80.6
82.6
83.1
82.1
73.7
表2反应物料比对产品回收率的影响
反应物料比
2∶1
3∶1
4∶1
5∶1
6∶1
7∶1
38.4
83.6
84.5
84.8
备注:
表2中反应物料比为甲酸和无水碳酸钾的物质的量之比。
①写出甲酸和碳酸钾生产二甲酸钾的化学方程式:
。
②实际生产二甲酸钾时应选择的最佳反应条件是反应温度应控制在℃∽℃,反
应物料比应选择。
由表1可知反应温度过高,反应回收率反而会降低,其原
因可能是
③蒸发结晶后需进行的操作步骤是.。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取
出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·
L-1的NaOH溶液
滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是(选填“甲基橙”.“石蕊”或“酚酞”),用NaOH
溶液滴定至终点的现象是。
②上述弗米产品中二甲酸钾的质量分数为。
六、(本题共20分)
28.布噁布洛芬是一种消炎镇痛的药物。
它的工业合成路线如下:
(1)A长期暴露在空气中会变质,其原因是。
(2)有A到B的反应通常在低温时进行。
温度升高时,多硝基取代副产物会增多。
下列二硝基取代物中,最可能生成的是。
(填字母)
a.
b.
c.
d.
(3)AB的反应类型是。
(4)F的结构简式。
(5)D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是。
高聚物L由H通过肽键连接而成,该反应的类型是。
29.盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。
合成路线如下:
(1)C→D的反应类型是。
(2)A的结构简式为;
C的结构简式为;
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有种。
①属于苯的衍生物,苯环上共有二个取代基;
②与碳酸钠溶液反应可放出CO2气体,并且有—NH2基团
(4)写出
与足量的NaOH溶液共热充分反应的化学方程式:
(5)现仅以有机物CH3CH=CHCH3为原料,无机试剂任选,用反应流程图表示合成有机物CH3COOCH2CH=CHCH2OOCCH3的过程。
提示:
①
②由乙醇合成聚乙烯的反应流程图可表示为:
七、(本题共16分)
30.H2和Cl2组成的混合气体,经光照充分反应后气体中
存在的物质可能有的情况为:
a_____.b.
c。
将反应后的气体通入100ml1.0mol/LNaOH溶液中,图中表示溶液中某种离子的物质的量随通入气体体积的变化曲线
(1)图中表示溶液中__________离子的变化的曲线。
(2)如图,当n=0.02mol时,光照前的混合气体中H2和Cl2的体积之比为__________
31.Cl2和NO在室温下可以化合成一种新的气态化合物C,为测定C的分子组成,进行以下实验:
取总体积为5L的混合气体,测定反应后气体总体积V随着Cl2在混合气体中所占体积分数x的变化而发生变化的规律。
实验测知当Cl2所占体积分数为20%或60%时,反应后的气体总体积均为4L。
(1)写出化合物C的分子式,
写出反应的化学方程式:
(2)讨论当x取不同值时,反应后气体总体积V随x变化的关系。
X的取值范围
反应后气体总体积