化学选择题导学案 2Word文档格式.docx
《化学选择题导学案 2Word文档格式.docx》由会员分享,可在线阅读,更多相关《化学选择题导学案 2Word文档格式.docx(30页珍藏版)》请在冰豆网上搜索。
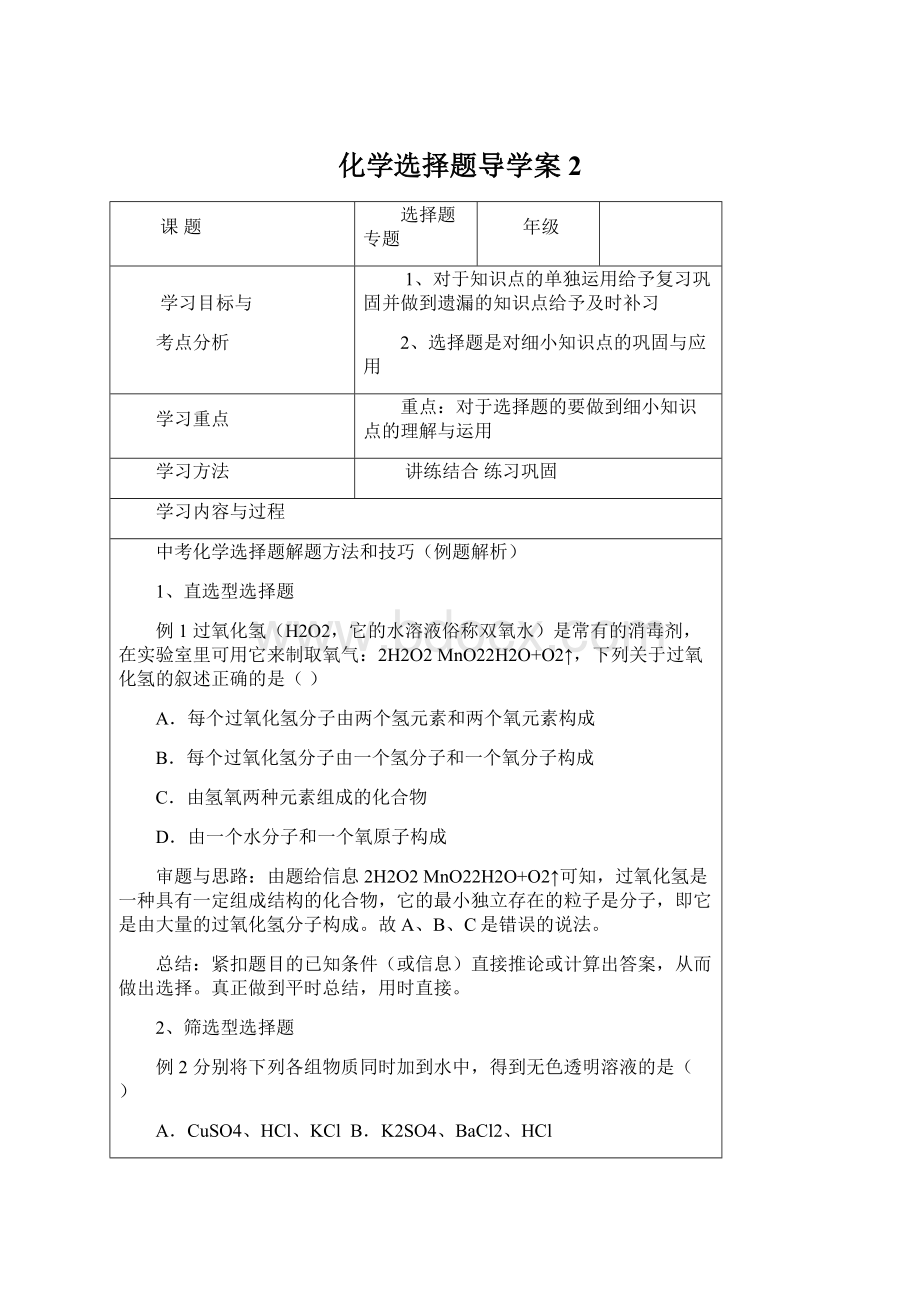
将两球分别浸泡在质量相同、溶质的质量分数也相同的稀硫酸中(如图所示),直至两个烧杯中均没有气泡产生为止。
两球的外形变化不大且无孔洞出现。
下列推测中,正确是()
A.铁球一定是实心的
B.拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同)
C.拿掉烧杯后,要想使杠杆平衡,支点应向N移动
D.拿掉烧杯后,要想使杠杆平衡,支点应向M移动
此题为跨学科综合性分析推断题。
解答题,先根据题给条件(信息)运用物理有关①物体的密度与体积的关系,②杠杆原理等推算出铁球必为空气,因为铁的密度比铝大,既然两球同质量、同体积,且悬挂杠杆两端又平衡,则说明两球所受到的重力与浮力一样,故铁球必为空心球。
继续根据题给信息,运用化学有关①金属与酸反应的化学原理、②定量计算的巧妙应用推断出:
消耗等质量的H2SO4需要的铁比铝多,从而进一步依据题给信息得知去掉烧杯之后,因铝球重支点必须向N端移动,故得出正确答案A、C。
选A、C
抓住题目中提供的前提设置和提出的问题,扣准题眼,运用规律,寻找突破口,对选项逐个分析推理,从而得出正确答案。
4、分析比较型选择题
例4向盛有相同溶质质量分数、相同质量稀硫酸的4支试管中,分别加入下列固体物质,使其与硫酸恰好完全反应,得到溶液的溶质质量分数最小的是()
A.MgB.MgOC.Mg(OH)2D.MgCO3
此题是一道典型对比分析选择题材。
由题干给定信息可知:
四个反应中H2SO4的量相等,且恰好完全反应,则说明四种物质与硫酸反应生成的硫酸镁(溶质)的质量也相等,所以判断得到的硫酸镁溶液的溶质质量分数大小的关键是:
确定反应中生成水的多少。
生成水越多,所得溶质量分数越小。
由化学方程式:
Mg+H2SO4===MgSO4+H2↑
MgO+H2SO4===MgSO4+H2O
Mg(OH)2+H2SO4===MgSO4+2H2O
MgCO3+H2SO4===MgSO4+H2O+CO2↑
不难看出,只有Mg(OH)2与此同时H2SO4反应生成的水最多。
溶质的质量分数=
×
100%,反应前,由于硫酸溶液的质量及溶质质量分数是相同的,且四个选项中的物质与水都不反应,所以,原硫酸溶液中的水都成为反应后所有溶液中的水,质量也相等(不变)。
因此,本题求解简捷的思路是:
只要比较各种物质与硫酸反应生成的硫酸镁和生成水的质量,问题就迎刃而解了。
由于硫酸的质量相同,且与各物质正好完全反应,故生成的硫酸镁质量相同,通过反应方程式分析,显然Mg(OH)2与H2SO4作用生成的水最多,故C项符合题意。
选C
根据题意,联系和运用已学过的、已掌握的有关知识,对题目进行全面而周密的分析;
将题中列出的几种答案相互对比,从而快速选择和确定正确答案。
5、淘汰型选择题
例5下列说法正确的是()
A.若两种粒子的核外电子数相同,这两种粒子一定是同种元素
B.若两种粒子的质子数相同,这两种粒子一定是同种元素
C.若两种粒子是同种元素,这两种粒子的质子数一定相同
D.若两种粒子是同种元素,这两种粒子的最外层电子数一定相同
本题可用淘汰法解答,解题步聚为:
①审题:
明确题目要知道怎样条件下的两种粒子才可能是同种元素;
②淘汰:
先根据两种粒子是同种元素,则这两种粒子的最外层电子数均可不一定相同。
可淘汰D,因为同种元素的两种粒子其核外电子总数和最外层电子数均可不一定相同。
同时知道C应为题中答案。
同种元素的两种粒子,其核内质子数一定相同。
反过来,具有相同质子数的两种粒子不一定是同种元素。
如果是具有相同质子数的两种原子,那么,它们是同种元素,但由于粒子可能是离子、原子、分子等,故可淘汰B。
同理可淘汰A,因为具有相同的核外电子数的两种粒子,若一为原子,一为离子,那么它们一定不是同种元素。
根据题目提供的条件和所提出的问题进行分析对比,直接淘汰不合理的选项;
或通过分析,确定某一选项,进而采用对比取舍手段,根据这一确定(选项)否定其他选项。
做到明辨是否,去假存真。
6、平均值型计算选择题
例6两种金属粉末的混合物30g,与足量的稀硫酸反应,只生成氢气1g,则这种混合物中的两种金避可能是()A.Mg和AlB.Zn和FeC.Mg和FeD.Al和Fe
由题意可知,题中提供的金属有四种,它们与稀硫酸反应的化学方程式如下:
Mg+H2SO4=MgSO4+H2↑
242
Fe+H2SO4=FeSO4+H2↑
562
2Al+3H2SO4=Al2(SO4)3+3H2↑
183
Zn+H2SO4=ZnSO4+H2↑
652
无论是哪一个化学方程式,我们都可以使氢气前的化学计量数为1,使氢气下面对应的相对分子质量均为“2”。
这样我们不妨设金属混合物的化学式为R(在其化合物中显+2价),其平均相对原子质量为X,则有:
R+2HCl===RCl2+H2↑
x2
30g1g
=
解得x=60
即得金属混合的的平均相对原子质量为60。
由题目所提供的答案我们可以分析出答案为B,因为对于A来说Mg的相对原子质量为24,Al的相对原子质量虽为27,但当氢气下的相应相对分子质量为2时,我们可以把Al的相对原子质量看成是18。
而24和18相混合,所得的平均相对原子质量只能是大于18且小于24。
如此类推,B中Zn、Fe的相对原子质量分别为65、56,则它们混合后所得的混合的的平均相对原子质量为小于65且大于56的数。
题中x平均相对原子质量正好在这一数当中,故选B。
C中,Mg、Fe相混合后,平均相对原子质量应为一个小于56且大于24的数;
D中Al、Fe相混合,其平均相对原子质量为一个小于56且大于18的数。
注意:
①要理解Al的相对原子质量应为27,为什么这里说可以看作为18。
②Al与酸(稀盐酸、稀硫酸)反应的化学方程式很容易出错。
选B
抓住题目中所提供的物质的反应特征,抓住平均相对原子质量和平均相对分子质量的实质,然后解题,可收到事半功倍的效果。
7、估算型选择题
例7:
20g20%的NaOH溶液与20g20%的H2SO4溶液充分反应后,滴入紫色石蕊试液是()
A.蓝色B.紫色C.红D.无色
此题考察中和反应中反应物间量的关系及指示剂变色的情况,本题的解题关键是NaOH与H2SO4反应生成NaSO4和H2O,若NaOH有剩余,则溶液显碱性,滴入紫色蕊溶液显蓝色;
若H2SO4有剩余,则溶液显酸性,滴入紫色石蕊试液,溶液显红色;
若二者恰好完全反应,则溶液为中性,滴入紫色石蕊试液,溶液仍为此色。
此题有下列解法。
此题可用估算法。
等质量的碱酸中和时,谁的相对分子质量总量小,溶液就显该性。
即酸的相对分子质量总量小,最后溶液显酸性;
碱的相对分子质量总量小,最后溶液显碱性。
因此有:
2NaOH+H2SO4===Na2SO4+2H2O
8098
因为80<98
所以溶液显碱性,滴入紫色石蕊试液,溶液显蓝色。
故本题正确答案为A。
由以上三种解法可知:
思路一样,但解法最为简单的是第三种方法——估算法,所以估算法的解题方法掌握了的话,可以节省解题的时间。
加快解题的速度。
选A
计算型选择题与计算题的区别之一是,前者不必写出计算过程,因此可以根据特征数据进行估算,有时也可将题目的某些数据简化,进行近似计算。
8、差量型选择题
例8现有铜化氧化铜的混合的5.6g,与过量的一氧化碳充分反应后,得到固体物质为4.8克,则原混合的中铜单质的质量分数为()
A.10.2%B.20.4%C.28.6%D.40%
审题与思路与CO发生反应。
由于是充分反应,所以生成物中没有CuO;
得到的固体物质全部是Cu的质量,这4.8g的Cu应是原混合的中混有的Cu的质量和生成的Cu的质量之和。
此题的解法很多。
解法一:
用差量法解题,设混合物中氧化铜的质量为xg,则铜为(5.6-x)g有:
CO+CuO△Cu+CO2质量变化
806480-64=16
xg5.6g-4.8g=0.8g
铜的质量为:
5.6g-4g=1.6g
其中差量16为CuO转变为Cu时的失氧量,也就是反应前后固体的质的质量差。
所以混合的中铜单质的质量分数为:
(单质铜的质量/混合物的质量)100%=(1.6g/5.6g)100%=28.6%
故本题答案为C。
本题的解法有多种,我们在解此题时应该用什么方法,可以由我们自己去确定。
关键是要理解各方法的原理以及含义,明白解题过程,在解题过程中要注意条理清晰、明确。
找准物质量之间的关系,抓住物质间的关纱来解题,能使我们很快地解出结果,而且计算过程简洁明了。
9.规律特殊型选择题
例9相同质量的下列金属分别与足量的稀盐酸反应生成氢气质量最多的是()
A.镁B.铝C.锌D.铁
本题如果抓了规律,则解题十分简洁。
本题为已知等质量的不同金属,比较它们与酸反应产生氢气质量的大小,解这类题目只需找出生成氢气的质量与金属的相对原子质量,化合物的关系即可。
不需逐一写化学方程式,列比例式求解。
设金属R的相对原子质量为r,化合价为+a价。
2R+2aHCl===2RCla+aH2↑
2r2a
m(金属)m(H2)
2r:
2a=(金属):
m(H2)
解得:
m(H2)=a/rm(金属)
即:
m(H2)=(金属元素的化合价/金属的相对原子质量)m(金属)
设本题中等质量的金属为1g,所以有
A.m(H2)=(2/24)×
1g=1/12gB.m(H2)=(3/27)×
1g=1/9g
C.m(H2)=(2/65)×
1g=1/25.5gD.m(H2)=(2/56)×
1g=1/28g
故本题正确答案为B。
化学知识有许多规律,熟练地掌握和运用这些规律,有助于我们解题;
化学解题方法有许多特殊法,了解和掌握这些特殊之所在,并运有于解题,可以简化解题步骤,可以从繁中悟出简,从难中觅出易。
10、综合分析型选择题
例11取一定质量的CO和CO2的混合气体,通入足量的Ba(OH)2溶液中,充分反应后过滤,发现生成的沉淀和所取的混合气体质量相等,则混合气体中,碳原子与氧原子的个数比为()
A.1:
1B.1:
2C.28:
44D.181:
209
题中涉及的反应有:
CO2+Ba(OH)2===BaCO3↓+H2O,由题意知:
m(CO)+m(CO2)=m(BaCO3),因BaCO3的相对分子质量为197,不妨设生成的BaCO3的质量为197g,则CO和CO2的总质量也为197g,然后利用有关化学方程式及化学式即可求解。
因为CO2+Ba(OH)2=BaCO3↓+H2O,由题给条件m(BaCO3)=(CO)+m(CO2),设生成BaCO3质量为197g,则原混合气体中CO2质量为44g,CO质量为:
197g—44g=153g。
原混合气体中CO和CO2分子个数比为:
153/28:
44/44=153:
28
则原混合气体中碳原子与氧原子的个数比为:
(153+28):
=181:
209。
选D
本题为无数据计算题,既考查了化学方程式的计算,又考查了分子、原子个数比的计算,综合性强,较好地考查了学生的发散思维能力、逻辑思维能力和综合分析能力。
解答此题的关键是要反握物质(或元素)质量与分子(或原子)个数间的关系。
对于这种无数据的计算题,我们要抓住变化的本质、透彻审题,把握题设中关键的要点,根据题给等量关系,巧妙选取有关纯净物的相对分子质量(或相对原子质量)作为特殊值,便可化繁为简,化难为易。
有的化学题目知识综合性较强,知识的容量大。
解答时要充分地利用所学知识以及知识间的联系,运用已掌握的有关知识,对题目进行全面而周密地分析,将多种方法应用于解题之中,以求出正确的答案。
课内练习与训练
2009年中考化学选择题100精选
1、下列除杂(括号内的是杂质)所选试剂合理的是(
)
A、Cu(Zn)
稀盐酸
B、CO2气体(HCl)氢氧化钠溶液
C、CuO(Cu)浓硫酸
D、Na2SO4溶液(Na2CO3)
氯化钡溶液
2、除去下列物质中的少量杂质,所用试剂(括号内的物质)不正确的是(
A、氮气中的氧气(铜)
B、二氧化碳气体中的水蒸气(浓硫酸)
C、碳酸钙中的氯化钠(水)
D、氯化钠溶液中的碳酸钠(硫酸)
3、除去下列各组物质中的杂质,所用试剂和方法均正确的是(
物质
杂质
除杂所用的试剂和方法
A
H2
HCl气体
先通过NaOH溶液,再通过浓硫酸
B
NaOH溶液
Ba(OH)2溶液
先加入CuSO4溶液、过滤
C
CO气体
CO2气体
通过灼热的CuO
D
Cu(OH)2固体
CuCl2
加入适量的稀盐酸
4、要将待提纯的物质中杂质(括号内为杂质)除去,所用试剂和方法均正确的是(
选项
待提纯物质
选用试剂
操作方法
CuCl2(MgCl2)
镁片
过滤
CaO(CaCO3)
盐酸
蒸发
Cu(Fe)
稀硫酸
FeCl3溶液(盐酸)
氢氧化钠溶液
滴加
5、欲除去下列物质中的少量杂质,所用试剂或方法正确的是(
试剂或方法
CO2
NaOH溶液
NaNO3溶液
Na2SO4溶液
CO2
CO
点燃
CuO
KNO3
H2O
6、下列除去杂质的方法中,错误的是(
CaCl2溶液
HCl
过量CaCO3、过滤
Ca(OH)2
过量Na2CO3溶液、过滤
FeCl2溶液
CuCl2
过量铁粉、过滤
CH4
H2O
通过盛浓硫酸的洗气瓶
7、不能用于区别稀硫酸和氢氧化钠溶液的是(
A、紫色石蕊试液
B、NaCl溶液
C、BaCl2溶液
D、CuSO4溶液
8、下列物质中,不能用来鉴别CO和CO2的是(
A、澄清石灰水
B、观察颜色
C、灼热的氧化铜
D、紫色的石蕊试剂
9、某生在化学晚会上表演如下魔术:
用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。
该生先后所用的无色液体可能是(
A、石蕊溶液、稀硫酸
B、酚酞溶液、“雪碧”饮料
C、NaOH溶液、酚酞溶液
D、CuSO4溶液、NaOH溶液
10、为了区别O2与CO2两瓶(或两种)无色气体,下列方法中不可行的是(
A、分别通入紫色石蕊溶液中
B、用燃着的木条分别伸入瓶中
C、分别倒入少量NaOH溶液,振荡
D、用塑料可乐瓶分别盛满上述两种气体,各倒入1/5容积的水,盖紧瓶盖,振荡
11、下列实验装置或实验操作不正确的是(
12、下列变化不能通过一步反应实现的是(
A、Cu→Cu(OH)2
B、Zn→Ag
C、CaCl2→CaCO3
D、Na2CO3→NaOH
13、把氧化铜和铁粉的混合物加到一定量的盐酸中,搅拌让他们充分反应后,过滤。
取滤液加入少量铁粉,无任何现象。
则下列判断正确的是(
A、滤渣中不含铜
B、滤渣可能是铜和铁的混合物
B、滤液中含FeCl2和CuCl2
D、滤液中含FeCl2和HCl
14、实验室里用氯化钾固体配制一定溶质质量分数的氯化钾溶液时,下列仪器中,不必用到的是(
A、托盘天平
B、烧怀
C、量筒
D、漏斗
15、下列实验操作中,正确的是(
16、鉴别日常生活中的下列物品,方法不正确的是(
鉴别的物质
方
法
硬水和软水
加肥皂水、搅拌,观察产生泡沫的多少
食盐和白砂糖
尝味道
棉布料和化纤布料
灼烧、闻气味
蒸馏水和矿泉水
观察颜色
17、为了探究二氧化碳的性质,思译同学进行如右图所示的实验。
你认为该实验不能说明的是(
)
A、CO2不能燃烧
B、CO2不能支持燃烧
C、CO2的密度比空气大
D、CO2能与水反应
18、为了测定氧气在空气中的体积分数,实验室采用燃烧法除去一瓶空气中的氧气,应选用的是(
A、红磷
B、木炭
C、蜡烛
D、硫粉
19、给试管里的固体物质加热,操作方法正确的是(
A、用外焰给物质加热
C、加热时试管碰着灯芯
B、加热前未给试管进行预热
D、加热时试管口向上倾斜
20、下列物质久置于空气中会发生变化,其变化原因与空气成分无直接关系的是(
A、生石灰
B、盐酸
C、烧碱
D、铁钉
21、在一个大萝卜上挖个小洞,向小洞中注入饱和食盐溶液,过一段时间后将洞内的食盐溶液倒出。
在相同的温度下,发现倒出的食盐溶液还可溶解少量的食盐,这说明倒出的食盐溶液(
A、是氯化钠的不饱和溶液
B、氯化钠溶解度降低
C、是氯化钠的饱和溶液
D、氯化钠溶解度升高
22、下列试剂能一次性鉴别出NaOH、稀盐酸、NaCl三种溶液的是(
A、Na2CO3溶液
B、澄清石灰水
C、酚酞试液
D、紫色石蕊试液
23、将N2、CO、HCl三种混合气体依次通过NaOH溶液、浓硫酸、灼热的CuO,假设每次处理均能完全反应(或吸收)。
则最后排出的气体是(
A、N2、CO2
B、H2O(气)、N2
C、N2、CO
D、HCI、CO
24、下列实验操作不正确的是(
26、在实验的过程中多次重复实验的主要原因是为了(
A、得到较多的数据
B、避免偶然现象,使结果更真实
C、实验失败后重新再做
D、得出不同的结论
27、下列实验基本操作或事故处理,正确的是(
A、为了节约药品,将用剩的药品放回原试剂瓶
B、酒精灯打翻着火,立即离开
C、浓硫酸沾在皮肤上用水冲洗
D、有腐蚀性的药品直接放在天平托盘上称重
25、如右图所示,打开止水夹,将液体A滴入试管②中与固体B接触。
若试管①中的导管口没有气泡产生,则液体A和固体B的组合可能是下列中的(
A、稀盐酸和铁
B、水和生石灰
C、水和氢氧化钠
D、水和氯化钠
28、试管内壁附着的下列物质中,不能用稀盐酸浸泡而除去的是(
A、氯化铁溶液与氢氧化钠溶液反应后留下的红褐色固体
B、碱式碳酸铜受热分解后的黑色固体[Cu2(OH)2CO3△2CuO+H2O+CO2↑]
C、用足量氢气还原氧化铜后留下的红色固体
D、盛放石灰水后留下的白色固体
29、某自然科学兴趣小组,设计了如右图所示的装置,用来研究不同金属跟稀硫酸反应的快慢。
他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中。
(“+”越多表示产生的气泡越多)。
如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是(
A、镁
B、铝
C、铁
D、锌
30、下列各组物质投入水中,搅拌后能得到无色、澄清溶液的是(
A、KNO3、HCl、CuCl2
B、Ba(OH)2、BaCl2、、Na2SO4
C、Na2CO3、NaCl、Ca(OH)2
D、NaOH、KCl、H2SO4
32、下列装置操作图不能用于检查气密性的是(