备考突破高三化学专题强化集训化学反应原理强化练文档格式.docx
《备考突破高三化学专题强化集训化学反应原理强化练文档格式.docx》由会员分享,可在线阅读,更多相关《备考突破高三化学专题强化集训化学反应原理强化练文档格式.docx(21页珍藏版)》请在冰豆网上搜索。
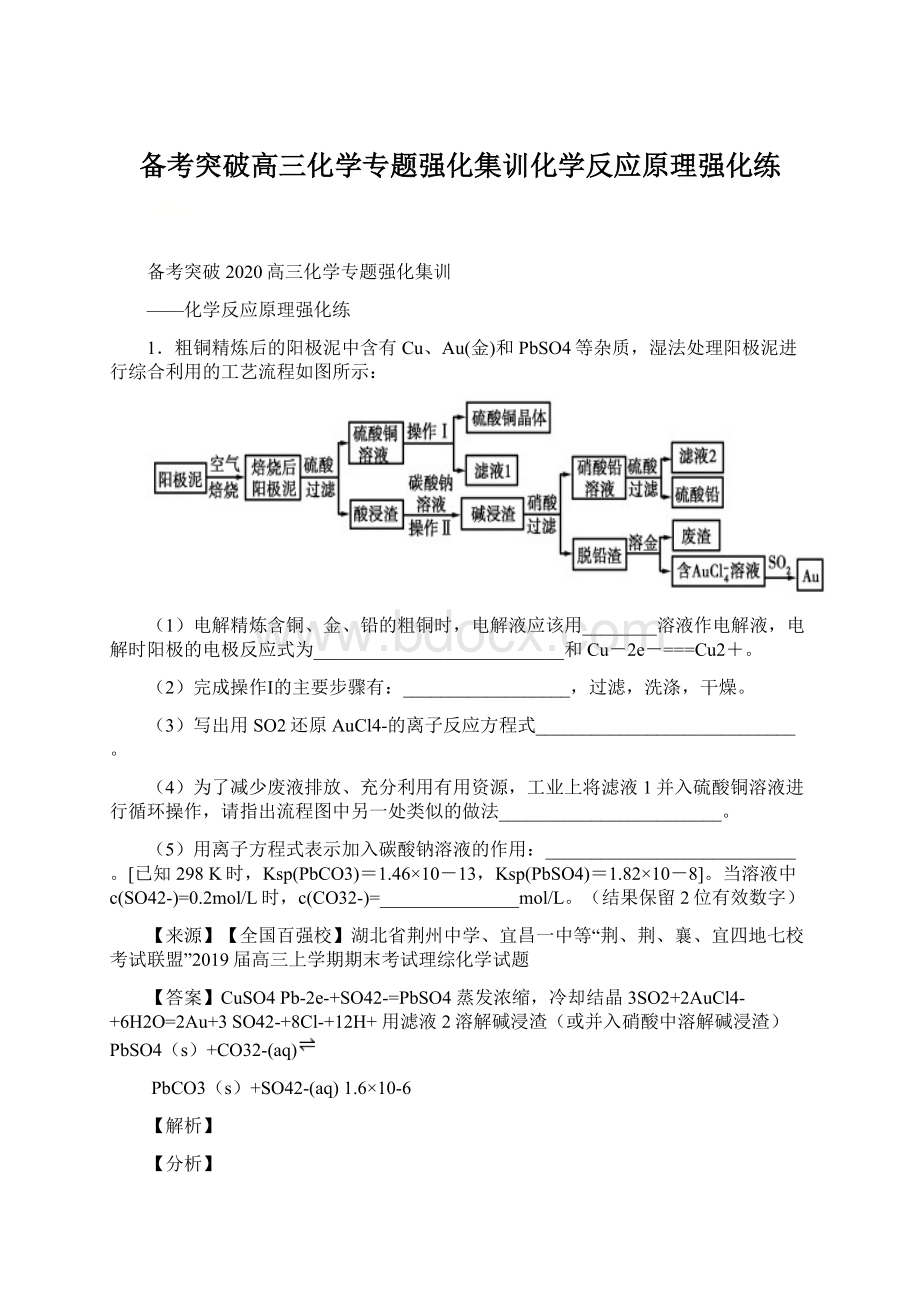
粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤、干燥获得硫酸铜晶体;
Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;
脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au,以此解答。
【详解】
脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au,
(1)电解精炼粗铜时一般用硫酸铜溶液作电解质溶液;
电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为:
Pb-2e-+SO42-=PbSO4;
因此,本题正确答案是:
CuSO4;
(2)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
蒸发浓缩,降温结晶;
(3)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:
3SO2+2AuCl4-+6H2O=2Au+3SO42-+8Cl-+12H+;
(4)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液2,此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤走硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣;
用滤液2溶解碱浸渣(或并入硝酸中溶解碱浸渣);
(5)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,离子方程式要注意标明状态,方程式为:
PbSO4(s)+CO32-(aq)
PbCO3(s)+SO42-(aq);
当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=
×
c(SO42-)=
0.2mol/L=1.6×
10-6mol/L。
1.6×
10-6。
2.NaAlH4(四氢铝钠)是有机合成的重要还原剂。
某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3,MgO和SiO2、等杂质制备四氢铝钠的工艺流程如下:
资料显示:
NaH、NaAlH4遇水蒸气发生剧烈反应。
请回答下列问题:
(1)NaAlH4中氢元素的化合价为___________。
(2)试剂A中溶质的阴、阳离子所含电子数相等,其电子式为___________。
在空气中灼烧滤渣2,得到的固体的主要成分为___________(填化学式)。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式:
___________。
(4)实验前要保证NaH与AlC13反应的装置干燥,其目的是___________________。
(5)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图所示。
当硫酸浓度大于C0mol·
L-1时,浸出率降低的原因可能是___________。
(6)测定NaAlH4粗产品的纯度。
称取mgNaAlH4粗产品按如图所示装置进行实验,测定产品的纯度。
①“安全漏斗”中“安全”的含义是____________________________________________。
②已知实验前B管读数为xmL,向A中加入足量蒸馏水,当A中反应完全后,冷却至室温B管读数为ymL(均折合成标准状况)。
则该产品的纯度为___________(用含m、x和y的代数式表示)。
③若实验前读数时B管和C管液面相平,实验后读数时B管液面低于C管,则测得的结果___________(填“偏高”“偏低”或“无影响”)
【来源】河北省衡水中学2019届高三统一联合考试理科综合化学试题
【答案】-1价
Fe2O3、MgOAlO2-+HCO3-+H2O=Al(OH)3↓+CO32-防止NaH、NaAlH4与水蒸气反应硫酸浓度增大,铝片与硫酸发生钝化加入液体能起液封作用,避免气体从漏斗中逸出
偏低
(1)根据化合物中各元素化合价代数和为0进行计算;
(2)试剂A为强碱,将铝元素转化成偏铝酸盐,由于试剂A中溶质的阴离了和阳离子所含电子数相等,则试剂A为氢氧化钠。
滤渣1的主要成分是二氧化硅,滤渣2的主要成分是氢氧化铁和氢氧化镁。
在空气中灼烧生成氧化铁、氧化镁;
(3)偏铝酸钠和碳酸氢钠反应类似于较强酸制备较弱酸;
(4)NaH、NaAlH4均能够与水蒸气反应;
(5)浓硫酸与铝片发生纯化,反应减慢;
(6)①“安全"
的含义是避免气体逸出。
从安全漏斗的结构看出,上部液体不能完全滴入烧瓶,起到了液封作用;
②根据反应NaAlH4+H2O=NaAlO2+4H2↑进行求算;
读数时C管液面高于B管,存在液压差,导致测得的H2的体积(y)偏小,使结果偏低。
(1)NaAlH4中钠元素为+1价,铝元素为+3价,根据化合物中各元素化合价代数和为0,则氢元素的化合价为-1价;
其电子式为
;
在空气中灼烧生成Fe2O3、MgO;
(3)偏铝酸钠和碳酸氢钠反应类似于较强酸制备较弱酸,滤液2与滤液3反应的离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;
(4)NaH、NaAlH4均能够与水蒸气反应,实验前要保证NaH与AlC13反应的装置干燥,其目的是防止NaH、NaAlH4与水蒸气反应;
(5)浓硫酸与铝片发生纯化,反应减慢,浸出率降低;
从安全漏斗的结构看出,上部液体不能完全滴入烧瓶,起到了液封作用,避免气体逸出;
②NaAlH4+H2O=NaAlO2+4H2↑
n(H2)=
,n(NaAlH4)=
,
(NaAlH4)=
。
若反应完后,读数时C管液面高于B管,存在液压差,导致测得的H2的体积(y)偏小,使结果偏低。
3.某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:
(废料中的其他金属含量较低,对实验影响可忽略)
已知:
①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×
10-5,Ksp(AgCl)=1.8×
10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:
1)。
氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。
HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
【来源】【百强校】东北师大附中、重庆一中等六校2019届高三1月联考(期末)理综化学试题
【答案】粉碎废料、适当增加空气量、搅拌等加热浓缩降温结晶为提高Ag的回收率3NaClO+2Ag+H2O=2AgCl+NaCl+2NaOH+O2↑Ag2SO4(s)+2Cl-(aq)
2AgCl(s)+SO42-(aq)3.7×
1014有污染性气体生成
(1)从外界条件对反应速率的影响来分析,如粉碎废料、适当增加空气量、搅拌等;
(2)操作IV是从溶液中获得硫酸铜晶体;
(3)渣料中含有少量银和硫酸银(微溶),必须回收;
(4)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,且AgCl和NaCl的物质的量之比为2:
1,结合电子得失守恒和质量守恒写出方程式。
AgCl比Ag2SO4溶解度更小,由此写出沉淀转化的方程式;
根据沉淀转化的方程式,结合两种物质的Ksp计算平衡常数K;
用硝酸有污染性气体生成。
(1)从外界条件对反应速率的影响来分析,操作I中为了加快空气熔炼速率,可以采取粉碎废料、适当增加空气量、搅拌等;
(2)操作IV是从溶液中获得硫酸铜晶体,通常经过加热浓缩、降温结晶、过滤、洗涤和干燥,可以得到硫酸铜晶体;
(3)渣料中含有少量银和硫酸银(微溶),必须回收,洗涤滤渣II,与粗银合并,目的是为提高Ag的回收率。
1,结合电子得失守恒和质量守恒:
3NaClO+2Ag+H2O=2AgCl+NaCl+2NaOH+O2↑;
AgCl比Ag2SO4溶解度更小,由此写出沉淀转化的方程式:
Ag2SO4(s)+2Cl-(aq)
2AgCl(s)+SO42-(aq);
根据沉淀转化的方程式,结合两种物质的Ksp计算,Ksp(Ag2SO4)=1.2×
10-10,平衡常数K=c(SO42-)/c2(Cl-)=Ksp(Ag2SO4)/[Ksp(AgCl)]2=1.2×
10-5/(1.8×
10-10)2=3.7×
1014;
HNO3也能氧化Ag,生成氮的氧化物,从反应产物的角度分析,以HNO3代替NaClO的缺点是有污染性气体生成。
4.钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。
广泛应用于钢铁、航空航天、能源、化工等领域。
工业上常用钒炉渣(主要含FeO•V2O3,还有少量SiO2、P2O5等杂质)提取V2O5的流程如图:
(1)焙烧的目的是将FeO•V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价,写出该反应的化学方程式_________________________________
(2)加MgSO4溶液的步骤中,滤渣的主要成分是_____________(用化学式表示)。
(3)沉钒过程中的发生反应的离子方程式为_________________,得到的固体物质往往需要洗涤,写出实验室洗涤NH4VO3沉淀的操作方法_______________。
(4)元素钒在溶液中还可以以V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)等形式存在.某利用钒元素微粒间的反应来设计的可充电电池的工作原理如图示,已知溶液中还含有1mol硫酸,请回答下列问题:
①充电时,左槽电极上发生的电极反应式为________________
②放电过程中,右槽溶液颜色变化为_______________________,若此时外电路转移了3.01×
1022个电子,则左槽溶液中H+的变化量Δn(H+)=_________。
【来源】江西省红色七校2019届高三第二次联考理科综合化学试题
【答案】4FeO•V2O5+4Na2CO3+5O2
8NaVO3+2Fe2O3+4CO2MgSiO3Mg3(PO4)3NH4++VO3-=NH4VO3↓往漏斗中加水至浸没沉淀,让水自然流下,重复2-3次VO2++H2O-e=VO2++2H+紫色变为绿色0.05mol
钒炉渣加入碳酸钠在空气中焙烧,生成NaVO3、氧化铁、硅酸钠、磷酸钠,水浸后得到滤渣中含有氧化铁,滤液为NaVO3、硅酸钠、磷酸钠的水溶液,滤液中加入硫酸镁生成生成难溶的硅酸镁、磷酸镁沉淀,过滤后向溶液中再加入硫酸铵生成NH4VO3沉淀,NH4VO3灼烧生成V2O5。
根据以上分析,
(1)FeO•V2O3与碳酸钠、氧气在高温条件下反应生成NaVO3、Fe2O3、CO2,该反应的化学方程式是4FeO•V2O5+4Na2CO3+5O2
8NaVO3+2Fe2O3+4CO2。
(2)加入MgSO4溶液生成硅酸镁、磷酸镁沉淀,所以滤渣的主要成分是MgSiO3、Mg3(PO4)3。
(3)沉钒过程中NaVO3与(NH4)2SO4发生反应生成NH4VO3沉淀,反应的离子方程式为NH4++VO3-=NH4VO3↓,实验室洗涤NH4VO3沉淀的操作方法是:
往漏斗中加水至浸没沉淀,让水自然流下,重复2-3次;
(4)①充电时,外接电源的正极与电池的正极相连,左槽电极为阳极,失电子发生氧化反应,钒元素化合价升高,发生的电极反应式为VO2++H2O-e-=VO2++2H+;
②放电过程中,右槽是负极,负极失电子钒元素化合价升高,由V2+变为V3+,溶液颜色由紫色变为绿色,放电时正极反应为VO2++2H++e-=VO2++H2O,若此时外电路转移了3.01×
1022个电子,通过电极反应消耗氢离子0.1mol,同时0.05mol氢离子由右槽进入左槽,则左槽溶液中H+的变化量Δn(H+)=0.1-0.05=0.05mol。
【点睛】
本题考查物质制备工艺流程,需要熟练掌握元素化合物性质;
对工艺流程题目关键是理解整个过程,常涉及物质的分离提纯、原理的分析评价、陌生方程式书写等,侧重考查学生分析能力、知识迁移运用能力。
5.工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:
(1)软锰矿“粉磨”的目的是___________。
(2)“浸渣”的主要成分是___________。
(3)经检测“浸取液”中无Fe2+,“浸取"
时MnO2发生反应的离子方程式为___________。
(4)在“沉锰”操作中,不能用Na2CO3代替NH4HCO3,其原因是___________。
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解应采用___________离子交换膜(填“阴”或“阳”),阳极的电极反应式为___________。
(6)为充分利用“滤渣1”,需测定滤渣中Al元素的含量,设计以下方案。
①将mg滤渣处理成amL溶液;
②取少量①中溶液用EDTA滴定测得溶液中Fe3+、Al3+的浓度之和为bmmol/L;
③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,离子方程式为___________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。
该样品中Al元素的质量分数为___________(用含字母的表达式表示)。
【来源】湖北省武汉市2019届高三2月调研理科综合试题(化学部分)
【答案】加快浸取速率二氧化硅MnO2+2Fe2++4H+=Mn2++2Fe3++2H2ONa2CO3溶液碱性较强,会导致生成氢氧化物沉淀(碱式碳酸锰)阴2H2O-4e-=4H++O2↑2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O
100%
(1)软锰矿是固体物质,将其“粉磨”的目的是增大物质的表面积,以便于在用稀硫酸和FeSO4溶液浸取时反应速率大大加快;
(2)软锰矿主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2,用硫酸和FeSO4浸取时,FeCO3、Al2O3与硫酸反应产生FeSO4、Al2(SO4)3进入溶液,FeSO4与MnO2在酸性条件下发生氧化还原反应:
MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,而SiO2不能发生反应,所以“浸渣”的主要成分是二氧化硅(或写为SiO2);
(3)经检测“浸取液”中无Fe2+,说明Fe2+在“浸取"
时与具有氧化性MnO2发生了氧化还原反应,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)在“沉锰”操作中,不能用Na2CO3代替NH4HCO3,原因是由于CO32-的水解使Na2CO3溶液碱性较强,会导致Mn2+生成氢氧化物沉淀或碱式碳酸锰,影响MnCO3的纯度;
(5)反应产生的MnCO3与稀硫酸反应:
MnCO3+H2SO4=MnSO4+H2O+CO2↑,要采用电解的方法使Mn2+还原为金属Mn,阴极电极反应为:
2Mn2++4e-=2Mn,阳极电极反应为:
2H2O-4e-=4H++O2↑,左边增加4个H+离子,右边减少2个Mn2+的同时剩余2个SO42-,为了维持溶液电中性,右边的SO42-要进入左边,因此要选择阴离子交换膜;
(6)③另取少量①中溶液将Fe3+用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)还原Fe2+,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O;
④将③所得溶液利用吸光度法测得其吸光度为0.400,根据物质的吸光度与Fe2+的浓度关系知该溶液中c(Fe2+)=0.040mmol/L,根据2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O可知c(Fe3+)=c(Fe2+)=0.040mmol/L,因为c(Al3+)+c(Fe3+)=bmmol/L,所以c(Al3+)=(b-0.040)mmol/L,溶液的体积为amL,故n(Al3+)=(b-0.040)mmol/L×
a×
10-3L=a(b-0.040)×
10-6mol,则该样品中Al元素的质量分数为
6.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。
其工业流程如下:
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:
Fe2O3+6H+=2Fe3++3H2Oⅱ:
......
写出ⅱ的离子方程式:
____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):
____________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;
向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:
_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
【来源】闽粤赣三省十校2019届高三下学期联考理科综合化学试题
【答案】2Fe3++SO2+2H2O=2Fe2++SO42-+4H+Mn2+Fe2+SO2(H2SO3)、FeSO490℃防止NH4HCO3受热分解,提高原料利用率Mn2++2HCO3-=MnCO3↓+CO2↑+H2O取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净
分析一下工业流程:
浸锰过程通入过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,过滤Ⅰ所得滤渣为SiO2,加入MnO2氧化,此时溶液中可以被氧化的物质有Fe2+和未反应的SO2,调PH是为了将上一步氧化生成的Fe3+沉淀下来与Mn2+分离,加入NH4HCO3溶液将Mn2+沉淀下来,再经过一系列步骤可得到纯的MnCO3。
(1)用总反应离子方程式减去反应ⅰ可得反应ⅱ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为上一步SO2将Mn4+和Fe3+还原成Mn2+和Fe2+,所以答案为Mn2+、Fe2+;
(3)氧化过程中溶液中具有还原性的物质有Fe2+和未反应的SO2,被MnO2氧化的物质有SO2(H2SO3)、FeSO4;
(4)从图像中可以看出,随着温度的升高,副产物MnS2O6生成率越来越低,当温度到达90℃,生成率基本不变,再升高温度意义不大,并且耗能,故“浸锰”的适宜