巢湖一中学年度第二学期期中教学质量检测卷Word下载.docx
《巢湖一中学年度第二学期期中教学质量检测卷Word下载.docx》由会员分享,可在线阅读,更多相关《巢湖一中学年度第二学期期中教学质量检测卷Word下载.docx(12页珍藏版)》请在冰豆网上搜索。
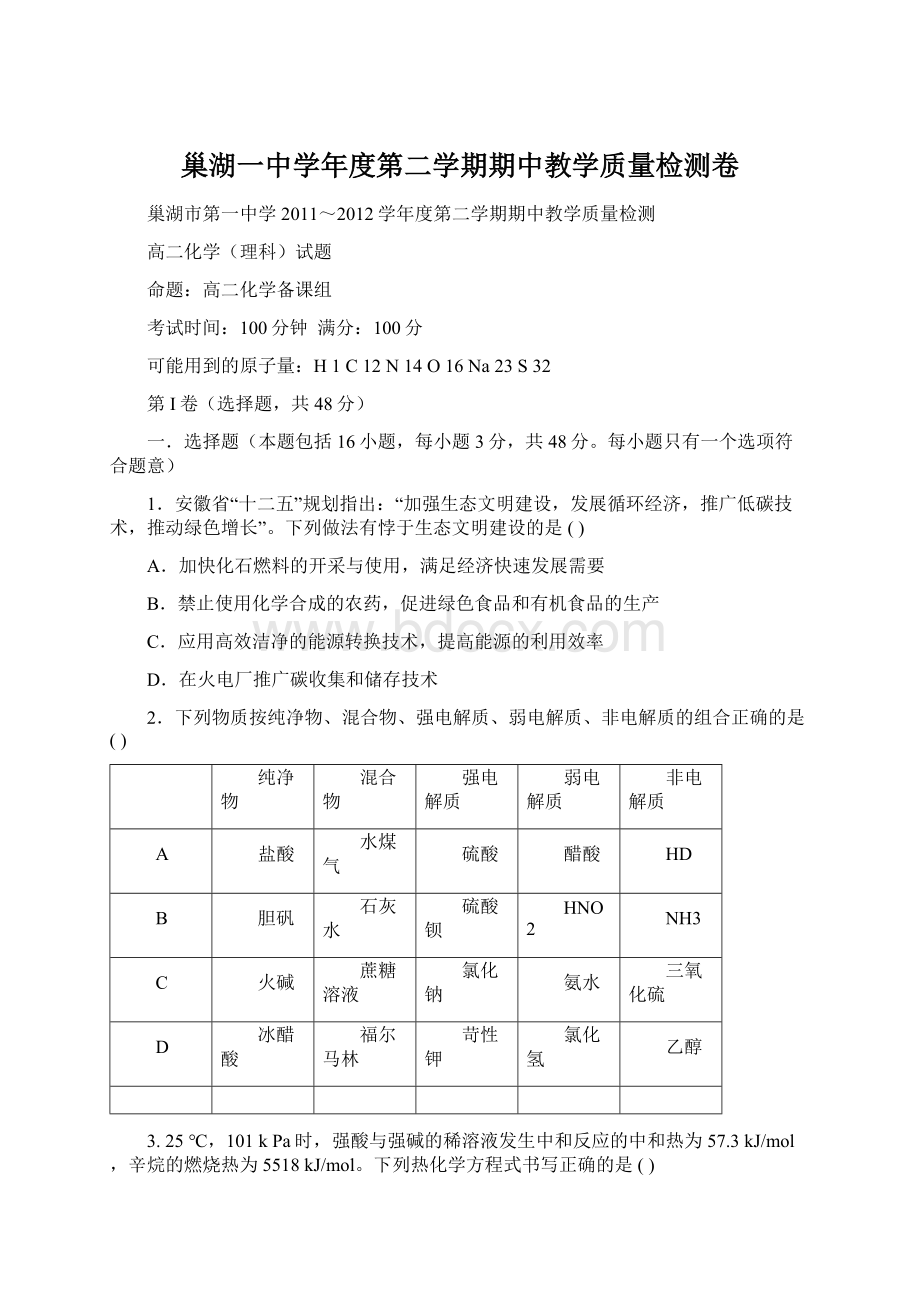
石灰水
硫酸钡
HNO2
NH3
C
火碱
蔗糖溶液
氯化钠
氨水
三氧化硫
D
冰醋酸
福尔马林
苛性钾
氯化氢
乙醇
3.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。
下列热化学方程式书写正确的是()
A.2H+(aq)+
(aq)+
(aq)+2
(aq)=BaSO4(s)+2H
O
(1)
H=
114.6kJ/mol
B.2KOH(aq)+H
SO4(aq)=K
SO4(aq)+2H
O(l)
114.6kJ/mol
C.C8H18(l)+
O
(g)=8CO
(g)+9H
O
5518kJ/mol
D.2C8H18(g)+25O
(g)=16CO
(g)+18H
4.下列实验方法或数据合理的是()
A.用托盘天平准确称取9.8gNaCl固体
B.用25mL碱式滴定管准确量取22.00mL的KMnO4溶液
C.用广泛pH试纸测出某盐酸溶液的pH为3.2
D.用10mL量筒量取7.50mL稀盐酸
5.下列事实不能用勒夏特列原理解释的是:
()
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用高压(20MPa~50Mpa)条件,以提高原料的利用率;
C.在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体;
D.实验室用排饱和食盐水的方法收集氯气。
6.下列各组离子一定能在指定环境中大量共存的是()
A.在c(H+)=10-10mol/L的溶液中Al3+、NH
、Cl-、NO
B.pH值为1的溶液Fe3+、Na+、SO42-、CO
C.水电离出来的c(H+)=10-12mol/L的溶液K+、NH4+、Cl-、ClO-
D.pH值为13的溶液K+、SO
、Na+、S2-
7.为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。
下列叙述中不正确的是()
A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
D.图1实验可通过观察产生气泡的快慢来比较反应速率
8.一定温度下,某密闭容器里发生如下反应:
CO(g)+H2O(g)
CO2(g)+H2(g)(正反应为吸热反应),当反应达到平衡时,测得容器中各物质的物质的量均为nmol。
欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可以采用的是( )
①升高温度 ②增大压强 ③再通入nmolCO2和nmolH2 ④再加入2nmolCO2和2nmolH2(g)
A.①②④B.②④
C.③④D.①②③
9.相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g)
H=-92.6kJ/mol,实验测得起始、平衡时的有关数据如下表:
容器
编号
起始时各物质物质的量/mol
达平衡时体
系能量的变化
N2
H2
①
1
3
放出热量:
23.15kJ
②
0.9
2.7
0.2
Q
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若将容器①体积拉至0.5L,上述反应的反应热ΔH一定不改变
10.如图,表示反应2SO2(g)+O2(g)
2SO3(g),△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法正确的是(
)
A.t1时增加了SO2和O2的浓度,平衡向正反应方向移动;
B.t1降低了温度,平衡向正反应方向移动;
C.t1时减小了压强,平衡向逆反应方向移动;
D.t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动。
11.将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)
Ag2O(s)+SO3(g),2SO3(g)
2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4mol/L,C(SO2)=0.1mol/L,则下列叙述不正确的是()
A.SO3的分解率为20%B.平衡时,v(O2)=0.005mol/(L·
min)
C.容器内气体的密度为40g/LD.加压,容器内固体质量不变
12.反应N2O4(g)
2NO2(g)ΔH=+57kJ·
mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如右图所示。
下列说法正确的是()
A.A、C两点的反应速率:
A>
B.A、C两点气体的颜色:
A深,C浅
C.A、B两点气体的平均相对分子质量:
D.B、C两点化学平衡常数:
B<
13.①pH=2的CH3COOH溶液;
②pH=2的H2SO4溶液;
③pH=12的氨水;
④pH=12的NaOH溶液。
相同条件下,有关上述溶液的比较中,正确的是()
A.水电离的c(H+):
①=②=③=④
B.将②、④溶液混合后,pH=7,消耗溶液的体积:
②<
④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:
②最大
D.向10mL上述四溶液中各加入90mL水后,溶液的pH:
③>
④>
①>
14.下列叙述正确的是()
A.用水稀释0.1mol/L的氨水,则溶液中
增大
B.pH=3的盐酸和醋酸分别升高相同的温度,pH均不变
C.在等体积等pH的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸;
D.两种氨水溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10c1
15.常温时,以下4种溶液pH最小的是()
A.0.01mol/L醋酸溶液
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
16.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是()
第Ⅱ卷(非选择题,共52分)
17.(6分)双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性。
(1)若把H2O2看成二元弱酸,请写出它在水中的电离方程式:
,
。
(2)水电离生成H3O+和OH—叫做水的自偶电离。
同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为:
。
18.(6分)在一定温度下,向不同的电解质溶液中加入新物质时溶液的导电性发生变化,其电流强度(I)随物质加入量(m)的变化曲线如图所示。
其中与A图变化趋势一致的是________________(填编号,下同),与B图变化趋势一致的是________________,与C图变化趋势一致的是________________。
①H2SO4溶液中加入适量BaCl2固体
②氢硫酸(H2S)溶液中滴入稀NaOH溶液至过量
③澄清石灰水中通入CO2至过量
溶液中通入适量
⑤Ba(OH)2溶液中滴入H2SO4溶液至过量
19.(6分)今有a·
盐酸b·
硫酸c·
醋酸三种酸:
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。
(用a、b、c表示,下同)
(2)完全中和含等物质的量的NaOH的溶液,消耗相同pH的上述三种酸溶液的体积由大到小的顺序是___________;
(3)完全中和含等物质的量的NaOH的溶液,消耗相同物质的量浓度的上述三种酸溶液的体积由大到小的顺序是___________;
20.(9分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。
为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化
如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·
min)。
②该反应的平衡常数表达式为K=__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1molCO2和3molH2
⑵有人提出,可以设计反应2CO(g)=2C(s)+O2(g)通过其自发进行来消除CO的污染。
该方案_______(填“是”、“否”)可行,理由是:
______________________________________________。
21.(9分)某实验小组拟定用实验验证醋酸是弱酸。
甲、乙两同学的方案分别是:
甲:
①称取一定量的冰醋酸准确配制0.1mol/L的醋酸溶液100mL
②用pH试纸测出该溶液的pH,即可证明醋酸是弱酸。
乙:
分别配制盐酸和醋酸溶液,在相同温度下比较两溶液的导电性。
回答下列问题:
(1)简要说明pH试纸的使用方法:
。
(2)甲方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH1(选填“>”“<”“=”,下同);
乙方案中,若达目的,配制的两溶液应满足的条件是_________________________必须相等,证明醋酸是弱酸的现象是___________________。
22.(10分)某学生用0.2000mol·
L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
调节液面至“0”或“0”刻度线稍下,并记下读数;
移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号),
若测定结果偏高,其原因可能是。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:
(3)如右图是某次滴定时的滴定管中的液面,其读数为mL。
(4)根据下列数据:
请计算待测盐酸溶液的浓度:
mol/L。
滴定次数
待测体积(mL)
标准烧碱体积(mL)
滴定前读数
滴定后读数
第一次
20.00
0.40
20.40
第二次
2.00
24.10
第三次
4.00
24.00
23.(6分)
(1)某温度(t℃)时,测得0.01mol·
L-1NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb=。
(2)25℃时,pH=a的20mL的H2SO4溶液与c(H+)=10-b的200mL的NaOH溶液混合后,溶液呈中性,则a和b满足的关系___________。
高二化学(理科)答题卷
得分:
_____________
一、选择题,共16题,每小题3分,共48分。
题号
2
4
5
6
7
8
答案
9
10
11
12
13
14
15
16
第二部分非选择题(共52分)
17、(6分)
(1)___________________、___________________________;
(2)。
18、(6分)与A图变化趋势一致的是________________(填编号,下同),与B图变化趋势一致的是________________,与C图变化趋势一致的是________________。
19、(6分)
(1)
(2)(3)
20、(9分)
(1)①②K=③
(2)(1分)
理由是:
21、(9分)
(1)简要说明pH试纸的使用方法:
。
(3分)
(2)(2分)
_________________________(2分),_________________________________(2分)。
22、(10分)
(1)_____;
;
(2)判断滴定终点的现象是:
________________________。
(3)读数为mL。
(4)_____________________mol/L。
23、(6分)①该温度下水的Kw=。
②Va︰Vb=。
(2)a和b满足的关系___________。
17、(6分)
(1)H2O2
H++HO2-、HO2-
H++O22-;
(2)2H2O2
H3O2++HO2-。
18、(6分)与A图变化趋势一致的是②(填编号,下同),与B图变化趋势一致的是__③⑤___,与C图变化趋势一致的是__①④___。
19、(6分)
(1)c>a=b
(2)a=b>c(3)a=c>b
20、(9分)
(1)①0.225②K=③CD
(2)否(1分)
该反应△H>0、△S<0,因而△G>0,不能自发进行。
取一小块pH试纸置于洁净的玻璃片上,用玻璃棒蘸取待测液点到pH试纸上,与标准比色卡对照。
(2)>(2分)
_物质的量浓度相等(2分),_接入盐酸溶液的灯泡较亮(或其它正确答案)(2分)。
22、(10分)
(1)_①__;
ABCD(此空不完整不得分);
滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色____。
(3)读数为22.60mL。
(4)0.2000_mol/L。
(注:
(3)(4)两小题未考虑有效数字不得分)
23、(6分)①该温度下水的Kw=1.0×
10-15。
②Va︰Vb=10:
1。
(2)a和b满足的关系__a+b=13_________。