专题3第二单元第2课时Word格式.docx
《专题3第二单元第2课时Word格式.docx》由会员分享,可在线阅读,更多相关《专题3第二单元第2课时Word格式.docx(18页珍藏版)》请在冰豆网上搜索。
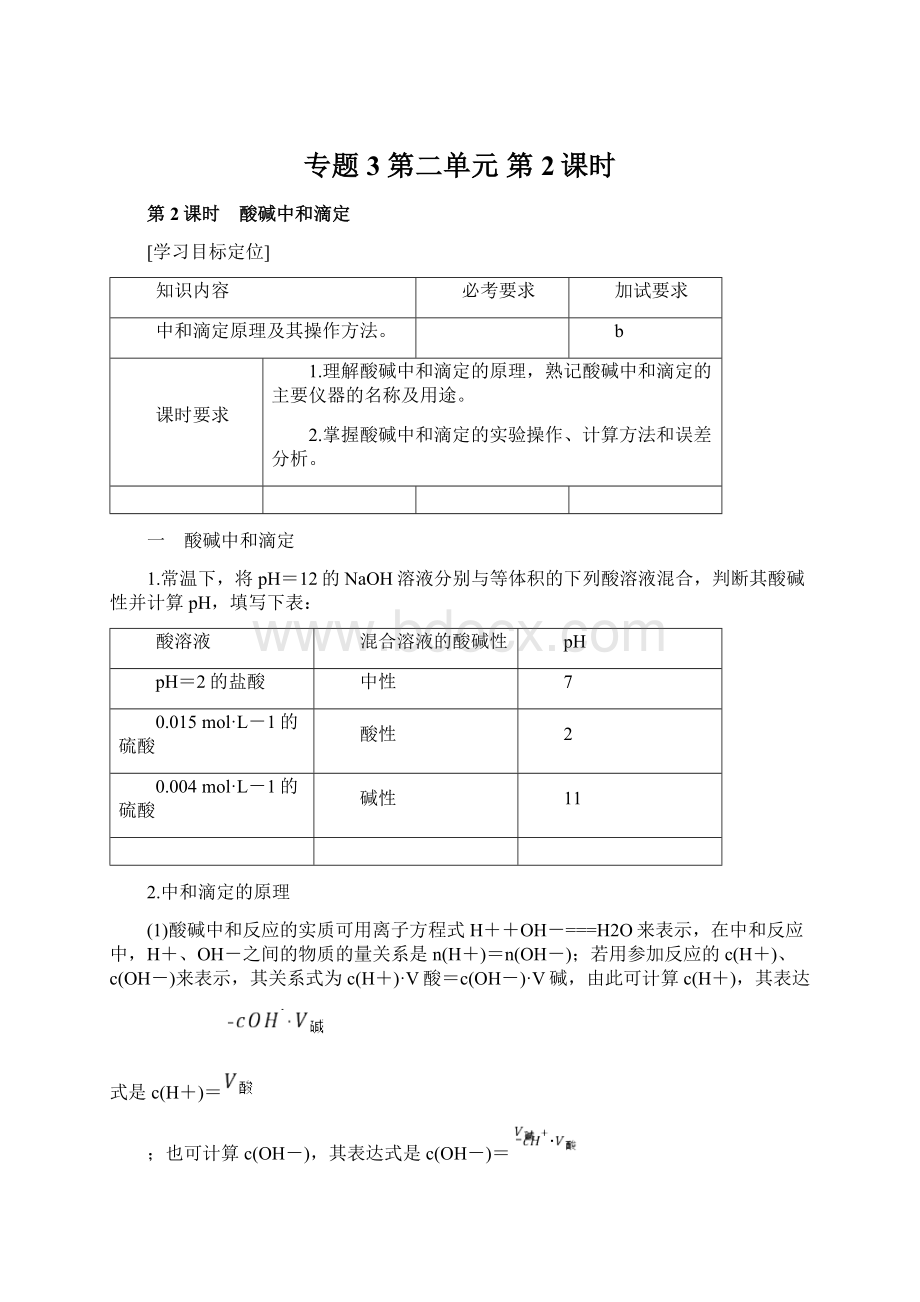
(4)中和滴定的关键是准确判断滴定终点(中和反应恰好反应完全的时刻),其方法是在待测液中加2~3滴指示剂,观察滴定过程中其颜色的变化,常选用的指示剂是酚酞或甲基橙,不用石蕊溶液的原因是石蕊溶液颜色变化不明显且突变范围太宽。
3.主要仪器及使用
酸碱中和滴定所用的主要仪器是锥形瓶和滴定管。
滴定管的上端都标有规格大小、使用温度、“0”刻度;
滴定管的精确读数为0.01mL。
(1)滴定管的分类
①酸式滴定管:
包括玻璃活塞、长玻璃管,可盛放酸性溶液、强氧化性溶液,不能盛放碱性溶液及氢氟酸。
②碱式滴定管:
包括长玻璃管、橡皮管、玻璃球,可盛放碱性溶液。
(2)滴定管的使用方法
①检查仪器:
使用前先检查滴定管活塞是否漏水。
②润洗仪器:
在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗2~3遍。
③加入溶液:
分别将反应液加入到相应滴定管中,使液面位于滴定管0刻度线以上2~3mL处。
④调节起始读数:
在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满溶液,然后调节滴定管液面使其处于某一刻度,准确读取数值并记录。
4.实验操作步骤
酸碱中和滴定的实验步骤可以提炼为6个关键字:
(1)洗(洗涤):
洗涤仪器并进行检漏、润洗。
(2)取(取液):
向酸(碱)式滴定管中注入标准液,向锥形瓶中注入待测液,加入2~3滴指示剂。
(3)滴(滴定):
在锥形瓶下垫一张白纸,向锥形瓶中先快后慢地加入标准液(后面逐滴加入),至指示剂发生明显的颜色变化(如由红色变为无色或红色变为橙色、无色变为粉红色等)且半分钟内不变时,停止滴定。
(4)读(读数):
平视滴定管中凹液面最低点,读取溶液体积。
(5)记(记录):
记录滴定前和滴定终点时滴定管中标准液的刻度,重复滴定2~3次将数据记入表中。
(6)算(计算):
以(V终-V始)为消耗的标准液的体积,取2~3次实验结果的平均值,依据c待=
(一元酸碱)计算待测液的物质的量浓度。
酸碱中和滴定
(1)原理:
酸和碱反应的实质是H++OH-===H2O。
用已知浓度的盐酸(标准液)来滴定未知浓度的NaOH溶液(待测液)的计算公式为c待=
(2)准确判断滴定终点:
最后一滴恰好使指示剂颜色发生明显的改变且半分钟内不变色,即为滴定终点。
(3)滴定操作要点:
左手控制活塞或玻璃小球,右手摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化。
(4)滴定曲线
以滴加酸(或碱)的量为横坐标,以溶液的pH为纵坐标绘出一条溶液的pH随酸(或碱)的滴加量而变化的曲线。
如图所示为用0.1000mol·
L-1NaOH溶液滴定20.00mL0.1000mol·
L-1HCl溶液过程中的pH变化曲线。
由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色发生明显变化,有利于确定滴定终点。
1.
(1)选用以下主要仪器和试剂,是否可以达到测定NaOH溶液浓度的目的?
(填“是”或“否”)。
主要仪器:
滴定管 锥形瓶 烧杯
试剂:
NaOH溶液 0.1000mol·
L-1盐酸
(2)现用物质的量浓度为0.1000mol·
L-1的标准NaOH溶液去滴定VmL未知浓度的盐酸,请填写下列空白:
①用标准NaOH溶液滴定时,应将标准NaOH溶液注入(填“甲”或“乙”)中。
②某学生的操作步骤如下:
A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上2~3mL;
E.调节液面至“0”或“0”刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用字母序号填写)。
上述B步骤操作的目的是。
判断到达滴定终点的实验现象是。
③右上图是碱式滴定管中液面在滴定前后的读数,c(HCl)=mol·
答案
(1)否
(2)①乙 ②BDCEAF 洗去附在滴定管内壁上的水,防止其将标准溶液稀释而带来误差 当滴入最后一滴标准液后,溶液由无色变为浅红色,且半分钟内不褪色 ③
解析
(1)缺少酸碱指示剂,无法判断滴定终点。
(2)①NaOH为强碱,应将NaOH溶液注入碱式滴定管中,故选乙。
②按查漏→水洗→润洗→装液→排气泡→调液面→读数→加待测液和指示剂→滴定→判断终点→读数、记录数据→计算的顺序思考。
判断滴定终点的方法是:
当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不褪色。
③滴定过程中消耗NaOH溶液的体积为(V2-V1)mL,因此c(HCl)=
mol·
2.下列酸碱中和滴定的实验操作或仪器的使用正确的是。
①装置Ⅰ进行酸碱中和滴定(略去部分夹持仪器)
②如图Ⅱ实验装置(固定装置略去)进行操作
③如图Ⅲ所示,记录滴定终点读数为12.20mL
④如图Ⅳ曲线表示用0.1000mol·
L-1NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
⑤滴定管在使用前要用待装液润洗,而锥形瓶不用润洗
⑥酸式滴定管注入Na2CO3溶液之前应检查是否漏液
⑦可用25mL碱式滴定管量取20.0mLKMnO4溶液
答案 ⑤
解析 ①应选用酸式滴定管;
②NaOH溶液不应装入酸式滴定管中;
③读数应为11.80mL;
④HX酸性最弱;
⑤正确;
⑥Na2CO3溶液应注入碱式滴定管中;
⑦应改为可用25mL酸式滴定管量取20.00mLKMnO4溶液。
二 酸碱中和滴定误差分析
1.在酸碱中和滴定前的准备工作中,滴定管用蒸馏水洗净后,还要用标准液润洗2~3次,否则会使标准液实际浓度减小,消耗标准液体积增大,由c待=
可知,所测得的待测液浓度偏大。
2.在滴定前,锥形瓶用蒸馏水洗净后,是否要用待测液润洗?
为什么?
不需要。
因为若用待测液润洗锥形瓶,会使量取的待测液的实际体积增大,消耗标准液的体积增大,使测定结果偏大。
3.滴定管正确的读数方法是视线、刻度线、凹液面在同一水平线上。
试分析下列图示读数对滴定结果的影响:
(1)如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
(2)如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
常见误差分析
类 别
操 作
结果
来自滴定管中产生的误差
滴定管用蒸馏水洗后,未用标准液润洗
偏高
滴定管未用待测液润洗
偏低
盛标准液的滴定管滴定前有气泡,滴定后无气泡
盛标准液的滴定管滴定前无气泡,滴定后有气泡
盛待测液的滴定管滴定前有气泡,滴定后无气泡
盛待测液的滴定管滴定前无气泡,滴定后有气泡
来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液洗
待测液加水稀释
无影响
读数带来的误差
用滴定管量取待测液
先俯视后仰视
先仰视后俯视
标准液
3.下列实验操作不会引起误差的是( )
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂,实验时不小心多加了几滴
D.用标准盐酸测定未知浓度NaOH溶液,实验结束时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
答案 C
解析 A项,锥形瓶一定不要用待测液润洗,否则会使待测液的量偏大,消耗标准液的体积偏大,从而使所测浓度偏大;
B项,冲洗干净的滴定管无论是盛装标准溶液,还是待测溶液,都必须用待装溶液润洗2~3次,否则会使标准溶液或待测溶液比原来溶液的浓度偏小,影响结果;
C项,在滴定过程中,指示剂略多加了几滴,一般不影响实验结果,因为指示剂不会改变反应过程中酸和碱的物质的量;
D项,实验开始时酸式滴定管中无气泡,实验结束时有气泡,会导致所读取的V(HCl)偏小,依据V(HCl)·
c(HCl)=V(NaOH)·
c(NaOH)得所测得的c(NaOH)偏小。
4.下列错误操作中,能造成中和滴定结果偏低的是( )
A.用滴定管量取标准液时,开始时平视,滴定后仰视
B.盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定
C.往锥形瓶中加待测液时,对滴定管读数,开始时仰视,滴定后平视
D.振荡时锥形瓶中液滴飞溅出来
答案 D
酸式碱式莫混用,读数视线要水平;
充满尖嘴不留气,液面不要高于零;
适量滴加指示剂,初始读数要记清;
左手慢慢旋活塞,右手旋摇锥形瓶;
两眼紧盯待测液,颜色突变立即停;
记下刻度来计算,中和滴定操作完。
1.酸碱完全中和时,有关说法正确的是( )
A.溶液一定呈中性
B.酸和碱的物质的量一定相等
C.酸和碱的物质的量浓度相等
D.酸能提供的H+与碱能提供的OH-的物质的量相等
解析 酸碱完全反应时,酸提供的H+与碱提供的OH-的物质的量相等。
2.下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面和记录初始读数 ⑤取一定体积的待测液于锥形瓶中 ⑥滴定操作
A.①③②④⑤⑥B.①②③④⑤⑥
C.②③①④⑤⑥D.④⑤①②③⑥
答案 B
解析 滴定操作的顺序为查漏—洗涤—润洗—注液—滴定。
3.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
碱
酸
石蕊
乙
B
酚酞
甲
C
甲基橙
D
观察内容的选择,我本着先静后动,由近及远的原则,有目的、有计划的先安排与幼儿生活接近的,能理解的观察内容。
随机观察也是不可少的,是相当有趣的,如蜻蜓、蚯蚓、毛毛虫等,孩子一边观察,一边提问,兴趣很浓。
我提供的观察对象,注意形象逼真,色彩鲜明,大小适中,引导幼儿多角度多层面地进行观察,保证每个幼儿看得到,看得清。
看得清才能说得正确。
在观察过程中指导。
我注意帮助幼儿学习正确的观察方法,即按顺序观察和抓住事物的不同特征重点观察,观察与说话相结合,在观察中积累词汇,理解词汇,如一次我抓住时机,引导幼儿观察雷雨,雷雨前天空急剧变化,乌云密布,我问幼儿乌云是什么样子的,有的孩子说:
乌云像大海的波浪。
有的孩子说“乌云跑得飞快。
”我加以肯定说“这是乌云滚滚。
”当幼儿看到闪电时,我告诉他“这叫电光闪闪。
”接着幼儿听到雷声惊叫起来,我抓住时机说:
“这就是雷声隆隆。
”一会儿下起了大雨,我问:
“雨下得怎样?
”幼儿说大极了,我就舀一盆水往下一倒,作比较观察,让幼儿掌握“倾盆大雨”这个词。
雨后,我又带幼儿观察晴朗的天空,朗诵自编的一首儿歌:
“蓝天高,白云飘,鸟儿飞,树儿摇,太阳公公咪咪笑。
”这样抓住特征见景生情,幼儿不仅印象深刻,对雷雨前后气象变化的词语学得快,记得牢,而且会应用。
我还在观察的基础上,引导幼儿联想,让他们与以往学的词语、生活经验联系起来,在发展想象力中发展语言。
如啄木鸟的嘴是长长的,尖尖的,硬硬的,像医生用的手术刀―样,给大树开刀治病。
通过联想,幼儿能够生动形象地描述观察对象。
解析 甲为酸式滴定管,乙为碱式滴定管。
酸碱中和滴定中一般不选用石蕊试液作指示剂,故A项不正确;
酸式滴定管不能盛放碱液,故B项不正确;
C项,滴定管选用不正确。
4.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·
L-1NaOH溶液滴定。
下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
解析 A项,滴定管用蒸馏水洗涤后,还要用待装NaOH溶液润洗,否则将要引起误差,错误;
B项,在用NaOH溶液滴定盐酸的过程中,锥形瓶内溶液由酸性逐渐变为中性,溶液的pH由小变大,正确;
C项,用酚酞作指示剂,锥形瓶中溶液应由无色变为粉红色,且半分钟内不恢复原色时才能停止滴定,错误;
D项,滴定达终点时,发现滴定管尖嘴部分有悬滴,则碱液的体积偏大,测定结果偏大,错误。
5.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是(填字母)。
(2)下列操作合理的是(填字母)。
A.用25mL碱式滴定管量取20.00mLNaHCO3溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol·
L-1的氢氧化钠溶液495.5mL
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示。
则所用盐酸的体积为mL。
(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数
待测氢氧化钠溶液的体积/mL
0.1000mol·
L-1盐酸的体积/mL
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
26.11
第二次
1.56
30.30
28.74
第三次
0.22
26.31
26.09
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):
c(NaOH)=。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定
答案
(1)ab
(2)A (3)26.10 (4)0.1044mol·
L-1(5)CD
解析
(1)量筒、容量瓶无“0”刻度,托盘天平的“0”刻度在刻度尺的最左边。
(2)B项,托盘天平的精确度为0.1g;
C项,量取3.2mL的浓H2SO4应用5mL的量筒;
D项,500mL容量瓶只能配制500mL溶液。
(3)滴定管可估读一位,其体积应为26.10mL。
(4)舍去第二组数据c(NaOH)=
=0.1044mol·
40分钟课时作业
[基础过关]
题组1 仪器的使用
1.某同学在实验报告中记录了下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸
B.用pH试纸测出某溶液pH为3.5
C.用托盘天平称取8.75g食盐
D.用酸式滴定管测出消耗盐酸的体积为15.60mL
一般说来,“教师”概念之形成经历了十分漫长的历史。
杨士勋(唐初学者,四门博士)《春秋谷梁传疏》曰:
“师者教人以不及,故谓师为师资也”。
这儿的“师资”,其实就是先秦而后历代对教师的别称之一。
《韩非子》也有云:
“今有不才之子……师长教之弗为变”其“师长”当然也指教师。
这儿的“师资”和“师长”可称为“教师”概念的雏形,但仍说不上是名副其实的“教师”,因为“教师”必须要有明确的传授知识的对象和本身明确的职责。
要练说,得练听。
听是说的前提,听得准确,才有条件正确模仿,才能不断地掌握高一级水平的语言。
我在教学中,注意听说结合,训练幼儿听的能力,课堂上,我特别重视教师的语言,我对幼儿说话,注意声音清楚,高低起伏,抑扬有致,富有吸引力,这样能引起幼儿的注意。
当我发现有的幼儿不专心听别人发言时,就随时表扬那些静听的幼儿,或是让他重复别人说过的内容,抓住教育时机,要求他们专心听,用心记。
平时我还通过各种趣味活动,培养幼儿边听边记,边听边想,边听边说的能力,如听词对词,听词句说意思,听句子辩正误,听故事讲述故事,听谜语猜谜底,听智力故事,动脑筋,出主意,听儿歌上句,接儿歌下句等,这样幼儿学得生动活泼,轻松愉快,既训练了听的能力,强化了记忆,又发展了思维,为说打下了基础。
解析 量筒的精确度只有0.1mL,pH试纸只能读到整数,托盘天平的精确度为0.1g。
2.在一支25mL的酸式滴定管中加入0.1mol·
L-1的盐酸,其液面恰好在5mL刻度处,若把滴定管中的溶液全部转移到烧杯中,然后用0.1mol·
L-1NaOH溶液进行中和,则消耗NaOH溶液的体积( )
A.大于20mLB.小于20mL
C.等于20mLD.等于5mL
答案 A
解析 V(HCl)>20mL,所以消耗NaOH溶液的体积大于20mL。
3.下列说法正确的是( )
A.用图示仪器Ⅰ准确量取25.00mL酸性KMnO4溶液
B.装置Ⅱ可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验
C.中和滴定时,滴定管用所盛装的待装液润洗2~3次
D.中和滴定实验时,用待测液润洗锥形瓶
解析 酸性KMnO4溶液不能用碱式滴定管量取,A项不正确;
NaOH溶液不能盛装在酸式滴定管中,B项不正确;
中和滴定时滴定管需用待装液润洗,而锥形瓶不能用待测液润洗,C项正确,D项不正确。
题组2 滴定操作及数据处理
4.(2019·
宁波中学月考)盐酸与氢氧化钠溶液相互滴定的滴定曲线如图,下列叙述正确的( )
A.酚酞不能用作本实验的指示剂
B.盐酸的物质的量浓度为1mol·
L-1
C.P点时恰好完全中和,溶液呈中性
D.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
解析 A项,氢氧化钠与盐酸恰好反应时溶液呈中性,盐酸与氢氧化钠溶液相互滴定可用酚酞或甲基橙作指示剂,错误;
B项,根据曲线可以看出盐酸的pH=1,pH=-lgc(H+)=1,所以c(HCl)=c(H+)=0.1mol·
L-1,错误;
C项,根据曲线可以看出P点时pH=7,则c(H+)=c(OH-)、c(Na+)=c(Cl-),说明溶液呈中性,反应恰好完全,正确;
D项,曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸的曲线,错误。
5.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液时,下列操作中不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液
C.滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化
D.读数时,视线与滴定管内液体的凹液面最低处保持一致
解析 A项,滴定管使用前应润洗;
B项,锥形瓶不能用待测液润洗;
C、D两项均符合实验操作。
题组3 误差分析
6.用标准浓度的NaOH溶液滴定未知浓度的盐酸时,下列情况会使盐酸物质的量浓度偏低的是( )
A.碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液
B.碱式滴定管尖端有气泡,滴定后气泡消失
C.记录消耗的碱液时,滴定前平视、滴定后俯视凹液面
D.锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸
解析 未用NaOH溶液润洗滴定管,即NaOH溶液浓度下降,或把气泡误算为NaOH溶液的体积,读取的NaOH溶液的体积均比实际用量大,结果偏高;
滴定前平视,滴定后俯视凹液面,这样读取的NaOH溶液的体积比实际用量小,结果偏低;
锥形瓶中含有蒸馏水,对测定结果无影响。
7.用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
A.试样中加入酚酞作指示剂,用标准酸液进行滴定
B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
C.锥形瓶用蒸馏水洗涤后,直接注入待测溶液进行滴定
D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
解析 此实验过程中,待测值为c(Na2CO3),根据酸与Na2CO3的反应可知,c(Na2CO3)·
V(待测液)=k·
c(酸)·
V(酸)(k为标准酸与Na2CO3反应时的化学计量数之比)。
A项,加入酚酞时,对实验数据无影响;
B项,此操作使V(酸)数值偏大,故使c(Na2CO3)偏大,最终所得Na2CO3质量分数偏高;
C项,此操作对实验数据无影响;
D项,此操作使c(Na2CO3)数值偏小,最终使所得Na2CO3质量分数偏低。
8.下图是用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸的图像,依据图像推出盐酸和NaOH溶液的物质的量浓度是下表内各组中的( )
选项
溶液
c(HCl)/mol·
0.12
0.04
0.03
0.09
c(NaOH)/mol·
解析 由图像可知,30mLNaOH溶液恰好中和10mL盐酸,则3c(NaOH)=c(HCl),表中A、D组属此种情况,但A组中c(HCl)=0.12mol·
L-1,c(H+)=0.12mol·
L-1,pH<1,不符合图像;
D组中c(HCl)=0.09mol·
L-1,pH>1,加入20mLNaOH后溶液的c(H+)=
=1×
10-2mol·
L-1,pH=-lg(1×
10-2)=2,正好符合题意。
[能力提升]
9.某学生用0.2000mol·
L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取