高二化学下学期第二次联考试题Word格式.docx
《高二化学下学期第二次联考试题Word格式.docx》由会员分享,可在线阅读,更多相关《高二化学下学期第二次联考试题Word格式.docx(12页珍藏版)》请在冰豆网上搜索。
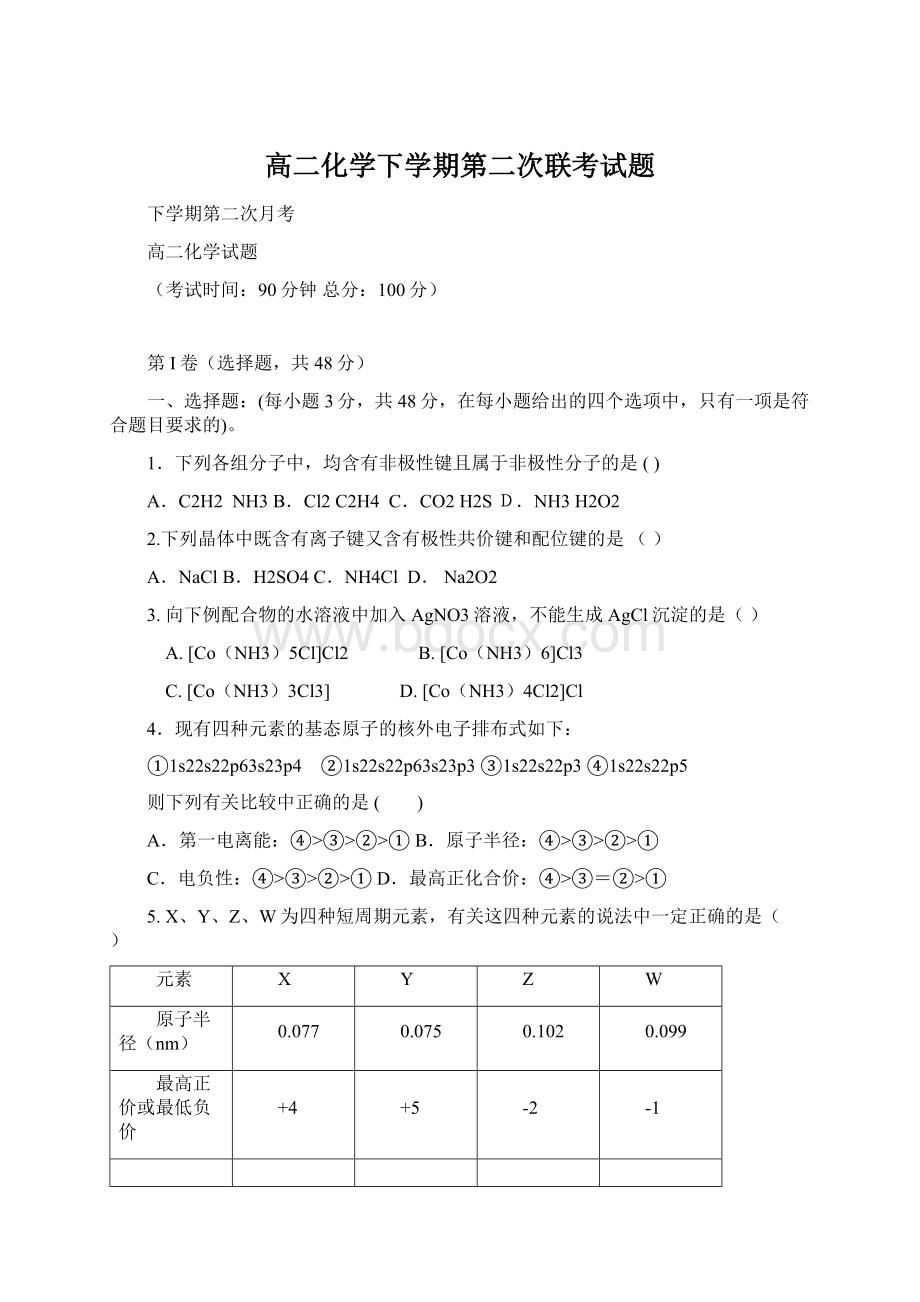
元素
X
Y
Z
W
原子半径(nm)
0.077
0.075
0.102
0.099
最高正价或最低负价
+4
+5
-2
-1
A.1molW的单质参加氧化还原反应时转移的电子数为2mol
B.X与Z形成XZ2时各原子均满足8电子稳定结构
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.Y的氢化物与W的氢化物反应的产物只含有共价键
6.解释下列物质性质的变化规律与物质结构间的因果关系时,与氢键有关的变化规律是()
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.熔点:
Li>
Na>
K>
Rb
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.H2S的熔沸点小于H2O的熔沸点
7.如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为acm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为()
A.
B.
C.
D.
8.实现下列变化时,需克服相同类型作用力的是()
A.金刚石和干冰的熔化B.食盐和烧碱的熔化
C.液溴和液汞的气化D.氨的气化和水的电离
9.下列物质固态时一定是分子晶体的是()
A.酸性氧化物B.碱性氧化物C.含氧酸D.非金属单质
10.下列关于晶体的说法一定正确的是()
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.熔融时化学键没有破坏的晶体一定是金属晶体
11.向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4•H2O。
下列说法不正确的是()
A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子
B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小
C.碱式硫酸铜与氨水反应的离子方程式
Cu2(OH)2SO4+8NH3•H2O=2[Cu(NH3)4]2++SO42-+2OH-+8H2O
D.深蓝色晶体中只含有离子键、配位键和氢键
12.化学反应可视为旧键断裂和新键生成的过程。
键能是形成(拆开)1mol化学键时释放(或吸收)的能量。
已知白磷和P4O6的分子结构如图所示,现提供以下键能(kJ·
mol-1):
P-P:
198,P-O:
360,O-O:
498,则化学反应P4(白磷)+3O2=P4O6的反应
热△H为()
A.-1638kJ·
mol-1B.+1638kJ·
mol-1
C.-126kJ·
mol-1D.+126kJ·
13.中学化学中很多规律都有其使用范围,下列根据有关“规律”推出的结论合理的是()
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
14.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。
已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。
Al2H6球棍模型如下图。
下列有关说法肯定错误的是()
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
15.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。
下列有关分析正确的是()
A.K3C60中只有离子键B.K3C60中碳元素显-3价
C.C60与12C互为同素异形体D.该晶体在熔融状态下能导电
16.通常把原子总数和价电子总数相同的分子或离子称为等电子体。
人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.BF3和CO
是等电子体,均为平面正三角形结构
B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
C.NH3和PCl3是等电子体,均为三角锥形结构
D.CH4和NH
是等电子体,键角均为60°
第Ⅱ卷
二、非选择题(共52分)
17.(15分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;
J元素最低负化合价的绝对值与其原子最外层电子数相等;
M是地壳中含量最多的金属元素。
J
R
(1)M的离子结构示意图为_____;
元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_______________。
(3)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>
0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项
a
b
c
d
x
温度
加入H2的物质的量
加入甲的物质的量
y
平衡常数K
甲的物质的量
甲的转化率
生成物物质的量总和
(4)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为:
______________________________________________________________。
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
18.(16分)请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光B.焰色反应C.原子光谱D.燃烧放热E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。
某平面正六边形分子由A、B两种元素组成且原子个数比为1:
1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)
②在a:
苯b:
CH3OHc:
HCHOd:
CS2e:
CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。
一般地,为d0
或d10排布时,无颜色;
为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。
据此判断,[Mn(H2O)6]]2+_____________(填“无”或“有”)颜色
(4)请写出HClO的电子式:
_______________________;
在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5)A、B均为短周期金属元素。
依据下表数据和已学知识,
电离能/KJ·
mol-1
I1
I2
I3
I4
A
932
1821
15390
21771
B
738
1451
7733
10540
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式:
_______________________________________________。
19.下表为长式周期表的一部分,其中的序号代表对应的元素。
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为。
(3)元素⑦与①⑤形成的化合物的化学键类型有___________________;
根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因___________________________。
20.回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。
推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
共价键
C-C
C-N
C-S
键能/kJ·
347
305
259
(2)已知:
波长为300nm的紫外光的光子所具有的
能量约为399kJ/mol。
根据右表有关蛋白质分子中
重要化学键的信息,说明人体长时间照射紫外光后
皮肤易受伤害的原因:
______________________________________________________________
_____________________________________________________________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中含有极性键的数目是___________;
NH4+的空间构型是_______________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1038.7kJ·
若该反应中有8molN-H键断裂,则形成的π键有________mol。
(4)硼砂是含结晶水的四硼酸钠,其阴离子
(含B、O、H三种元素)的球棍模型如右图所示:
①在
中,硼原子轨道的杂化类型有和________;
配位键存在于原子之间(填原子的数字标号);
m=(填数字)。
②硼砂晶体由
、
和
构成,它们之间存在的作用力有(填序号)。
A.共价键B.离子键C.氢键D.范德华力E.金属键
“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
下学期第二次月考
高二化学答题卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分
一、选择题(16个小题,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
9
10
11
12
13
14
15
16
二、填空题(共52分)
17.
(1)____________________________
(2)_________________
(3)①________________________________________________
②___________________K^S*5U.C#O%
(4)___________________________________________________
(5)_________________________________________________________
18.
(1)____________________________
(2)___________________________
(3)①_______________
②_________________________________
③_______________
(4)______________________
(5)_____________________________________________________________
19.
(1)______________
(2)________________________________________
(3)_________________________________________________
(4)__________________________________
(5)______________________________________________________
(6)_____________________________________________________
(7)_____________________________________________________________
20.
(1)__________________
(2)_________________________________________________________________________________
___________________________________________________________________________________。
(3)①__________ ________________ ② _____________________
(4)①____________和________________________________________
②________________
高二化学参考答案
C
D
17.(共11分)
(1)
(各1分)
(2)
(1分)
(3)①
或
(2分)
②b和c(2分,漏选得1分,有错选不得分)K^S*5U.C#O%
(4)
(5)c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)(2分)
18.(共14分)
(1)D、E(2分,漏选得1分,有错选不得分)
(2)12(1分)
(3)①CuK(2分,写对一个给1分,全部写对得满分)
②be(2分,漏选得1分,有错选不得分)1800(1分)
③有(1分)
(4)
(各1分)
点燃
(5)3s2(1分)2Mg+CO2===2MgO+C(2分)
19.(共15分)
(1)4(1分)
(2)金刚石原子晶体1:
2(各1分)
(3)离子键、共价键(2分,漏选得1分,有错选不得分)共价化合物(1分)
(4)三角锥形(1分)N—H…N(1分)
(5)HF分子间通过氢键会形成(HF)n分子(或HF分子间会形成氢键)(1分)
(6)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O(2分)
(7)酸(1分)Cu2++2H2O
Cu(OH)2+2H+(2分)
20.(共12分)
(1)非极性(1分)
(2)紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子(2分)
(3)①4(1分) 正四面体 (1分)
② 6mol(1分)
(4)①SP2杂化(1分)SP3杂化(1分)4、5(1分),m=2(1分)②BCD(2分,漏选得1分,有错选不得分)