化学四川省成都实验中学届高三上学期月考理科综合Word格式文档下载.docx
《化学四川省成都实验中学届高三上学期月考理科综合Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化学四川省成都实验中学届高三上学期月考理科综合Word格式文档下载.docx(11页珍藏版)》请在冰豆网上搜索。
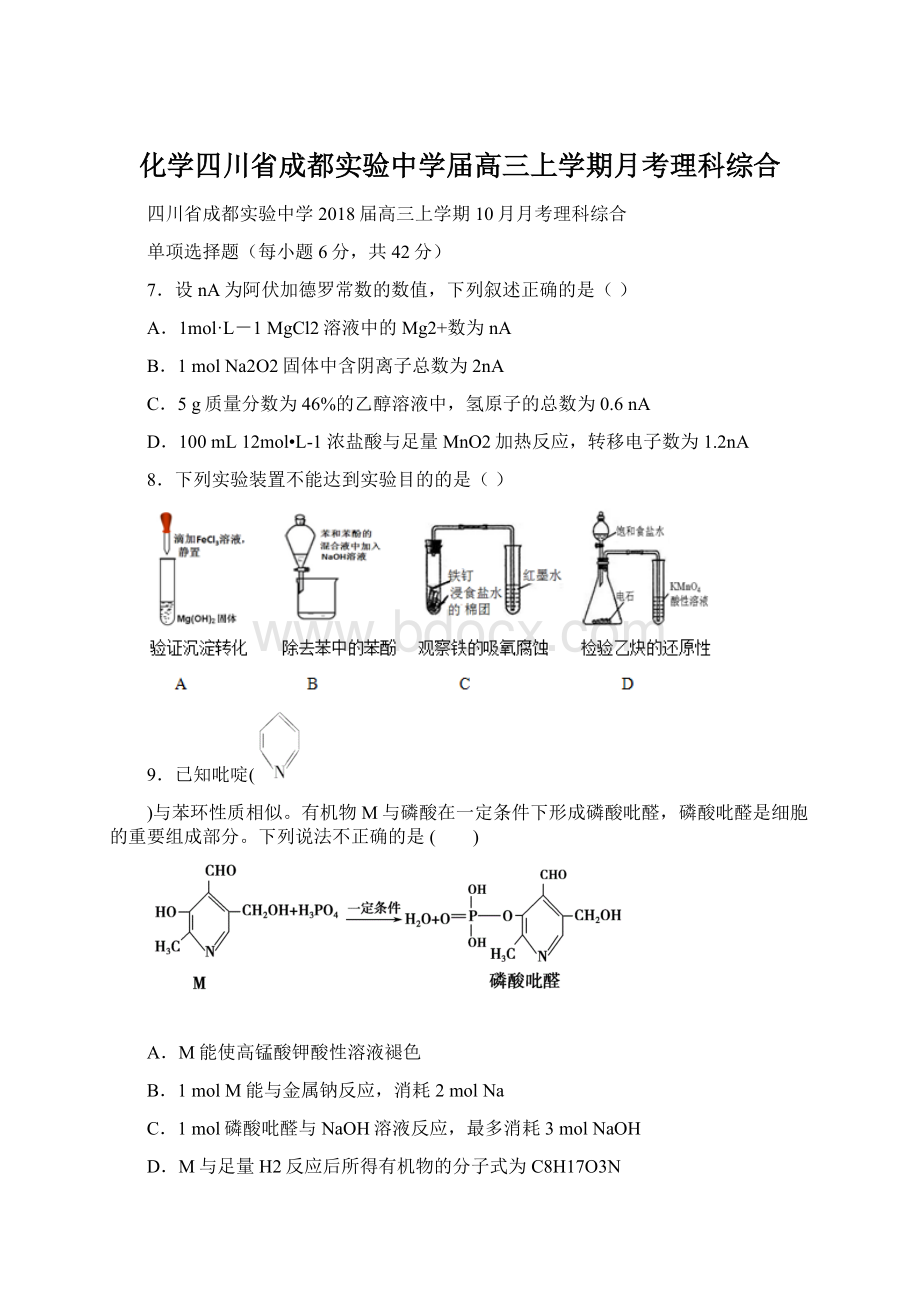
B
配制一定浓度的氯化钾溶液1000mL
准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容
C
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
11.A、B、C、D四种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为
C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍.下列说法正确的是( )
A.原子半径大小顺序为:
B>C>D>A
B.四种元素都属于非金属元素,它们之间只能形成共价化合物
C.B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期
D.BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体
12.糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。
下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:
Fe-3e-===Fe3+
C.脱氧过程中碳作原电池负极,电极反应为:
2H2O+O2+4e-===4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
13.25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如下图所示。
下列说法正确的是()
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:
HZ﹤HY﹤HX
B.根据滴定曲线,可得Ka≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:
c(X-)﹥c(Y-)﹥c(OH-)﹥c(H+)
D.HY与HZ混合,达到平衡时:
c(H+)=Ka(HY)·
c(HY)/c(Y-)+c(Z-)+c(OH-)
非选择题(本题包括5小题,26、27、28为必答题,35、36任意选答一题,若两题均作答,则按第35题计分。
)
26.(14分)
(1)在2L容器中利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)
CO2(g)+3H2(g)
H(298K)=+49.4kJ/mol
(1)该条件下反应达平衡状态的依据是(填序号)。
A.v正(CH3OH)=v正(CO2)B.混合气体的密度不变
C.c(CH3OH)=c(H2O)D.混合气体的总物质的量不变
(2)如图所示为硝酸铜晶体[Cu(NO3)2·
nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.该反应最终得到的晶体是Cu(NO3)2·
3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·
3H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:
2H2O
OH-+H3O+,则液态NH3电离的方程式是
(4)甲、乙两容器体积相等,甲容器通入2molSO2和2molO2,乙容器通入2molSO3和1molO2,发生反应:
2SO2(g)+O2(g)
2SO3(g)
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b1(填“﹤”、“﹥”或“=”)。
(5)甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。
下图是甲醇燃料电池模型,试回答下列问题:
①写出该燃料电池的正极反应式。
②b处应该通入(填空气或者甲醇)M、N是阴离子交换膜,则阴离子移动的方向
是(填“从左到右”或“从右到左”)
③用该电池电解500ml,0.2mol/L的CuSO4溶液,消耗3.2g甲醇时,阴极析出Cu的质量
为。
27.(除标注外,每空2分,共15分)铁在冷的浓硫酸中能发生钝化。
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。
实验室现有下列试剂:
0.01mol/L酸性KMnO4溶液、0.1mol/LKI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。
请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
实验操作
预期现象
结论
验证猜想Ⅰ
步骤①:
取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液
___________
步骤②:
________
含有Fe3
验证猜想Ⅱ
将所得气体通入如下装置
含有两种气体
【实验探究】
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
_____________________________
28.(14分)工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Al(OH)3
Fe(OH)3
Fe(OH)2
Cu(OH)2
Pb(OH)2
Mn(OH)2
开始沉淀的pH
3.3
1.5
6.5
4.2
8.0
8.3
沉淀完全的pH
5.2
3.7
9.7
6.7
8.8
9.8
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是。
(2)酸浸后的溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去。
(3)从溶液A中回收的主要物质是,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式。
35.【选修:
物质结构与性质】
(15分)X、R、Y、Z、W和H均为前四周期元素,原子序数依次增大,在所有元素的原子中X的原子半径最小,Y原子最外层电子数是其周期数的三倍,R与Y相邻,Y、W同主族,Z与X原子最外层电子数相同。
H是地壳中含量第二的金属元素。
回答下列问题:
(1)X的第一电离能比Z的_______(填“大”或“小”);
X2Y融化所需克服的微粒间作用力是_______________。
(2)由X、Y和Z元素组成的化合物中,既含有共价键又含有离子键的有_____、_____。
ZN3是一种很不稳定的化合物,其阴离子的电子式为N3—___________。
(3)Y3可将碱性工业废水中的CN—氧化为碳酸盐和氮气,离子方程式为________________。
(4)在25°
、101Kpa下,已知13.5g的
固体单质在Y2气体
中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是___________________。
(5)HW2晶体的晶胞结构与NaCl晶体的相似(如图所示),晶体化学式为___________,晶体中含有的中哑铃形W22-的存在,使晶胞沿一个方向拉长。
晶体中1个H2+周围距离最近的W22-数目为__________。
36.【选修:
有机化学基础】
(15分)X是一种抗菌药,用于治疗急、慢性溃疡性结肠炎,其结构简式
.以有机物A为原料合成X的路线如下:
已知:
(1)写出A中含有的官能团的名称 .(2分)
(2)写出下列反应的反应类型:
③ ;
④ .(每空1分)
(3)写出E的结构简式 .(2分)
(4)写出第②步反应的化学方程式 .(3分)
(5)在第一步反应中可能会生成一种高聚物的副产物,写出该副产物的结构简式 .(2分)
(6)B有多种同分异构体,写出同时符合下列条件B的所有同分异构体结构简式:
.(4分)
①能发生银镜反应;
②一定条件下与NaOH溶液完全反应,需消耗2molNaOH;
③分子结构中不含甲基;
④苯环上有2种不同化学环境的氢.
参考答案
7—11CDCCA12—13DB
26.【答案】
(1)D(2分)
(2)c、d(2分)
(3)2NH3
NH4++NH2-(2分)
(4)﹤(2分)
(5)①O2+4e-+2CO2=2CO32-(2分)
甲醇(1分) 从右到左(1分)6.4g(2分)
27.【答案】【提出猜想】Ⅱ.SO2、H2溶液紫红色褪去 含有Fe2+(或溶液紫红色不褪去,不含Fe2+)
另取少量所得溶液,滴加KI淀粉溶液 溶液变为蓝色
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
【问题讨论】 不正确(1分)若溶液中含有Fe3+,则无法检验溶液中是否含有Fe2+
【解析】解答本题时应注意以下三点:
(1)明确实验的目的是验证溶液和气体的成分;
(2)根据溶液中可能存在的离子Fe2+(铁过量)、Fe3+或两者的混合物,选择合适的试剂进行检验;
(3)根据气体的可能成分SO2和H2选择合适的试剂进行检验。
铁与浓硫酸加热时,产生的金属离子可能有Fe2+(铁过量)、Fe3+,产生的气体可能有H2(铁过量)、SO2。
Fe2+可以使酸性KMnO4溶液褪色,Fe3+具有氧化性,可把I-氧化成I2可使KI淀粉溶液变为蓝色;
SO2可以使酸性KMnO4溶液褪色,并被其吸收。
28.【答案】
(除标注外,每空2分)
(1)增大接触面积,加快反应速率(使反应更充分)
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O(3分)②除去Fe3+,A13+③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O(3分)
【解析】
(1)将反应物粉碎的作用是增大接触面积,加快反应速率,使反应更充分;
(2)pH调到5.2~6.0,其主要目的是除去Fe3+、A13+和部分Cu2+;
③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;
(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4。
(4)由MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,可知反应物为Mn3O4和稀硫酸,生成物为MnSO4和MnO2,反应方程式可写成:
Mn3O4+H2SO4→MnSO4+MnO2,根据原子守恒,还应有水生成,故可写出:
Mn3O4+H2SO4→MnSO4+MnO2+H2O,利用化合价法和原子守恒配平方程式得:
Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
35.【答案】
(1)大(1分)氢键(和范德华力)(1分)
(2)NaOHNa2O2(2分)[略]—(与CO2相同)(2分)
(3)5O3+6CN—+6OH—=6CO32-+3N2+3H2O(2分)
(4)2Na(s)+O2(g)=Na2O2(g)△H=-1427.7kJ/mol(2分)
(5)FeS24(4分)
36.【答案】
(1)羟基、羧基
(2)取代反应还原反应
(3)
(4)
(5)
(6)
【解析】:
由反应②可知,②为硝化反应,①为酯化反应,则A为
,A酯化反应生成B,B为
,反应③中酚羟基中的H原子发生取代反应,反应④为硝基的还原反应,即硝基生成氨基,则C为
,则D为
,由信息②可知D与B反应生成E为
,在碱性条件下水解可生成X,
(1)A为
,含官能团为羟基、羧基,故答案为:
羟基、羧基;
(2)由上述分析可知,③为取代反应,④为还原反应,故答案为:
取代反应;
还原反应;
(3)E的结构简式为
,故答案为:
;
(4)第②步反应的化学方程式为
,
故答案为:
(5)第一步反应中可能会发生缩聚反应生成一种高聚物的副产物,该副产物的结构简式为
(6)B的同分异构体,写出同时符合①能发生银镜反应,含﹣CHO;
②一定条件下与NaOH溶液完全反应,需消耗2molNaOH,含酚﹣OH或﹣COOC﹣;
④苯环上有2种不同化学环境的氢,则苯环上只有2种H,符合条件的B的所有同分异构体结构简式为