4氧气制备Word文件下载.docx
《4氧气制备Word文件下载.docx》由会员分享,可在线阅读,更多相关《4氧气制备Word文件下载.docx(14页珍藏版)》请在冰豆网上搜索。
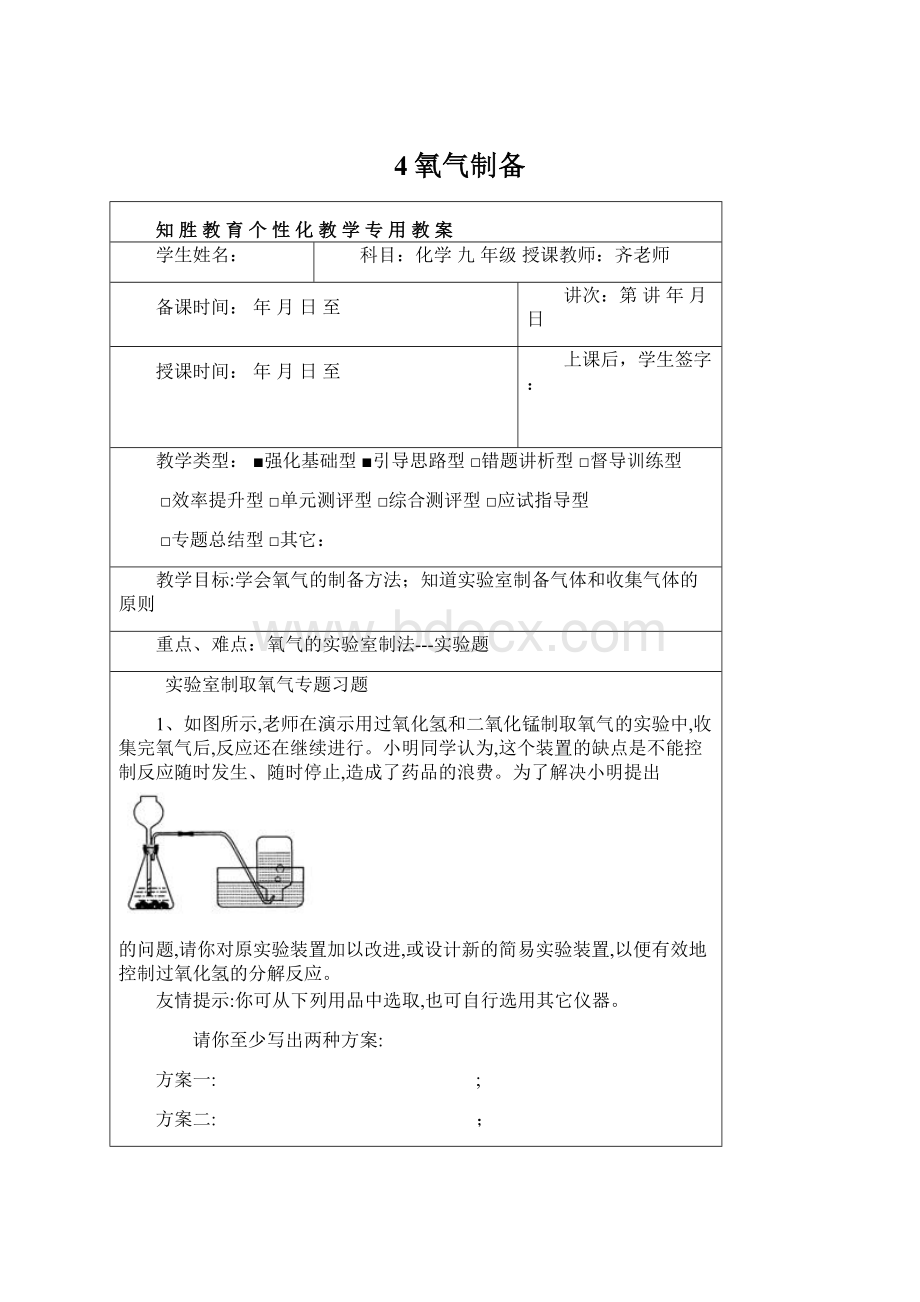
方案一:
;
方案二:
;
1
2、实验室有高锰酸钾、过氧化氢、二氧化锰、棉花、木块及下列仪器,请回答下列问题:
(1)写出有标号仪器的名称②
;
(2)芳芳发现若补充的一种仪器,再利用上述仪器和药品就可以制取氧气。
需要补充的仪器
是
,除此而外,她还需选择的仪器有
(填序号)
(3)她正在绘制制取氧气的装置图,请你帮助芳芳将其补充完,并写出发生反应的化学方程
式:
(4)用双氧水和二氧化锰混合制氧气与加热高锰酸钾制氧气的方法相比较,能体现出的一条优点是
3、实验室常用下列装置来制取氧气:
(1)写出图中有标号仪器的名称:
a
、b
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是
(填序号),
能用E装置收集氧气的依据是
。
(3)实验室用高锰酸钾制取氧气的化学方程式为:
。
4、利用下列仪器进行实验(所有装置的气密性都已检查完毕)
(1)把过氧化氢溶液缓缓加入盛有二氧化锰的容器中制取并收集氧气,完成该实验你所选用的仪器有
(填字母)。
写出发生反应的化学方程式
这种方法与“把二氧化锰加入盛有过氧化氢溶液的试管中制氧气”相比有
的优点。
(2)某同学继续探究“红砖粉末是否也可以作过氧化氢分解反应的催化剂?
”实验步骤和现象如下:
①他分别向两支试管中加入等质量等溶质质量分数的过氧化氢溶液,向其中一支试管加入一药匙红砖粉末,然后将两支试管中的气体导出通入水中比较产生气泡的快慢,发现加入红砖粉末的试管中反应较快。
②将反应较快的试管内固体过滤出来,洗涤、烘干、称量。
③用称量后的固体重复步骤①的实验,现象与步骤①完全相同。
试回答:
步骤①中他除了选用试管外还用到上面列出的仪器有
步骤③的实验目的是
该学生认为通过上述实验已证明红砖粉末可以作过氧
化氢分解反应的催化剂,但老师认为该同学的实验还缺少一个关键步骤,请指出来
5
(1)abdh
(1分)
2H2O2
2H2O+O2↑(1分)
可以得到平稳的氧气流、控制反应速率、节约药品等答对其中一点即给分(1分)
(2)fgh
证明红砖粉末在反应前后的化学性质没有改变(1分)
实验开始没有称量红砖粉末的质量(1分)
5、实验室常用高锰酸钾粉末制取氧气(装置A),也可用过氧化氢溶液和催化剂二氧化锰粉末来制取氧气(装置B)。
装置B中的仪器a是分液漏斗,通过活塞的“开”、“关”可以随时滴加过氧化氢溶液,从而控制得到氧气的质量。
(1)写出一种实验室制取氧气的化学方程式:
_________________________________。
(2)从所需的药品状态和反应条件比较装置A和B的差异:
装置A
装置B
所需药品状态
反应条件
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶中,检验氧气是否收集满,这是利用了氧气的________________________、__________________________性质。
6小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。
她
设计并完成了下表所示的探究实验:
实验操作
实验现象
实验结论或总结
实验一
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条
有气泡产生,木条不复燃
过氧化氢分解产生氧气,但是
反应的化学方程式为:
二氧化锰是过氧化氢分解的催化剂
实验二
向盛水的试管中加入二氧化锰,伸入带火星的木条
没有明显现象
实验三
二氧化锰能加快过氧化氢的分解
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。
接下来的实验操作、现象和结论是:
。
(1)
反应慢
2H2O2=2H2O+O2↑
二氧化锰加入水中不产生氧气。
向盛有5mL5%过氧化氢溶液的试管中加入二氧化锰,伸入带火星的木条
有大量气泡产生,带火星的木条迅速复燃
(2)对比(或对照等);
(3)第一方面:
比较MnO2在过氧化氢分解前后的质量。
第二方面:
倾倒掉反应后的液体,向剩余的固体中重新加人过氧化氢溶液,有大量气泡产生,说明MnO2仍然能加快过氧化氢的分解速率(化学性质没变)
7、根据下列实验装置图,问答问题:
A
B
C
D
E
(1)写出标有序号的仪器名称:
①__________,②_________。
(2)在实验室中用高锰酸钾制取氧气时,发生反应的化学方程式为
,应选择的发生装置为
(填写装置的字母代号,下同),该装置还缺少
(3)常温下,用亚硫酸钠固体和稀硫酸反应制取二氧化硫气体,应选用的发生装置是
由于二氧化硫是易溶于水、密度比空气大的气体,会和氢氧化钠等碱溶液反应而被吸收,所以应用
装置进行收集。
在硫酸厂的尾气中常有二氧化硫这种有毒气体,为防治污染最好用
来吸收。
8、通过化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置。
请结合下图回答问题:
(1)写出图中标号的仪器名称:
b
(2)写出实验室用A装置制取氧气的化学方程式
(3)通过查阅资料得知:
①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是
,收集装置是
(填字母编号)
(4)请写出氨气和氧化铜反应的化学方程式
9、实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题。
(1)写出实验室制取氧气的一个化学方程式____________。
利用该反应制取氧气,发生装置应选____________(填序号,下同)。
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2==2NO2,则收集一氧化氮气体时不能用的装置是(填序号)____________。
(3)按图F作细铁丝在氧气中燃烧的实验,我观察到的现象有____________________________________________,其相关的化学方程式是____________。
10、今天是学校实验室的开放日,九年级1班某小组的同学来到实验室准备练习制取和收集氧气,实验员为他们提供了下列装置、仪器和药品。
装置和仪器:
药品:
高锰酸钾
过氧化氢溶液
二氧化锰
氯酸钾
①
②
③
(2)张勇同学选择了A和D制取和收集氧气,他可以选择的药品是
,反应的文字表示式为
,如果要检验氧气是否收集满,可以用
检验。
11、现有下图所示的实验装置,请回答问题:
(1)在加入药品之前应对实验装置进行
(2)可用于实验室制备和收集O2的一套装置是(填字母番号)
写出用此装置制备O2的反应化学方程式
(3)若选用A装置制备气体时应考滤的因素是
12、为了制取少量的氧气,化学兴趣小组的同学把工作分为以下三个阶段。
I查阅资料.获得信息:
过氧化氢、氯酸钾、高锰酸钾等含有氧元素的物质在一定条件下分解都可以产生氧气,其中过氧化氢价格最低,在常温下就能够分解放出氧气.该过程无副产物;
氯酸钾价格较高。
分解较困难.且常伴有副产物;
高锰酸钾价格较高,加热即可快速分解。
二氧化锰能加速上述三种物质的分解。
根据上述信息,确定制取氧气的实验方案。
lI组装仪器,进行实验。
可供选择的实验装置如下:
Ⅲ实验完毕,洗刷仪器,整理用品,总结实验,完成实验报告。
(1)要制取一瓶氧气,你认为应选择的最佳实验装置是
(填写字母代号),
组装好实验装置后首先应
(2)有气体产生的化学反应在有限的空间里发生时,如果反应速度过快,容易引起爆炸。
在用过氧化氢和二氧化锰制氧气的实验中,为预防爆炸应采取的措施是(列举两条);
(3)回顾整个工作过程,你认为在准备工作阶段除应考虑药品的价格、制氧气反应的难易、制氧气过程的安全性等因素外。
还应考虑的因素是(一条即可)。
23(I)B、C
检查装置的气密性
(2)控制过氧化氢溶液的浓度.控制催化剂(或二氧化锰)的用量,应保证气体通道畅通等(以上任意两条或其他合理答案均可)
(3)反应物应在含有氧元素的物质中选择;
应考虑实验过程对环境的影响;
实验所需仪器的规格、性能;
实验试剂的浓度、用量等问题
13、今年我市化学实验操作考察的实验之一是“高锰酸钾制取氧气”。
现摘录某同学的实验过程如下:
①选择适当仪器,组装成如右图所示的实验装置;
②检查装置气密性,装置气密性良好;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶
底部出现气泡;
④将药品平铺于干燥试管底部,在导管口放置蓬松的棉花团,塞上橡皮塞,固定于铁架台上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,用毛玻璃片将集气瓶口盖好,从水中取出并正放在桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;
………………
请回答下列问题:
(1)写出用高锰酸钾制氧气的化学方程式:
(2)欲调整试管高度,应调节图中A、B、C哪个旋钮:
(3)步骤②的操作与观察到的现象是:
若装置无破损,加热一段时间后,观察到高锰酸钾已大量分解,但导管口仍未产生明显气泡,可能的原因是
(4)上述实验步骤中,可能导致集气瓶中收集的氧气不纯净(水蒸气不计)的是
(5)步骤⑦中的操作,可能引起
27
(1)2KMnO4△K2MnO4+MnO2+O2↑(2分)
(2)A(1分)
(3)用手捂住大试管,导管口冒气泡,松手后导管口形成稳定的水柱(1分)
橡皮塞没有塞紧(1分)
(4)③⑤(答对一个给1分,有错倒扣1分)(2分)
(5)倒吸(或大试管破裂)(1分)
14、下列装置中若不添加其他仪器,也不改变装置结构,就不能检查出装置是否漏气的是(
)
B
C
D
15、小岳同学所在的学习小组对实验室用过氧化氢溶液制O2的知识做了全方位的探究,下面是他们的学习实录:
(1)实验发生装置的探究学习:
根据反应物的状态,小岳从下列装置中选择了D作为发生装置,你认为他该选择的收集装置是
实验过程中小岳发现,试管中产生了很多泡沫,甚至有些进入导气管中。
经过讨论,该小组同学认为泡沫的产生可能有很多原因:
可能是试管的横截面积太小,气泡不易破裂。
你认为他们的猜测还可能有
小岳将发生装置改成了C,发现泡沫没有了,但是反应的速率很快,很难对实验进行控制。
小晨建议小岳将反应装置换成B就可以了。
小晨的理由是
(2)催化剂选择的探究学习:
通过课堂上的学习,小静了解到:
MnO2、土豆块都可以做H2O2分解的催化剂,于是萌生了寻找适合催化剂的想法。
通过查阅资料,小静还了解到部分盐(溶液)也能对过氧化氢的分解具有催化作用,如CuCl2、CuSO4等盐(溶液)。
于是小静做了以下的探究。
①请你帮助她完成实验报告:
实验过程
实验结论
在一支试管中加入5ml6%的H2O2溶液,然后滴入适量的CuCl2溶液,把带火星的木条伸入试管。
CuCl2溶液可以催化分解H2O2
②已知CuCl2在水中可解离出Cu2+和Cl-,同学们提出以下猜想:
小凯说:
真正催化分解H2O2的是CuCl2溶液中的H2O;
小毅说:
真正催化分解H2O2的是CuCl2溶液中的Cu2+;
小留说:
真正催化分解H2O2的是CuCl2溶液中的Cl-;
你认为最不可能的是
同学的猜想,理由是
③同学们对余下的两个猜想,用实验进行了探究。
请你仔细分析后填表:
实验过程
结论
先向盛有5ml6%的H2O2溶液的试管中加入少量的HCl溶液,并把带火星的木条伸入试管。
无明显现象
再向这支试管中加入少量的
,并把带火星的木条伸入试管。
30⑴E、G
反应太快、双氧水浓度太大或氧气密度比空气大或试管容积太小或MnO2较多(其他合理答案均可)
用分液漏斗可以控制双氧水滴加的量
⑵①带火星的木条复燃
②小凯
双氧水溶液中就含有水
③Cl─不能催化分解H2O2
③CuCl2或CuSO4或CuO或Cu(OH)2等(其他合理答案也行)
31、为什么KClO3里混入KMnO4加热时制氧的速度会大大加快?
32、化学兴趣小组利用课余时间自制氧气,有同学从家里拿来了洗脸盆并盛了半盆自来水,用罐头瓶(带玻璃片)装满水倒放入脸盆中准备收集气体,还有同学从化工试剂商店买来了高锰酸钾作原料。
由于自带仪器不够用,又有同学准备从学校化学实验室借用一些仪器。
问:
①还需借用的仪器有_____________________________________________;
②检验收集的气体是O2的方法是__________________________________。
35、下列实验操作,先后顺序正确的一项是
A、检查装置气密性时,先用双手紧贴试管外壁,再将导管的一端浸入水中。
B、实验室制取、收集氧气时,先将导气管伸入盛满水的集气瓶,再给试管加热。
C、使用滴管时,先用手指捏紧橡胶乳头,然后把滴管伸入试剂瓶中,放开手指,吸入液体试剂。
D、使用H2O2溶液和MnO2制氧气时,先将药品装入装置,然后检查装置的气密性。
37、实验室用加热高锰酸钾制取并排水法收集氧气时,不可少的一组玻璃仪器是
A.大试管、玻璃导管、水槽、玻璃片
B.大试管、玻璃导管、集气瓶、水槽、玻璃片、酒精灯
C.锥形瓶、集气瓶、铁架台、水槽
D.大试管、铁架台、单孔塞、玻璃导管、酒精灯
38、
某气体只能用向上排空气法收集,则该气体具备下列性质中的哪几项(
A.不易溶于水
B.易溶于水
C.密度比空气小
D.密度比空气大