元素及其化合物的性质归纳整汇编Word格式.docx
《元素及其化合物的性质归纳整汇编Word格式.docx》由会员分享,可在线阅读,更多相关《元素及其化合物的性质归纳整汇编Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
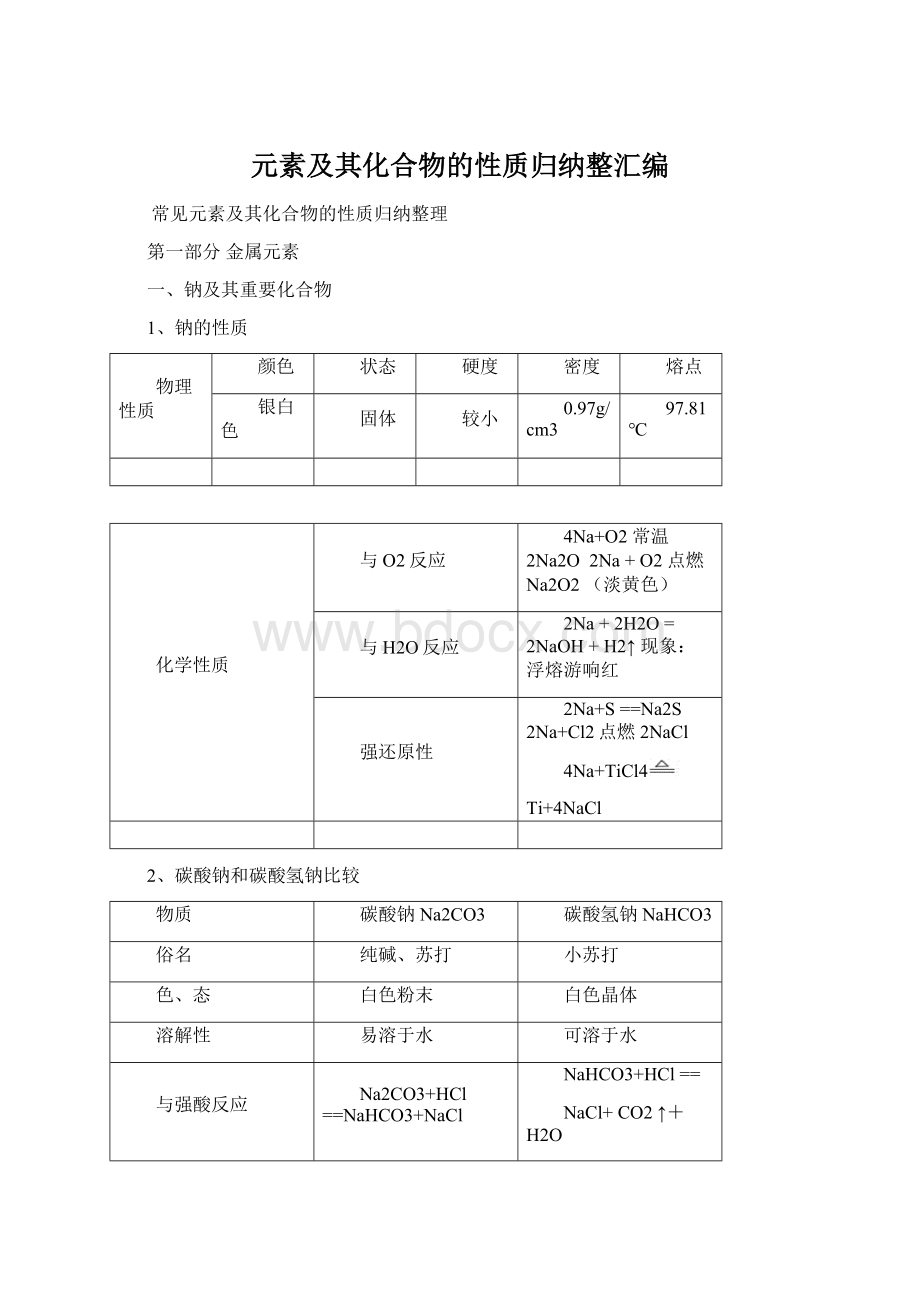
反应
NaHCO3+NaOH=Na2CO3+H2O
与BaCl2或CaCl2反应
Na2CO3+BaCl2=BaCO3↓+2NaCl
不反应
与CO2反应
Na2CO3+CO2+H2O=2NaHCO3
热稳定性
稳定,加热不分解
2NaHCO3
Na2CO3+CO2↑+H2O
相互转化
二、镁的性质
1.物理性质:
具有银白色金属光泽,良好的导电、导热性、延展性。
密度较小,熔点较低,硬度较小
2.化学性质:
①与非金属反应2Mg+O2点燃
2MgO3Mg+N2点燃
Mg3N2
②与酸反应Mg+2HCl=H2↑+2MgCl2
③与CO2反应2Mg+CO2点燃2MgO+C
三、铝及其化合物的性质
1、铝的性质
①与非金属反应4Al+3O2点燃
2Al2O3
②铝热反应2Al+Fe2O3高温Al2O3+2Fe(焊接铁轨)
③与酸反应2Al+6HCl==2AlCl3+3H2↑
④与碱反应2Al+2NaOH+2H2O==2NaAlO2+3H2↑
2、Al2O3(两性氧化物)
①与酸反应Al2O3+6HCl==2AlCl3+3H2O
Al2O3+6H+==2Al3++3H2O
②与碱溶液反应Al2O3+2NaOH===2NaAlO2+H2O
Al2O3+2OH-===2AlO2-+H2O
3、Al(OH)3(两性氢氧化物)
①与酸反应Al(OH)3+3HCl==AlCl3+3H2O
②与碱反应Al(OH)3+NaOH===NaAlO2+2H2O
受热分解2Al(OH)3
Al2O3+3H2O
电离方程式H++AlO2-+H2OAl(OH)3Al3++3OH-
4、Al(OH)3制备
AlCl3+3NH3·
H2O=Al(OH)3↓+3NH4Cl
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
5、从铝土矿提取铝(优化32页)
酸溶法
碱溶法
四、铁及其化合物的性质
1、铁的性质
物理性质:
纯净的铁是光亮的银白色金属,密度大,熔沸点高,有延展性、导热性和导电性。
化学性质:
①与氧化性不太强的氧化剂反应,生成+2价化合物如S.I2.H+.Fe3+.Cu2+
Fe+CuSO4=Cu+FeSO4Fe+S点燃FeS
Fe+2Fe3+===3Fe2+
Fe+2HCl==FeCl2+H2↑
②与强氧化剂反应,生成+3价化合物如Cl2.Br2.HNO3.浓H2SO4(△)等氧化为Fe3+。
(若在溶液中反应,若铁过量还有可能生成Fe2+)
2Fe+3Cl2点燃2FeCl3
2、Fe3+、Fe2+相互转化
3、Fe3+、Fe2+的检验方法
五、铜的化学性质
1与非金属单质反应
2Cu+O2
2CuOCu+Cl2
CuCl22Cu+S
Cu2S
2与强氧化性酸反应
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
与非氧化性酸不反应,如盐酸、稀硫酸
第二部分非金属元素
一、C、H、O元素
氧气的性质
1.氧气的物理性质:
无色无味的气体,不易溶于水,密度比空气略大。
2.氧气的化学性质:
支持燃烧,有助燃性。
可供呼吸用,是常用的氧化剂。
3Fe
+
2O2
点燃
Fe3O4
3.制法①用双氧水制氧气:
2H2O2
MnO2 2H2O+
O2↑
②加热高锰酸钾2KMnO4
K2MnO4+MnO2+O2↑
③加热氯酸钾和二氧化锰的混合物2KClO3
2KCl+3O2↑
过氧化钠与水的反应2Na2O2+2H2O=4NaOH+O2↑
氢气的性质
1.氢气的物理性质:
无色无味的气体,极难溶于水,密度最小的气体
2.氢气的化学性质
①可燃性:
2H2+O2
2H2O
②还原性:
H2+CuO
Cu+H2O
碳的性质
充分燃烧C+O2
CO2
氧气不足2C+O2
2CO
②还原性:
C+2CuO
2Cu+CO2↑
C+CO2
二氧化碳的性质
1.二氧化碳的物理性质:
可溶于水,密度比空气的大。
加压降温易变为固体“干冰”
2.二氧化碳的化学性质
①跟水反应:
二氧化碳通入水中生成碳酸CO2+H2O H2CO3
②用澄清的石灰水检验CO2+Ca(OH)2=CaCO3↓+H2O
③通常情况下,CO2不支持燃烧,也不可以燃烧。
2Mg+CO2点燃2MgO+C
一氧化碳的性质
1.一氧化碳的物理性质:
无色、无味、比空气的密度略小、难溶于水
2.一氧化碳的化学性质
①可燃性:
2CO+O2
2CO2
CO+CuO
Cu+CO2
3CO+Fe2O3
2Fe+3CO2
③毒性:
一氧化碳吸入肺里跟血液的血红蛋白结合,破坏了血红蛋白的输氧能力
二、氯、溴、碘
1、氯气的性质
黄绿色、有毒、有刺激性气味,可溶于水
与金属反应2Na+Cl2=2NaClCu+Cl2
CuCl22Fe+3Cl2==2FeCl3
与氢气反应H2+Cl2点燃2HCl
与水反应Cl2+H2O HCl+HClO
与碱反应2NaOH+Cl2=NaCl+NaClO+H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O(漂白粉生产原理)
Ca(ClO)2+H2O+CO2= CaCO3↓+2HClO(漂白粉漂白原理)
2、HClO的性质
①弱酸性
②漂白性
③氧化性
3、
氯、溴、碘元素之间的化学反应
氯、溴、碘等元素在原子结构和性质方面具有一定的相似性,都具有氧化性。
单质的氧化能力:
Cl2>
Br2>
I2,能发生以下反应
Cl2+2Br—=2Cl—+Br2Cl2+2I—=2Cl—+I2
Br2+2I—=2Br—+I2
4、溴单质、碘单质的物理性质比较
溴单质
碘单质
深红棕色
紫黑色
液态
固态
溶液
水中
黄到黄棕色
黄色到褐色
CCl4中
橙到橙红色
紫色到深紫色
溴、碘不易溶于水,易溶于四氯化碳、酒精等有机溶剂。
单质溴有毒,具有腐蚀性,易挥发,常用水封保存。
碘易升华,应密闭保存
三、氮及其重要化合物
1、一氧化氮、二氧化氮
物理性质比较
一氧化氮
二氧化氮
无色无味气体,微溶于水
红棕色、刺激性气味,易溶于水
化学性质2NO+O2===2NO2
3NO2+H2O====2HNO3+NO
2、硝酸
物理性质:
无色、具有挥发性的液体
硝酸具有酸性、强氧化性,能和大多数金属及部分非金属在一定条件下反应。
1强氧化性
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
2不稳定4HNO3受热或见光4NO2↑+2H2O+O2↑
③浓硝酸使Fe、Al金属发生钝化
3、氨NH3
无色、刺激性气味,极易溶于水
与水反应NH3+H2O=NH3·
H2ONH4++OH-
与酸反应NH3+HCl=NH4Cl
与氧气反应4NH3+5O2催化剂4NO+6H2O (氨的催化氧化)
★氨气的制备
1.实验室制法
(1)加热固态铵盐和碱的混合物:
一般加热NH4Cl和Ca(OH)2的混合物
实验装置:
“固体+固体
气体”
反应原理:
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O。
(2)浓氨水中加固态碱性物质(如固体碱石灰、氢氧化钠,氧化钙)
2、收集:
只能用向下排空气法。
3、干燥方法:
用碱石灰(NaOH和CaO固体的混合物)。
4、检验方法:
a.用湿润的红色石蕊试纸置于试管口,试纸变蓝色;
b.将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
尾气处理:
一般在管口塞一团用水或稀H2SO4浸湿的棉花球,可避免污染空气。
4、铵盐
白色、易溶于水的晶体
①热稳定性
NH4HCO3
NH3↑+H2O+CO2↑
NH4Cl
NH3↑+HCl↑
②与碱反应放出氨气
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O(实验室制氨气)
5、铵根离子检验:
加碱共热,生成的气体能使湿润的红色石蕊试纸变蓝,则说明原溶液中存在铵根离子。
四、硫及其重要化合物
1、硫单质、二氧化硫的物理性质
硫单质
二氧化硫
黄色或淡黄色固体,很脆,不溶于水,微溶于酒精,易溶于二硫化碳,熔点和沸点都不高
无色、刺激性气味的有毒气体,易溶于水
2、二氧化硫的化学性质
①酸性氧化物SO2+H2OH2SO3SO2+2KOH==K2SO3+H2O
②氧化性SO2+2H2S=3S↓+2H2O
3还原性,能与溴水、酸性高锰酸钾反应使之褪色。
2SO2+O2
2SO3SO2+Cl2+2H2O==H2SO4+HCl
④漂白性:
能与某些有色物质反应,生成不稳定的无色物质。
检验:
能使品红溶液褪色,加热后又恢复红色
3、硫酸
无色油状液体,不易挥发,强腐蚀性,密度较大
硫酸是强酸,具有酸的通性。
浓硫酸有吸水性、脱水性和强氧化性,能和多数金属、部分非金属在一定的条件下发生反应
①Cu+2H2SO4(浓)
②C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
③浓硫酸使铁、铝金属钝化
五、硅及其重要化合物
SiO2+2NaOH=Na2SiO3+H2O
SiO2+CaO高温CaSiO3
SiO2+2C高温Si+2CO↑
Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3
第三部分实验
(1)常见气体的检验
常见气体
检验方法
氢气
纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;
能点燃的气体不一定是氢气
氧气
可使带火星的木条复燃
氯气
黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、Br2也能使湿润的碘化钾淀粉试纸变蓝)
氯化氢
无色有刺激性气味的气体。
在潮湿的空气中形成白雾,能使湿润的蓝色石蕊试纸变红;
用蘸有浓氨水的玻璃棒靠近时冒白烟;
将气体通入AgNO3溶液时有白色沉淀生成。
能使品红溶液褪色,加热后又显红色。
氨气
无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟。
红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。
无色气体,接触空气立即变成红棕色
二氧化碳
能使澄清石灰水变浑浊;
能使燃着的木条熄灭。
SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭。
一氧化碳
可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;
能使灼热的CuO由黑色变成红色。
几种气体制备的反应原理
1、O22KClO3
2H2O2
2H2O+O2↑2KMnO4
K2MnO4+MnO2+O2↑
2、NH32NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
NH3·
H2O+CaO==NH3↑+Ca(OH)2
3、H2Zn+H2SO4(稀)=ZnSO4+H2↑
4、CO2CaCO3+2HCl=CaCl2+CO2↑+H2O
5、SO2Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
6、NO2Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
7、NO3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
8、Cl2MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
几种重要离子的检验
(1)Na+、K+:
用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(2)Al3+:
能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(3)NH4+:
铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(4)Fe2+:
能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。
2Fe2++Cl2=2Fe3++2Cl-
(5)Fe3+:
能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
(6)Cl-:
加入硝酸酸化的与硝酸银溶液,若生成白色沉淀,则可证明
(7)SO42-:
加入盐酸酸化的氯化钡溶液,若生成白色沉淀,则可证明
(二)对“碧芝”自制饰品店的分析
标题:
手工制作坊2004年3月18日
(1)价格低
附件
(二):
调查问卷设计
月生活费人数(频率)百分比几种重要阳离子的检验
(l)H+:
能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+:
可是创业不是一朝一夕的事,在创业过程中会遇到很多令人难以想象的疑难杂症,对我们这些80年代出生的温室小花朵来说,更是难上加难。
(3)Al3+:
(4)Ag+:
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。
5、你认为一件DIY手工艺制品在什么价位可以接受?
(5)NH4+:
beadorks公司成功地创造了这样一种气氛:
商店和顾客不再是单纯的买卖关系,营业员只是起着参谋的作用,顾客成为商品或者说是作品的作参与者,营业员和顾客互相交流切磋,成为一个共同的创作体(6)Fe2+:
300-400元1632%(7)Fe3+:
3、几种重要的阴离子的检验
(1)OH-:
能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl-:
能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)SO42-:
能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
2003年,上海市总人口达到1464万人,上海是全国第一个出现人口负增长的地区。
(4)SO32-:
浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。
能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(5)CO32-:
能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
第三部分电化学
一、钢铁的析氢腐蚀和吸氧腐蚀比较
析氢腐蚀
吸氧腐蚀
条件
正极反应
负极反应
总反应
后续反应
二、燃料电池
美国“阿波罗”宇宙飞船中使用的氢氧燃料电池。
其
构造如图所示,
其反应为:
2H2+O2====2H2O,则负极通入的是
__________,电极反应式为:
___________________,
正极通入的是________________。
电极反应式为:
______________________。
(2)如把KOH改为稀H2SO4做电解质,则电极反应式为:
负极_______________,
正极_______________________。
(3)如把H2改为CH4,KOH做导电物质,则电极反应式为:
负极______________________________,
正极_________________________
三、
电解饱和食盐水
阴极
阳极
总方程式
电解硫酸铜溶液
第四部分实验
可点燃的气体不一定是氢气
能使酸性高锰酸钾溶液褪色。
硫化氢
无色有臭鸡蛋气味的气体。
能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑。
无色气体,在空气中立即变成红棕色
1、O22KClO3
2H2O2
2H2O+O2↑2KMnO4
3、H2Zn+H2SO4(稀)=ZnSO4+H2↑
4、CO2CaCO3+2HCl=CaCl2+CO2↑+H2O
5、SO2Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O
8、Cl2MnO2+4HCl(浓)
几种重要阳离子的检验
(6)Fe2+:
(7)Fe3+: