当代中学生报高考理综化学试题及解析Word格式文档下载.docx
《当代中学生报高考理综化学试题及解析Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《当代中学生报高考理综化学试题及解析Word格式文档下载.docx(23页珍藏版)》请在冰豆网上搜索。
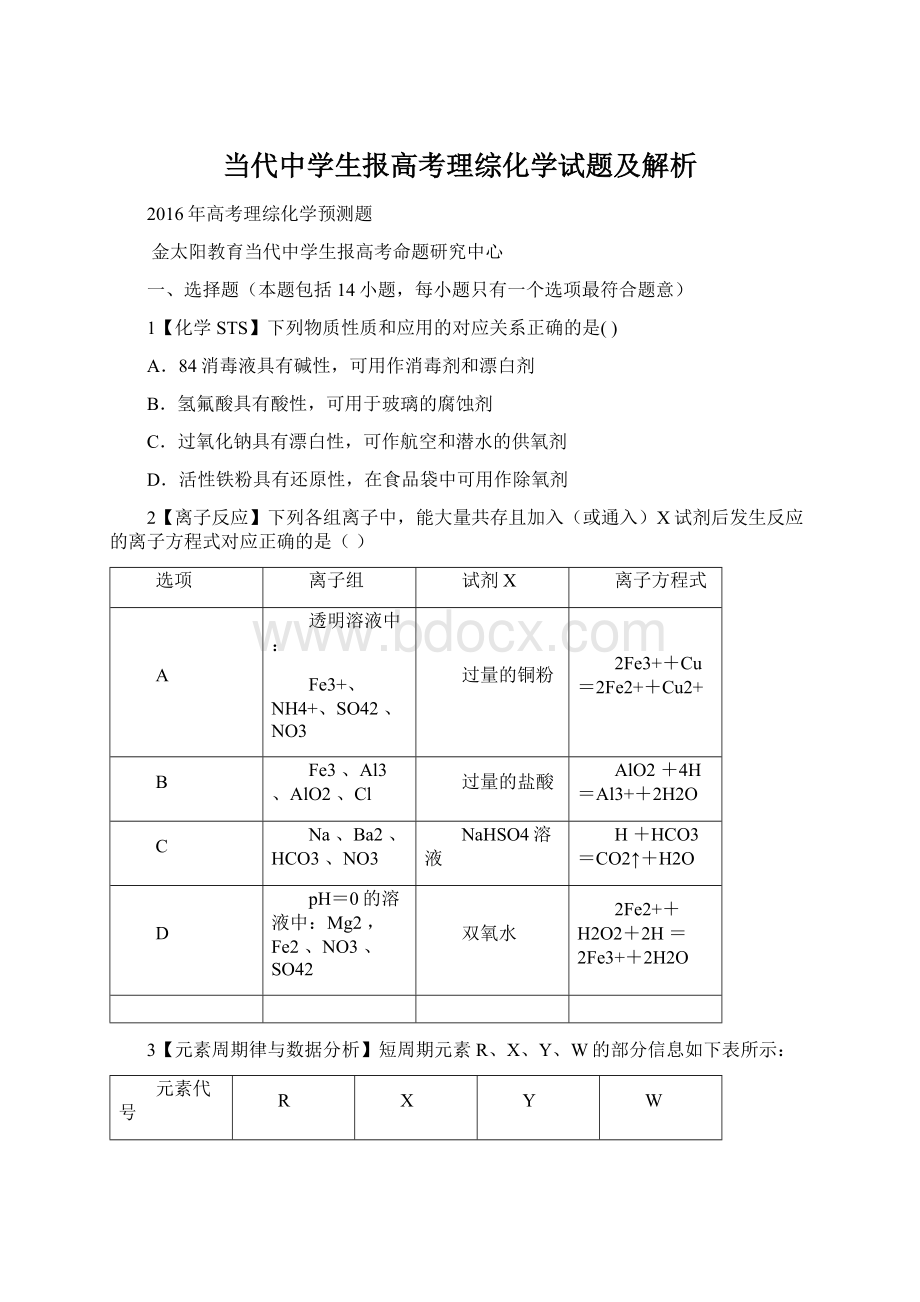
主要化合价
+4、-4
-2
+1
+7、-1
已知Y和W位于同一周期。
下列有关说法不正确的是()
A.简单的离子半径由小到大排序:
Y、X、W
B.X的气态氢化物的稳定性一定比R的强
C.R、X和Y可以组成含共价键的离子化合物
D.在R、X、W的氢化物中,X的沸点最高
4.【元素周期律与性质综合】W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,L层上电子数是M层上电子数的2倍;
在常温常压下,W和R组成的化合物有多种,其中两种化合物能相互转化,但元素化合价没有变化;
这4种元素的原子最外层电子数之和等于R原子的核电荷数的2倍。
下列说法正确的是()
A.元素的非金属性顺序为R>Y>W
B.R与其他三种元素均能形成共价化合物
C.简单氢化物的热稳定性顺序为R>W>Y
D.原子半径次序为W>R>X>Y
5.【阿伏加德罗常数】NA代表阿伏加德罗常数。
A.8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA
B.标准状况下,11.2L乙醇蒸气含共价键数目为4NA
C.1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA
D.1L0.2mol·
L1NH4ClO4溶液中含NH4+数目为0.2NA
6【新型电源】交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。
灯塔可用镁海水电池提供能源,其装置如图所示。
下列有关海水电池的说法正确的是()
A.X可为铁、铜、石墨等电极
B.每转移2mol电子,2molH由交换膜左侧向右侧迁移
C.正极的电极反应式为H2O2+2e+2H=2H2O
D.该电池能将化学能全部转化成电能
【答案】C
【解析】A项,X与稀硫酸直接接触,若X为铁,在铁表面发生氧化还原反应,错误;
B项,镁为负极,负极的电极反应式为Mg-2e=Mg2+
放电过程中,Mg2+由交换膜右侧向左侧迁移,最终镁极变轻,交换膜左侧生成,错误;
C项,双氧水在正极上发生还原反应,正确;
D项,任何电池的能量转化率小于100%,错误。
7【阿伏加德罗定律推论】在一定条件下活性铁粉与氨气反应合成半导体材料:
8Fe(s)+2NH3(g)
2Fe4N(s)+3H2(g)
下列有关NH3、H2的推断正确的是()
A.上述参加反应的NH3和生成H2的体积之比为3∶2
B.同温同压下,NH3、H2的密度之比为2∶17
C.相同质量的NH3、H2分子数之比为17∶2
D.同温同体积下,相同质量NH3、H2的压强之比为2∶17
【答案】D
【解析】A项,同温同压下,参加反应的NH3和生成H2的物质的量之比为2∶3,错误;
B项,同温同压下,气体密度与相对分子质量成正比例,NH3、H2的密度之比为17∶2,错误;
C项,气体质量相等,气体分子数与气体相对分子质量成反比例,故分子数之比为2∶17,错误。
D项,同温、同质量、同体积下,气体的压强与相对分子质量成反比,故NH3、H2的压强之比为2∶17,正确。
8【有机物结构与性质】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。
由青蒿素合成衍生药物蒿甲醚的合成路线如下:
A.①、②反应依次为加成反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
【答案】A
【解析】A项,对照青蒿素和双氢青蒿素的结构简式知,反应①实质是酯基中碳氧双键被还原(或加成)成碳氧单键,生成了羟基;
反应②实质是甲基取代羟基上氢,正确;
B项,青蒿素含酯基,双氢青蒿素含羟基,蒿甲醚不含酯基和羟基,它们都含醚键和过氧键,错误;
C项,青蒿素因含过氧化键,类似双氧水,具有氧化性,能杀菌消毒,错误。
D项,蒿甲醚的化学式为C16H26O5,错误。
9【有机物同分异构体】葡萄糖分子中含醛基(-CHO),能与银氨溶液发生银镜反应生成光亮的银。
有机物C8H5O3Br的同分异构体中,苯环上含有3个取代基且能发生银镜反应的结构共有()(不考虑立体异构体)
A.8种B.10种C.11种D.13种
【答案】B
【解析】依题意,苯环上三个取代基分别为-COOH,-CHO,-Br,先写2个取代基的同分异构体有邻、间、对三种,它们的苯环上再取代一个溴原子,分别得到4、4、2种结构,共有10种结构。
10【氧化还原反应概念】工业上,可用硫酸铈[Ce(SO4)2]溶液吸收尾气中NO,其化学方程式如下:
2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4
A.在该反应中氧化剂与还原剂的物质的量之比为1∶2
B.在该反应中,氧化产物有两种,还原产物有一种
C.若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大
D.在该反应中,每消耗22.4LNO必转移2mol电子
【解析】A项,NO是还原剂,硫酸铈是氧化剂,氧化剂、还原剂的物质的量之比为2∶1,错误;
B项,Ce2(SO4)3为还原产物,HNO2、HNO3是氧化产物,正确;
C项,反应后溶液的酸性增强,pH减小,错误;
D项,没有限制“标准状况”,不能计算转移电子数目,错误。
11【离子浓度大小判断】已知:
常温下,H2C2O4的Ka1=5.4×
102、Ka2=5.4×
105;
某弱酸的电离常数Ka与对应阴离子的水解常数为Kh,二者关系为Ka•Kh=Kw。
下列有关离子浓度大小判断正确的是()
A.0.1mol·
L1KHC2O4溶液中:
c(K)>c(HC2O4)>c(C2O42)>c(H2C2O4)
B.0.1mol·
L1NaHC2O4溶液和0.1mol·
L1NaOH溶液等体积的混合液:
c(Na)=2c(HC2O4)+c(C2O42)+2c(H2C2O4)
C.0.1mol·
L1NaHC2O4溶液和0.2mol·
c(Na)>c(OH)>c(HC2O4)>c(C2O42)>c(H)
D.0.2mol·
L1KHC2O4溶液和0.1mol·
L1KOH溶液等体积的混合液:
2c(H)+c(HC2O4)+2c(H2C2O4)=2c(OH)+c(C2O42)
【解析】根据电离常数知,HC2O4的水解常数Kh≈1×
1012,C2O42的水解常数Kh1≈1×
109,
HC2O4以电离为主,水解为次。
A项,KHC2O4溶液呈酸性,离子浓度大小顺序有:
c(K)>c(HC2O4)>c(C2O42)>c(H2C2O4),正确;
B项,混合溶液中溶质为Na2C2O4,物料守恒式为c(Na)=2c(HC2O4)+2c(C2O42)+2c(H2C2O4),错误;
C项,混合溶液中溶质为Na2C2O4,NaOH且浓度相等,离子浓度大小关系有:
c(Na)>c(OH)>c(C2O42)>c(HC2O4)>c(H),
错误;
D项,二者混合溶液中KHC2O4、K2C2O4的浓度相等,电荷守恒有:
c(K)+c(H)=c(OH)+c(HC2O4)+2c(C2O42),物料守恒有:
=
联立两式消除c(K)得:
c(H)+3c(H2C2O4)+c(HC2O4)=2c(OH)+c(C2O42),错误。
12【难溶电解质图像】AlPO4的沉淀溶解平衡曲线
如图所示(T2>T1。
A.图像中四个点的Ksp:
a=b>c>d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s)
Al3+(aq)+PO43(aq)△H<0
D.升高温度可使d点移动到b点
【解析】A项,溶度积只与温度有关,四个点对应的溶度积大小关系:
a=c=d<b,错误;
B项,b点溶度积大于a点,溶度积越大,对应的溶解度越大,正确;
C项,温度升高,溶度积越大,说明磷酸铝溶解过程是吸热过程,错误;
D项,升高温度,c(Al3)、c(PO43)都增大,升高温度不能使d点移动到b点,错误。
13【化学反应速率】在不同浓度(c)、不同温度下(T),某物质发生分解的瞬时反应速率如下表所示:
c/mol·
L1
υ/mol·
L1mol·
s1
T/K
1.00
0.08
0.06
0.04
273.15
3.00
2.40
1.80
1.20
298.15
6.00
5.00
4.00
T3
5.40
5.04
4.68
4.32
下列推断正确的是()
A.T3<273.15
B.同时改变起始浓度和温度,瞬时速率可能相等
C.该物质最适宜的分解条件是,温度为298.15K,起始浓度为1.0mol·
D.该分解反应一定是熵增、焓增反应
【解析】A项,起始浓度相同时,温度越高,反应速率越大,T3<298.15K,错误;
B项,从表格数据看出,273.15K、1mol·
L1时分解速率与298.15K、0.04mol·
L1时的瞬时速率相等,正确;
C项,表格列出条件有限,不能得出最佳分解条件,错误;
D项,根据瞬时速率不能得到焓变、熵变方向,错误。
14【化学平衡原理】在密闭容器中投入一定量反应物发生储氢反应:
LaNi5(s)+3H2(g)
LaNi5H6(s)
=-301kJ·
mol1
在某温度下,达到平衡状态,测得氢气压强为2MPa;
若温度不变,缩小体积至原来的一半,重新达到平衡。
下列说法不正确的是()
A.当LaNi5的浓度不再变化时,表明达到平衡状态
B.重新达到新平衡时H2的压强仍然为2MPa
C.扩大容器体积,重新达到平衡时n(H2)增多
D.增大压强、降低温度,有利于储氢
【解析】A项,在固气反应中,固体的浓度始终不变,不能根据固体浓度判断是否达到平衡状态,错误;
B项,平衡常数Kp=
温度不变,平衡常数不变,故H2的平衡压强不变,正确;
C项,扩大容积相当于减压,平衡向左移动,H2的物质的量增多,正确;
D项,正反应是放热反应,正反应是气体分子数减小的反应,增大压强、降低温度有利于平衡向右移动,有利于提高储氢百分率,正确。
15【实验方案设计】下列实验方案、现象与实验结论都正确的是()
实验操作及现象
实验结论
向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液;
产生白色沉淀
NO3在酸性条件下能氧化SO2生成SO42
向Fe(NO3)2溶液中滴加少量盐酸;
浅绿色变深绿色
溶液中存在Fe2+水解平衡移动
向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;
用激光灯照射液体,有一条明亮“通路”
该液体分散质直径介于1nm与100nm之间
向FeI2溶液中滴加酸化的双氧水和淀粉溶液;
溶液为蓝色
Fe2的还原性比I的还原性弱
【解析】A项,可能是铁离子氧化SO2,错误;
B项,优先发生反应:
3Fe2++NO3+4H=3Fe3++NO↑+2H2O,溶液变成黄色,错误;
C项,制备氢氧化铁胶体、胶体本质和性质等,正确;
D项,只能说明双氧水氧化了碘离子,不能说明碘离子的还原性比亚铁离子的强,错误。
二、非选择题(本题包括6小题分)
15(15分)
【实验设计】氮化锂是一种优良的贮氢材料,它是一种紫色或红色的晶状固体,在空气中长期暴露,最终会变成碳酸锂。
氮化锂易水解生成氢氧化锂和氨气,在空气中加热能剧烈燃烧,特别是细粉末状的氮化锂;
锂与氨反应生成LiNH2和H2。
实验室用干燥、纯净的N2与金属锂(密度为0.534g·
cm3)反应制取氮化锂。
某课题组拟选择下列装置完成实验(装置可重复使用):
回答下列问题:
(1)若实验室用生石灰与浓氨水混合制备少量氨气,气流从左至右,选择上述装置制备少量氮化锂。
装置连接顺序为。
(2)E装置的作用是;
写出D中化学方程式为。
(3)实验步骤如下:
①装药品②引发反应产生氨气③检查装置气密性④点燃C处酒精灯⑤点燃D处酒精灯正确的先后顺序为。
(填序号)
(4)实验室保存锂的方法是;
写出C中的化学方程式。
(5)设计简单实验证明C中产物为氮化锂:
。
【答案】
(1)A、F、D、E、C、F(3分)
(2)吸收氨气并干燥氮气(2分)CuO+2NH3
3Cu+N2+3H2O(2分)
(3)③①②⑤④(2分)
(4)锂保存在石蜡油中(1分)N2+6Li
2Li3N(2分)
(5)取少量产物于试管,滴入少量蒸馏水,用镊子夹一块湿润的红色石蕊试纸接近试管口,若试纸变蓝色,则产物有氮化锂,否则不含氮化锂(3分)
【解析】
(1)B装置适用“难溶块状固体与液体反应”,应选A装置制备氨气。
制备氨气、干燥氨气、氨气与氧化铜反应、除氨气并干燥氮气、氮气与锂反应、防空气中水蒸气进入装置。
装置可以重复使用,故正确的连接顺序为A、F、D、E、C、F。
(2)E装置有两个作用:
吸收未反应完全的氨气并干燥氮气。
根据实验目的和氧化还原反应原理知,氧化铜在加热条件下与氨气反应生成铜、氮气和水。
(3)实验步骤:
检查装置气密性、装药品、制氨气、通入氨气排空气、加热氧化铜制氮气、氮气排尽装置内空气、加热锂,故步骤序号为③①②⑤④。
(4)锂是活泼金属,密度小于煤油,应保存在石蜡中。
氮化锂中氮为-3价,锂为+1价。
(5)利用氮化锂与水反应产生NH3,检验NH3可以确认是否有氮化锂生成。
16(15分)
【定量与探究实验设计】亚硝酸钠可大量用于染料和有机合成工业。
请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。
写出反应的离子方程式。
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:
已知:
(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH外还有两种阴离子,其中一种是NO2,NO2与另一种阴离子的物质的量之比为。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是。
A.NaCl(aq)B.Na2CO3(aq)C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100mL溶液;
II.从步骤I配制的溶液中移取20.00mL加入锥形瓶中;
III.用cmol·
L1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体积为VmL。
①锥形瓶中发生反应的离子方程式为。
②滴定至终点的现象为。
③产品中NaNO2的纯度为(写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度(填“偏高”、“偏低”或“无影响”)
(1)Fe2++NO2+2H=Fe3++NO↑+H2O(2分)
(2)①避免硝酸分解,降低原料利用率(2分)②3∶1(1分)③B(1分)
(3)①5NO2+2MnO4+6H=5NO3+2Mn2++3H2O(2分)②溶液由无色变紫红色且半分钟不褪色(2分)③
×
100%(2分)④偏低(2分)
(1)在酸性条件下,氧化亚铁离子生成NO、铁离子和水。
(2)①温度过高,加快HNO3分解,导致原料利用率和产率都降低;
②由反应式知,n(NO2)=9mol,n(NO)=3mol
n(NaNO2)=6mol+3mol=9mol,n(NaNO3)=3mol。
③碳酸钠溶液中存在氢氧化钠,可以用碳酸钠溶液吸收NO、NO2制备亚硝酸钠。
(3)①酸性高锰酸钾溶液氧化NO2生成NO3、Mn2+等。
②若亚硝酸根离子完全反应,则滴加酸性高锰酸钾溶液使溶液为紫红色。
③计算时注意两点:
一是单位换算;
二是将体积进行换算。
n(KMnO4)=
mol,由电子守恒知,5n(KMnO4)=2n(NaNO2),m(NaNO2)=
mol×
69g·
mol1。
④滴定终点时仰视读数,读数小于实际体积,测得标准溶液体积偏小,导致结果偏低。
17(15分)
【无机化工流程】2Zn(OH)2•ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2•ZnCO3的工艺流程如下:
(1)当(NH4)2SO4,NH3·
H2O的混合溶液中存在c(NH4+)=2c(SO42)时,溶液呈(填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是(任写一种)。
(3)“浸取”时加入的NH3·
H2O过量,生成MnO2的离子方程式为。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?
用计算说明原因:
[已知:
Ksp(ZnS)=1.6×
1024,Ksp(CuS)=1.3×
1036]
(5)“沉锌”的离子方程式为。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是
(1)中(1分)
(2)搅拌、适当加热(2分)
(3)Mn2++H2O2+2NH3·
H2O=MnO2↓+2NH4++2H2O(3分)
(4)可行(1分)ZnS+Cu2=CuS+Zn2+K=
=1.2×
1012>>1×
105(3分)
(5)2Zn2++6HCO3=2Zn(OH)2•ZnCO3↓+5CO2↑+H2O(3分)
(6)(NH4)2SO4(2分)
(1)根据电荷守恒可推知溶液呈中性;
(2)从浓度、温度、接触面等角度分析影响化学反应速率的因素。
(3)在氨水作用下,双氧水氧化锰离子生成二氧化锰和铵离子、水。
(4)假设可行,计算平衡常数K,当K>105,反应已趋于完全。
(5)Zn2++2HCO3=Zn(OH)2↓+CO2↑,Zn2++HCO3=ZnCO3↓+H,H+HCO3=CO2↑+H2O,根据反应物和产物直接写出离子反应总方程式。
(6)滤液溶质的主要成分是硫酸铵
18(15分)
【离子综合推断与计算】在强酸性无色溶液中可能含下表离子组中若干种离子:
阳离子
Mg2、NH4+、Ba2、Al3+、Fe2+
阴离子
SiO32、MnO4、Cl、NO3、S2O32
实验I.取少量该溶液进行如下实验:
实验II.为了进一步确定该溶液组成,取100mL原溶液,向该溶液中滴加1mol·
L1NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
(1)不进行实验就可以推断,该溶液中一定不能大量存在的离子有(填离子符号)
(2)通过实验I可以确认该溶液中一定存在的阴离子是。
检验气体X的方法是;
固体Z的化学式为。
(3)写出实验II的图像中BC段的离子方程式为。
(4)A点对应的固体质量为g。
(5)通过上述信息,推算该溶液中阴离子的浓度为mol·
L1。
(1)Fe2、SiO32、S2O32、MnO4(2分)
(2)NO3(1分)用摄子夹一块湿润的红色石蕊试纸接近气体X,试剂变蓝色,则气体X为NH3(2分)Mg(OH)2(2分)
(3)Al(OH)3+OH=AlO2+2H2O(2分)
(4)1.36(3分)
(5)0.8(3分)
(1)该溶液呈强酸性,与酸反应的离子SiO32、S2O32不能大量存在;
原溶液无色,故Fe2、MnO4不存在。
(2)实验I知,加入稀硫酸,得到溶液,说明Ba2+不存在;
加入硝酸银溶液无沉淀产生,说明Cl不存在。
任何电解质溶液呈电中性,说明NO3一定存在。
从流程图看,气体X为氨气,固体Z为氢氧化镁。
(3)从实验II图像看出,氢氧化物与氢氧化钠反应,BC段发生反应为Al(OH)3+NaOH=NaAlO2+2H2O
(4)图像中A点代表金属离子恰好完全沉淀,n(Al3)=0.01mol,
n(Mg2)=
=0.01mol。
A点对应的沉淀为氢氧化镁、氢氧化铝,其总质量为(58g·
mol1+78g·
mol1)×
0.01mol=1.36g
(5)滴加氢氧化钠溶液至B点时,产物为NH3·
H2O、Mg(OH)2、Al(OH)3、NaNO3
c(NO3)=
=0.8mol·
19(15分)
【化学反应原理综合】N2H4(肼)可作用制药的原料,也可作火箭的燃料。
(1)肼能与酸反应。
N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
①N2H62++H2O
N2H5++H3O平衡常数K1
②N2H5++H2O
N2H4+H3O平衡常数K2
相同温度下,上述平衡常数K2<<K1,其主要原因是。
(2)工业上,可用次氯酸钠与氨反应制备肼,副产物对环境友好,
写出化学方程式。
(3)肼在催化剂作用下分解只产生两种气体,其中一种气体能使红色石蕊试纸变蓝色。
在密闭容器中发生上述反应,平衡体系中肼气体的体积分数与温度关系如图1所示。
该反应的正反应
0(填:
<、>或=,下同);
P2P1。
(4)已知热化学反应方程式:
反应I:
N2H4(g)
N2(g)+2H2(g)
1;
反应II:
N2(g)+3H2(g)
2NH3(g)
2。
①
1
2(填:
<、>或=)
②7N2H4(g)
8NH3(g)+3N2(g)+2H2(g)
=(用
1、
2表示)。
③向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应I,
测得混合物体系中,
(用y表示