化学竞赛初赛配合物练习Word文档下载推荐.docx
《化学竞赛初赛配合物练习Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《化学竞赛初赛配合物练习Word文档下载推荐.docx(11页珍藏版)》请在冰豆网上搜索。
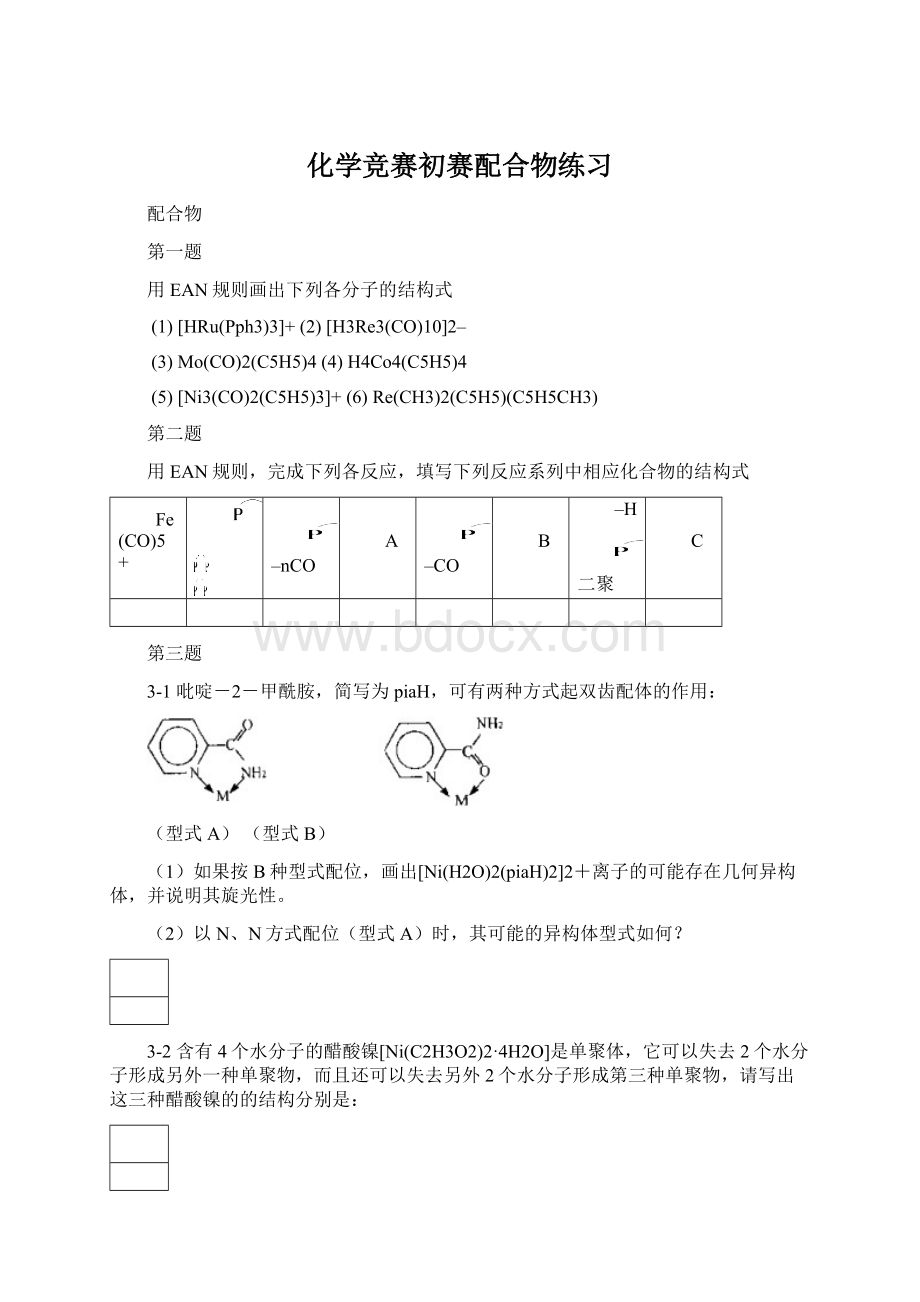
3-2含有4个水分子的醋酸镍[Ni(C2H3O2)2·
4H2O]是单聚体,它可以失去2个水分子形成另外一种单聚物,而且还可以失去另外2个水分子形成第三种单聚物,请写出这三种醋酸镍的的结构分别是:
3-3AgClO4在苯中的溶解性明显高于在烷烃中的溶解性,试解释该事实:
3-4液体氟化氢是酸性溶剂,具有相当强的的Lewis酸性和较高的相对介电常数。
HF是离子型物质的优良溶剂,但其高活性和毒性给操作带来困难。
(1)LiF溶于HF产生两种离子;
从物质结构作用力考虑能够发生这个反应的原因是。
(2)醋酸在水中是个酸,在HF里却是碱,写出反应方程式。
(3)高氯酸在HF中呈现两性,分别写出反应方程式。
第四题
请回答关于配合物的一些问题。
4-1有人想利用氨水与三氯化钴反应制取三氯化六氨合钴,结果实验失败。
请解释
失败原因,并提出一个制备三氯化六氨合钴的可行方案。
4-2配合物Fe(H2O)6
2+的八面体场分裂能为13700cm-1,电子成对能为30000cm-1。
请说明该离子的杂化方式和d电子分布,计算该离子的磁矩。
4-3下列配合物各有几种异构体?
其中几种有手性?
有手性的原因是什么?
(1)[Co(H2NCH2CH2NMe2)2Cl2]Cl
(2)[Co(H2NCH2CH2NHCH2CH2NMe2)BrCl2]
4-4如何用简单的化学方法区分异构体[Co(NH3)5(NO2)]Cl2和[Co(NH3)5(ONO)]Cl2?
第五题
铂的配合物{Pt(CH3NH2)(NH3)[CH2(COO)2]}是一种抗癌药,药效高而毒副作用小,其合成路线如下:
K2PtCl4
A(棕色溶液)
B(黄色晶体)
C(红棕色固体)
D(金黄色晶体)
E(淡黄色晶体)
在(I)中加入过量KI,反应温度为70℃;
(II)中加入CH3NH2,A与CH3NH2的反应摩尔比为1:
2;
(III)中加入HClO4和乙醇,红外光谱显示C中有两种不同振动频率的Pt-I键,而且C分子呈中心对称,经测定C的相对分子质量为B的1.88倍;
在(IV)中加入适量的氨水,得到极性化合物D;
在(V)中加入Ag2CO3和丙二酸,滤液经减压蒸馏得到E。
在整个合成过程中铂的配位数不变,铂原子的杂化轨道类型为dsp2。
(1)画出A、B、C、D、E的结构式
(2)从目标产物E的化学式中并不含碘,请问:
将K2PtCl4转化为A的目的何在?
(3)合成路线的最后一步加入Ag2CO3起到什么作用?
第六题
化合物的种类繁多,一个重要的因素是许多化合物存在同分异构现象(isomerism),试画出(Me2PCH2CH2PMe2)2Fe(CO)的所有可能的立体异构体。
(Me=CH3)。
在结构式中Me2PCH2CH2PMe2可简化成
(双齿配体)
第七题
试画出二氯二氨合铂(II)的几何异构体。
如果用1,2—二氨基环丁烯二酮代替两个NH3,与铂配位,生成什么结构的化合物?
有无顺反异构体?
若把1,2—二氨基环丁烯二酮上的双键加氢,然后再代替两个NH3与铂配位,生成什么化合物?
(画出所有可能的结构式)
第八题
RuCl2(H2O)4+有两种异构体:
A和B;
RuCl3(H2O)3也有两种异构体:
C和D。
C和D分别按下式水解,均生成A:
C或D+H2O===A+Cl–
写出A、B、C、D、的结构并说明C或D水解产物均为A的原因。
第九题
在NH4Cl水溶液中,用空气氧化碳酸钴(II),可以得到有光泽红色的—氯化物A(Co:
NH3:
Cl为1:
4:
1)。
在0℃下将固体A加入用HCl气体饱和的无水乙醇中,在室温下有气体迅速放出。
将其振摇至不再有气体发生,得到蓝灰色固体B,B是一种混合物。
将B过滤,用乙醇洗涤,然后用少量冷水洗涤。
所得主要产物再经过一系列提纯步骤,产生紫色晶体C(化学式:
CoCl3·
4NH3·
0.5H2O)。
当C在浓盐酸中加热时,可以分离出一种绿色化合物D,经分析为CoCl3·
HCl·
H2O。
D可溶于冷水,加浓盐酸就沉淀出来。
请回答下列问题:
(1)A~D分别代表何种化合物?
请分别画出C与D中配离子的立体结构。
(2)写出并配平所有的化学方程式。
(3)试根据C与D中的配离子的立体结构判断它们的极性,并简要说明理由。
(4)用少量冷水洗涤B的目的何在?
浓盐酸在D的形成中起什么作用?
(5)C与D之间的转化属于一种什么类型的反应?
(6)由题给条件和提示,说明你所推测的化学反应发生的依据(只要回答推测C和D)。
提示:
a.已知可被拆分的异构体形式是紫色的,并且在溶液中存在如下平衡
紫色—[CoCl2(en)2]Cl
在饱和HCl中蒸发
水溶液在蒸气浴上浓缩
绿色—[CoCl2(en)2]Cl·
2H2O
b.若用阳离子交换色谱柱吸附了适量固体B的水溶液,然后用合适的淋洗剂淋洗,可以观察到色谱柱上主要形成两条色带,先淋洗出的为少量绿色溶液,然后收集到较多的紫色溶液。
第十题
配位化学是化学的一个重要分支。
在十九世纪,维尔纳的老师认为:
六配位化合物是一种链式结构,如:
M—A—B—C—D—E—F或M—B—A—C—D—E·
·
;
而维尔纳认为:
六配位化合物是一种八面体。
10-1
请你设想一下:
维尔纳是如何否定老师的论断得出他的正确结论的?
在配合物中,乙酰丙酮(CH3COCH2COCH3)是常见的一种配体。
请继续回答下列问题:
10-2
乙酰丙酮(
)可作双齿配体。
请从有机化学的角度加以解释。
10-3
某同学用乙酰丙酮与CoCl2、H2O2在一定条件下反应得到一晶体A。
为测定晶体组成,该同学设计以下实验:
准确称取A晶体0.4343g,煮沸溶解后,用氢离子交换树脂(即HR型)充分交换至看不出有Co2+的红色,过滤;
用0.1013mol/L的NaOH标准溶液滴定,用去24.07mL。
(原子量请用:
Co:
58.93、H:
1.01、C:
12.01、O16.00、CI:
35.45)求:
10-3-1A中Co的质量分数。
10-3-2预测A的化学式,画出A的结构并写出Co的杂化形态。
10-3-3写出制备A的化学反应方程式。
10-3-4在铁粉的催化下,A能与液溴发生取代反应。
试写出其化学反应方程式。
阐述其原因。
配合物答案
3.
(1)
(2)
(3)
(4)
(5)
(6)
4.A:
B:
C:
3-1
(1)有5种几何异构体(2分),其中水分子在相邻位置的的有3种,这三种都有旋光异构(1分)(图略)
(2)分子中的两个N原子的周围环境不同,所以A型式和B型式异构体完全一样。
(1分)
3-2
(1)
(1分)
(2)
3-3苯的π电子可以和Ag+的空轨道形成配合物[Ag-C6H6]+(2分)
3-4
(1)LiF+HF→Li++[FHF]-(1分),HF与F-之间形成氢键的能力比较强(1分)
(2)CH3COOH+2HF→[CH3COOH2]++[FHF]-(1分)
(3)HClO4+2HF→H2ClO4++[FHF]-(1分)
HClO4+HF→ClO4-+H2F+(1分)
4-1(2分)
三氯化六氨合钴稳定性不是很高,同时氨水碱性较强,造成溶液pH明显升高,形
成Co(OH)3沉淀不溶于氨水(1分)。
改进方案可以用无水三氯化铬和液氨反应(1分)。
4-2(3分)
杂化方式sp3d2(1分),d电子分布t2g
4eg
2(1分),磁矩4.90B.M.(1分,不要求
有效数字)
4-3(4分)
(1)5种几何异构体(1分),其中3种有旋光异构体(0.5分)
(2)4种几何异构体(1分),其中2种有旋光异构体(0.5分)
因为这些异构体没有对称面,没有对称中心,也没有S4映轴(1分)
4-4(2分)
将这两种物质溶解后加入强酸酸化,如有气体产生则为[Co(NH3)5(ONO)]Cl2,无变
化则为[Co(NH3)5(NO2)]Cl2
(用红外光谱法或者观察颜色鉴别均不得分)
由于AgI的溶解度大大小于Ag2CO3,加入Ag2CO3后,可以使D中的配体I-脱离中心体而利于丙二酸根离子的配位。
Pt(NH3)2Cl2:
(1)A:
[Co(NH3)4CO3]Cl
B:
C、D混合物
C:
顺式—[Co(NH3)4Cl2]Cl
D:
反式—[Co(NH3)4Cl2]Cl
(2)4CoCO3+O2+4NH4Cl
4[Co(NH3)4CO3]Cl+H2O
[Co(NH3)4CO3]Cl+2HCl
cis-[Co(NH3)4Cl2]Cl+CO2+H2O
trans-[Co(NH3)4Cl2]Cl+CO2+H2O
(3)C中配离子的极性大于D中配离子的极性,因为结构对称的配离子是D,而结构不对称的配离子是C。
(4)用少量水洗涤的目的是把D洗掉,因为D溶于冷水,当C在浓盐酸中加热,可分离出一种绿色化合物D,这显然是浓盐酸的作用。
(5)C和D属于几何(顺—反)异构体,所以C与D之间的转化属于顺反异构转化反应。
(6)从提示来看:
a.紫色—[CoCl2(en)2]+可以拆分成左旋与右旋异构体,所以紫色化合物属于顺式结构,因为紫色物种无对称面,有光学异构体;
b.在阳离子交换色谱柱上先淋洗下来的是少量绿色溶液,这说明绿色物种是反式—[Co(NH3)4Cl2]+,因为反式结构无极性,所以在柱子上吸附能力弱,先被淋洗下来。
从a、b提示中我们可以判断C是cis-[Co(NH3)4Cl2]+,D是trans-[Co(NH3)4Cl2]+。
10-1链式结构无旋光异构体,而八面体具有旋光异构关系。
若发现某配合物用旋光仪测得有旋光性,且配位数为6,则该配合物一定是八面体结构。
(2分)
10-2乙酰丙酮之所以可作为双齿配体,是因为该物质始终存在烯醇式和酮式的互变异构:
10-3
(1)n(Co)=
n(H+)=
×
=
=0.001219mol;
MA=
,Co%=
(2)由MA推出应为Co(C5H7O2)3;
注意不能写为Co(C5H8O2)3。
sp3d2。
(3)CH3COCH2COCH3+CoCl2+2H2O2→Co(CH3COCHCOCH3)3+H2O+2HCl+1/2O2(1分)
+3Br2
+3HBr。
螯环的中央氢原子在两端羰基的作用下,呈现出部分酸性,可以在明显亲电条件下被Br+取代。