海南高考化学部分及解析解析Word文档下载推荐.docx
《海南高考化学部分及解析解析Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《海南高考化学部分及解析解析Word文档下载推荐.docx(38页珍藏版)》请在冰豆网上搜索。
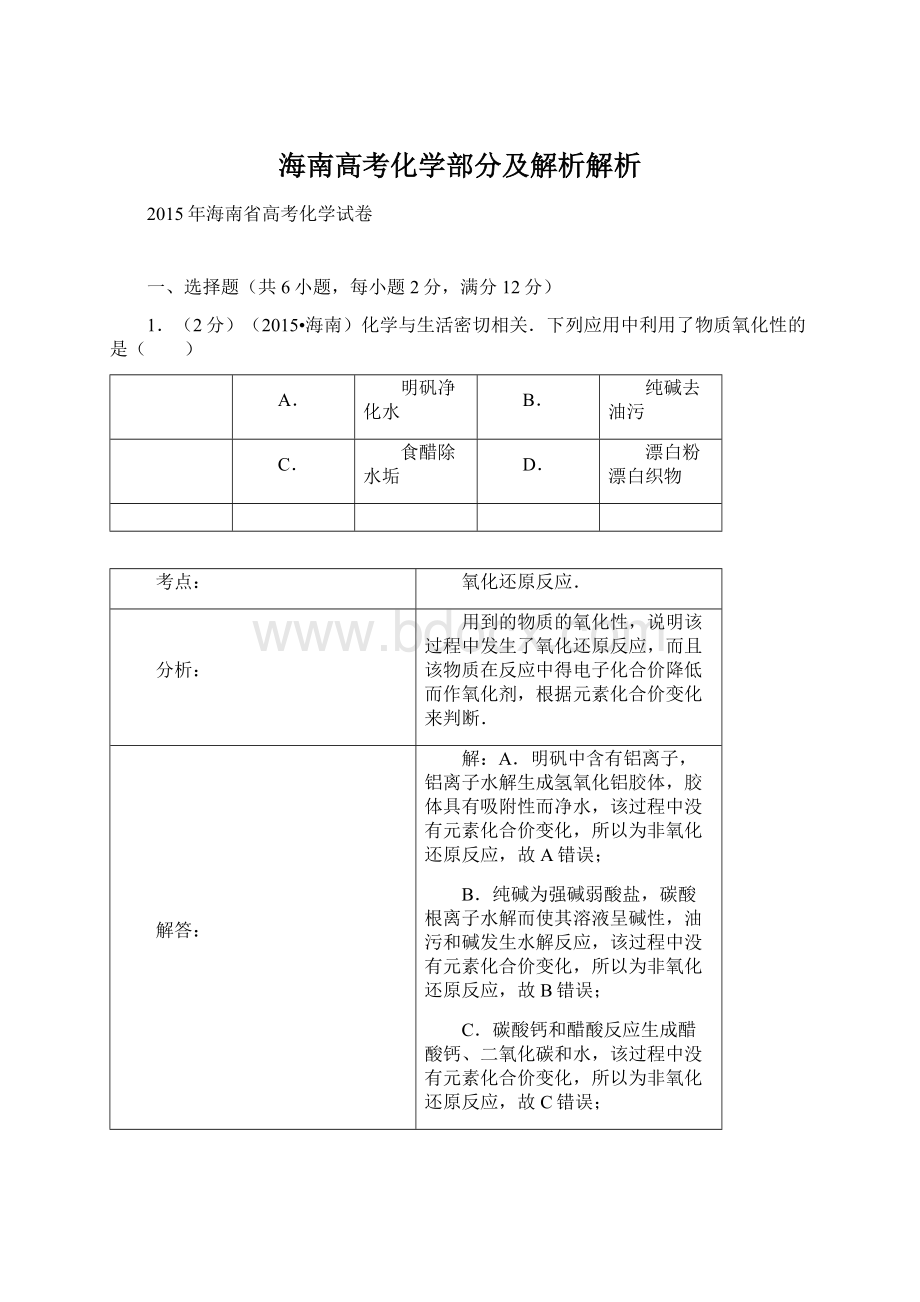
Na+
Mg2+
O2﹣
F﹣
微粒半径大小的比较.
电子层越多的离子半径越大,电子层一样的离子,核电荷数越多半径越小,据此来回答.
四种离子均含有2个电子层,而且电子排布相同,其核电荷数越大,离子半径越小,则离子半径:
O2﹣>F﹣>Na+>Mg2+,所以O2﹣的半径最大,
故选:
本题考查学生离子半径大小的比较方法知识,注意知识的积累是解题的关键,难度不大,侧重于基础知识的考查.
3.(2分)(2015•海南)0.1mol下列气体分别与1L0.1mol•L﹣1的NaOH溶液反应,形成的溶液pH最小的是( )
NO2
SO2
SO3
CO2
pH的简单计算.
0.1mol下列气体分别与1L0.1mol•L﹣1的NaOH溶液反应,二者的物质的量相同,
NO2与NaOH等物质的量反应的方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O;
SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3;
SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4;
CO2与NaOH等物质的量反应的方程式为NaOH+CO2=NaHCO3,根据反应产物的酸碱性判断.
2NO2+2NaOH=NaNO2+NaNO3+H2O,NaNO2为强碱弱酸盐,溶液显碱性;
SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3,NaHSO3在溶液中即电离又水解,电离程度大于水解程度,溶液显弱酸性;
SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4,NaHSO4在溶液中完全电离出氢离子,溶液显强酸性;
CO2与NaOH等物质的量反应的方程式为NaOH+CO2=NaHCO3,NaHCO3在溶液中即电离又水解,水解程度大于电离程度,溶液显弱碱性;
综上可知,形成的溶液pH最小的是SO3;
本题考查了物质的性质,题目涉及元素化合物的性质、盐的水解、弱电解质的电离,题目难度中等,注意根据物质之间反应判断产物以及溶液的酸碱性.
4.(2分)(2015•海南)已知丙烷的燃烧热△H=﹣2215kJ•mol﹣1.若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
55kJ
220kJ
550kJ
1108kJ
有关反应热的计算.
已知丙烷的燃烧热△H=﹣2215kJ•mol﹣1,则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2215kJ•mol﹣1,根据生成水的质量计算放出的热量.
已知丙烷的燃烧热△H=﹣2215kJ•mol﹣1,则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2215kJ•mol﹣1,
一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为
=55.375kJ≈55kJ;
本题考查了燃烧热的概念、反应热的计算,题目难度不大,注意把握燃烧热的概念即1mol纯物质完全燃烧生成稳定氧化物放出的热量.
5.(2分)(2015•海南)分子式为C4H10O并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
3种
4种
5种
6种
真题集萃;
同分异构现象和同分异构体.
分子式为C4H10O并能与金属钠反应放出氢气,为饱和一元醇,可以写成C4H9OH,其中丁基有四种结构.
分子式为C4H10O并能与金属钠反应放出氢气,为饱和一元醇,可以写成C4H9OH,其中丁基有四种结构,故符合条件的有机物共有4种,故选B.
本题考查同分异构体判断,难度不大,注意常见烃基的种类,如甲基和乙基1种,丙基有2种,丁基有4种,也可以书写出具体的醇进行判断.
6.(2分)(2015•海南)已知在碱性溶液中可发生如下反应:
2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )
+3
+4
+5
+6
根据电荷守恒得3×
1+4×
1=3×
1+2n,则n=2,所以RO4n﹣为RO42﹣,该离子中O元素化合价为﹣2价,R、O元素化合价的代数和为﹣2,据此判断R元素化合价.
1+2n,则n=2,所以RO4n﹣为RO42﹣,该离子中O元素化合价为﹣2价,R、O元素化合价的代数和为﹣2,所以该离子中R元素化合价=﹣2﹣(﹣2)×
4=+6,故选D.
本题以氧化还原反应为载体考查元素化合价判断,根据电荷守恒、离子中各元素化合价的代数和分析解答即可,侧重考查分析计算能力,题目难度不大.
二、选择题(共6小题,每小题4分,满分24分.每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选得0分;
若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
)
7.(4分)(2015•海南)下列叙述正确的是( )
稀盐酸可除去烧瓶内残留的MnO2
可用磨口玻璃瓶保存NaOH溶液
稀硝酸可除去试管内壁的银镜
煮沸自来水可除去其中的Ca(HCO3)2
硝酸的化学性质;
钠的重要化合物.
A.稀盐酸不能与二氧化锰反应;
B.玻璃中含有二氧化硅,能与氢氧化钠反应生成硅酸钠;
C.Ag与稀硝酸反应生成硝酸银、NO与水,可以除去试管内壁的银镜;
D.自来水煮沸,Ca(HCO3)2可以转化为CaCO3.
A.稀盐酸不能与二氧化锰反应,用浓盐酸、加热除去烧瓶内残留的MnO2,故A错误;
B.玻璃中含有二氧化硅,能与氢氧化钠反应生成硅酸钠,硅酸钠为无机矿物胶,使瓶塞与瓶口粘连在一起,故B错误;
C.Ag与稀硝酸反应生成硝酸银、NO与水,可以除去试管内壁的银镜,故C正确;
D.自来水煮沸,Ca(HCO3)2可以转化为CaCO3,使硬水得到软化,故D正确,
CD.
本题考查元素化合物性质、试剂保持、硬水软化等,比较基础,注意对基础知识的理解掌握.
8.(4分)(2015•海南)10mL浓度为1mol•L﹣1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
K2SO4
CH3COONa
CuSO4
Na2CO3
化学反应速率的影响因素.
为了减缓反应进行的速率,加热溶液后可以降低氢离子难度,但又不影响生成氢气的总量,则提供的氢离子的总物质的量不变,而C选项中构成原电池,加快反应速率,D选项中碳酸钠反应消耗氢离子,生成氢气的总量减少.
A.加入K2SO4溶液,相当于加水稀释,溶液中氢离子降低,且氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故A正确;
B,加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故B正确;
C.Zn可以置换出Cu,构成原电池,加快反应速率,故C错误;
D.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误,
AB.
本题考查化学反应速率影响因素,比较基础,需注意生成氢气的量不变,注意C选项构成原电池,加快反应速率.
9.(4分)(2015•海南)下列反应不属于取代反应的是( )
淀粉水解制葡萄糖
石油裂解制丙烯
乙醇与乙酸反应制乙酸乙酯
油脂与浓NaOH反应制高级脂肪酸钠
取代反应与加成反应.
有机物中原子或原子团被其它原子或原子团取代的反应为取代反应,如水解反应、酯化反应等,以此来解答.
A.淀粉水解制葡萄糖,为水解反应,也属于取代反应,故A不选;
B.石油裂解制丙烯,为大分子转化为小分子的反应,不属于取代反应,故B选;
C.乙醇与乙酸反应制乙酸乙酯,为酯化反应,也属于取代反应,故C不选;
D.油脂与浓NaOH反应制高级脂肪酸钠,为油脂的水解反应,也属于取代反应,故D不选;
故选B.
本题考查有机物的性质及反应类型,为基础性习题,把握有机物的性质、反应类型的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.
10.(4分)(2015•海南)下列指定微粒的数目相等的是( )
等物质的量的水与重水含有的中子数
等质量的乙烯和丙烯中含有的共有电子对数
同温、同压、同体积的CO和NO含有的质子数
等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数
物质的量的相关计算.
A.H2O中的中子数为8,D2O中的中子数为10;
B.乙烯和丙烯的最简式均为CH2,由n=
可知,等质量时含CH2的个数相同;
C.同温、同压、同体积,由n=
可知,气体的物质的量相同;
D.铁和铝分别与足量氯气完全反应,Fe、Al元素的化合价均由0升高为+3价.
A.H2O中的中子数为8,D2O中的中子数为10,则等物质的量的水与重水含有的中子数不同,故A错误;
可知,等质量时含CH2的个数相同,1个C2H4分子共用6对电子(其中4个C﹣H,2个C﹣C),1个C3H6分子共用9对电子(其中6个C﹣H,3个C﹣C),因此可以发现规律:
1个CH2平均共用3对电子,含CH2的个数相同则共有电子对数相同,故B正确;
可知,气体的物质的量相同,C、N的质子数不同,则CO和NO含有的质子数不同,故C错误;
D.铁和铝分别与足量氯气完全反应,Fe、Al元素的化合价均由0升高为+3价,则等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数均为n×
(3﹣0)NA,故D正确;
故选BD.
本题考查物质的量的计算,为高频考点,把握物质的构成、物质的量计算公式、转移电子计算等为解答的关键,侧重分析与应用能力、计算能力的考查,题目难度不大.
11.(4分)(2015•海南)下列曲线中,可以描述乙酸(甲、Ka=1.8×
10﹣5)和一氯乙酸(乙、Ka=1.4×
10﹣3)在水中的电离度与浓度关系的是( )
弱电解质在水溶液中的电离平衡.
由乙酸(甲、Ka=1.8×
10﹣3)可知,乙酸的Ka小,则乙酸的酸性弱;
等浓度时酸性强的电离度大;
弱酸的浓度越大,其电离度越小,以此来解答.
由图可知,横坐标为浓度,纵坐标为电离度,则等浓度时酸性强的电离度大,即乙的曲线在上方,可排除A、C;
弱酸的浓度越大,其电离度越小,则曲线甲、乙均随浓度的增大而下降,可排除D,显然只有B符合,
本题考查弱电解质的电离,为高频考点,把握Ka与酸性的关系、弱酸的电离度与浓度的关系及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度不大.
12.(4分)(2015•海南)a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
d元素的非金属性最强
它们均存在两种或两种以上的氧化物
只有a与其他元素生成的化合物都是离子化合物
b、c、d分别与氢气形成的化合物中化学键均为极性共价键
原子结构与元素的性质.
a的M电子层有1个电子,应为Na元素,b的最外层电子数为内层电子数的2倍,应为C元素,c的最高化合价为最低化合价绝对值的3倍,应为S元素,c与d同周期,d的原子半径小于c.应为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
a的M电子层有1个电子,应为Na元素,b的最外层电子数为内层电子数的2倍,应为C元素,c的最高化合价为最低化合价绝对值的3倍,应为S元素,c与d同周期,d的原子半径小于c.应为Cl元素,
A.同周期元素从左到右元素的非金属性逐渐增强,元素非金属性强弱顺序为Cl>S>C>Na,故A正确;
B.四种元素形成的氧化物有CO、CO2;
Na2O、Na2O2;
SO2、SO3,而Cl的化合价有多种,则氧化物也有多种,如ClO2、Cl2O等,故B正确;
C.a为Na,为金属,可与其他元素生成离子化合物,含有离子键,故C正确;
D.b为C,可与氢气反应生成C2H2、C2H4、C2H6等化合物,含有同种元素形成的共价键,为非极性键,故D错误.
本题为2015年考题,涉及原子结构与元素周期率的考查,侧重于学生的分析能力的培养和原子结构、元素周期率的综合应用的考查,注意把握提给信息以及元素周期率的递变规律,难度不大.
三、解答题(共5小题,满分44分)
13.(8分)(2015•海南)乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:
回答下列问题:
(1)A的结构简式为 CH3COOH .
(2)B的化学名称是 乙酸乙酯 .
(3)由乙醇生成C的反应类型为 取代反应 .
(4)E是一种常见的塑料,其化学名称是 聚氯乙烯 .
(5)由乙醇生成F的化学方程式为 CH3CH2OH
CH2=CH2↑+H2O .
有机物的推断.
乙醇被氧化生成A,且A能和乙醇反应,根据A的分子式知,A为CH3COOH,A在浓硫酸作催化剂、加热条件下发生消去反应生成F,F为CH2=CH2,乙醇和氯气在光照条件下发生取代反应生成C,C在浓硫酸作催化剂、加热条件下能发生消去反应,则C结构简式为CH2ClCH2OH、D为CH2=CHCl,D发生聚合反应生成聚氯乙烯,E结构简式为
,A和乙醇在浓硫酸作催化剂、加热条件下发生酯化反应生成B,B为CH3COOCH2CH3,据此分析解答.
,A和乙醇在浓硫酸作催化剂、加热条件下发生酯化反应生成B,B为CH3COOCH2CH3,
(1)A是乙酸,A的结构简式为CH3COOH,故答案为:
CH3COOH;
(2)B为CH3COOCH2CH3,B的化学名称是乙酸乙酯,故答案为:
乙酸乙酯;
(3)C是2﹣氯乙醇,由乙醇生成C的反应类型为取代反应,故答案为:
取代反应;
(4)E结构简式为
,其化学名称是聚氯乙烯,故答案为:
聚氯乙烯;
(5)F是乙烯,乙醇在浓硫酸作催化剂、加热170℃条件下,乙醇发生消去反应生成乙烯,反应方程式为CH3CH2OH
CH2=CH2↑+H2O,
故答案为:
CH3CH2OH
CH2=CH2↑+H2O.
本题为2015年海南高考题,考查有机物推断,侧重考查学生分析推断能力,涉及乙醇、乙烯、卤代烃、羧酸、酯、高分子化合物之间的转化,明确常见有机物官能团及其性质、常见有机反应类型及反应条件即可解答,注意乙醇制取乙烯必须控制好温度.
14.(8分)(2015•海南)单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备.其中X为Z的氧化物;
Y为氢化物,分子结构与甲烷相似.回答下列问题:
(1)能与X发生化学反应的酸是 氢氟酸 ;
由X制备Mg2Z的化学方程式为 SiO2+Mg
O2↑+Mg2Si .
(2)由Mg2Z生成Y的化学方程式为 Mg2Si+4HCl=2MgCl2+SiH4 ,Y分子的电子式为
.
(3)Z、X中共价键的类型分别是 非极性键 、 极性键 .
无机物的推断.
常见的半导体材料为Si,X为Z的氧化物,那么X为二氧化硅;
Y为氢化物,且分子结构与甲烷相似,那么Y为硅烷,结构简式为:
SiH4,据此结合各小题解答即可.
(1)二氧化硅为酸性氧化物,不溶于一般的酸,但是能溶于氢氟酸,此性质常用于腐蚀玻璃,由流程可知,二氧化硅与金属镁反应生成硅化镁,化学反应方程式为:
SiO2+Mg
O2↑+Mg2Si,故答案为:
氢氟酸;
O2↑+Mg2Si;
(2)硅化镁与盐酸反应生成硅烷,化学反应方程式为:
Mg2Si+4HCl=2MgCl2+SiH4,硅烷类似与甲烷的正四面体结构,故Si分别与H形成1对共价键,电子式为:
,故答案为:
Mg2Si+4HCl=2MgCl2+SiH4;
;
(3)Z为Si,硅单质为原子晶体,晶体中存在Si﹣Si非极性共价键,X为SiO2,属于原子晶体,存在Si﹣O极性共价键,故答案为:
非极性键、极性键.
本题主要考查的是元素的推断以及硅和其化合物的知识,设计化学反应方程式书写、电子式以及共价键类型的判断,难度不大.
15.(9分)(2015•海南)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:
(1)久存的银制品表面会变黑,失去银白色光泽,原因是 Ag与空气中微量H2S反应生成黑色的Ag2S .
(2)已知Ksp(AgCl)=1.8×
10﹣10,若向50mL0.018mol•L﹣1的AgNO3溶液中加入50mL0.020mol•L﹣1的盐酸,混合后溶液中Ag+的浓度为 1.8×
10﹣7 mol•L﹣1,pH为 2 .
(3)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 2AgNO3
2Ag+2NO2↑+O2↑ .
(4)如图所示原电池正极的反应式为 Ag++e﹣=Ag .
原电池和电解池的工作原理;
难溶电解质的溶解平衡及沉淀转化的本质.
(1)长期放置在空气中的银制品,其表面会逐渐变黑,这是由于银和空气中的微量硫化氢发生了反应生成黑色的Ag2S;
(2)n(AgNO3)=0.05L×
0.018mol/L=0.0009mol,n(HCl)=0.05L×
0.020mol/L=0.001mol,硝酸银和HCl发生反应AgNO3+HCl=AgCl↓+HNO3,根据方程式知,HCl剩余,混合溶液中c(Cl﹣)=
=10﹣3mol/L,溶液中c(Ag+)=
实际上氢离子不参加反应,则溶液中c(H+)=
=0.01mol/L,
溶液的pH=﹣lgc(H+);
(3)红棕色气体是NO2,该反应中Ag元素化合价由+1价变为0价、N元素化合价由+5价变为+4价,根据氧化还原反应知,还有元素失电子化合价升高,只能是O元素失电子生成O2,根据反应物、生成物及反应条件书写方程式;
(4)该原电池中,Cu的活动性大于Ag,Cu易失电子发生氧化反应,所以Cu是负极、Ag是正极,正极上银离子得电子发生还原反应.
(1)长期放置在空气中的银制品,其表面会逐渐变黑,这是由于银和空气中的微量硫化氢发生了反应生成黑色的Ag2S,故答案为:
Ag与空气中微量H2S反应生成黑色的Ag2S;
=
mol/L=1.8×
10﹣7mol/L;
=0.01mol/L,溶液的pH=﹣lgc(H+)=﹣lg0.01=2,
1.8×
10﹣7;
2;
(3)红棕色气体是NO2,该反应中Ag元素化合价由+1价变为0价、N元素化合价由+5价变为+4价,根据氧化还原反应知,还有元素失电子化合价升高,只能是O元素失电子生成O2,根据反应物、生成物及反应条件书写方程式为2AgNO3
2Ag+2NO2↑+O2↑,故答案为:
2AgNO3
2Ag+2NO2↑+O2↑;
(4)该原电池中,Cu的活动性大于Ag,Cu易失电子发生氧化反应,所以Cu是负极、Ag是正极,正极上银离子得电子发生还原反应,电极反应式为Ag++e﹣=Ag,故答案为:
Ag++e﹣=Ag.
本题为2015年海南省高考题,考查原电池原理、氧化还原反应、pH计算、溶度积常数等知识点,综合性较强,明确正负极判断及其发生的反应