华东师大版春秋版九年级上学期期中科学试题D卷练习文档格式.docx
《华东师大版春秋版九年级上学期期中科学试题D卷练习文档格式.docx》由会员分享,可在线阅读,更多相关《华东师大版春秋版九年级上学期期中科学试题D卷练习文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
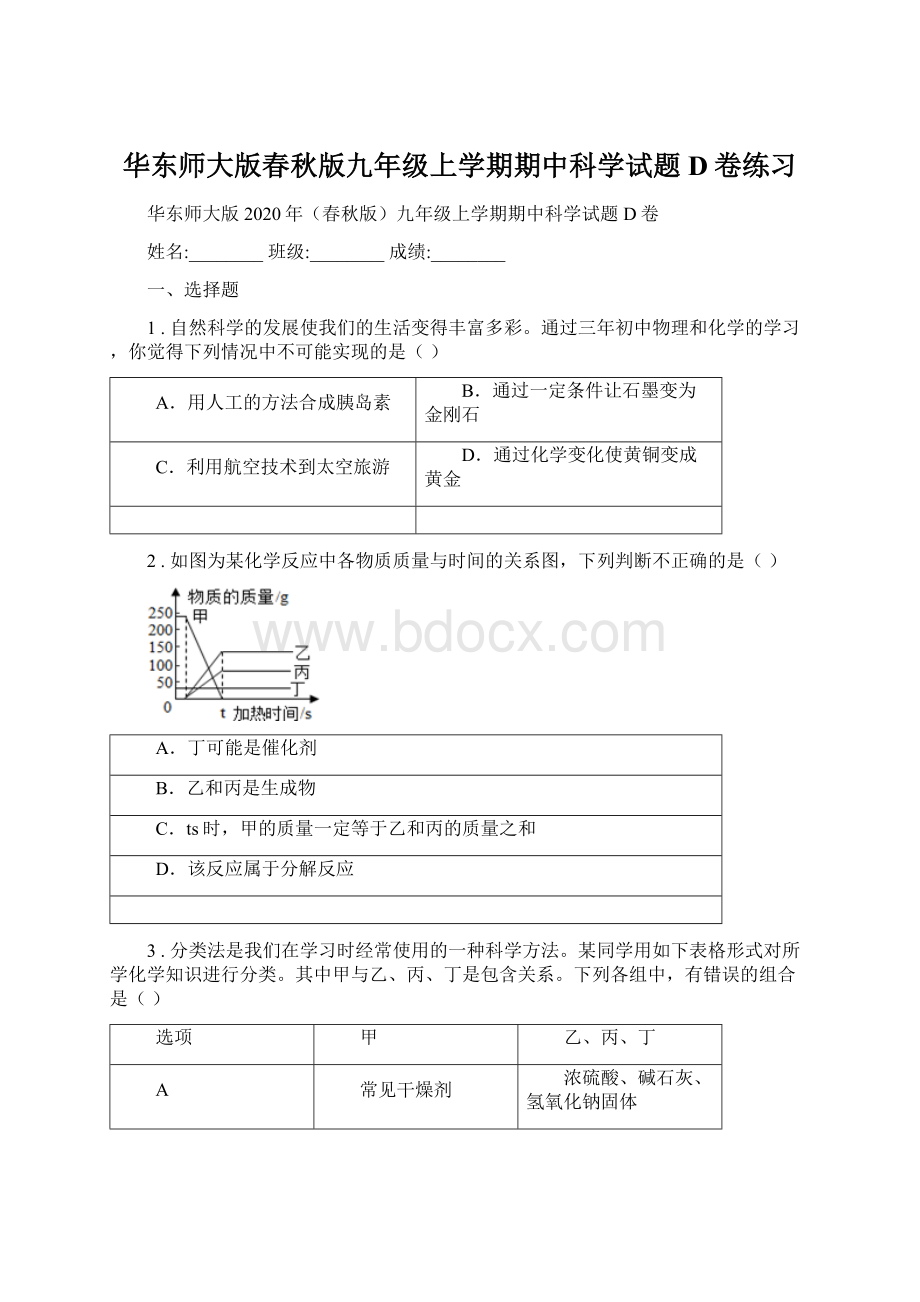
C.C
D.D
4.某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数。
向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气。
下列说法正确的是
A.当粉末为Cu~Fe合金时,反应所得溶液中一定含有Fe2+和Cu2+
B.当粉末为Cu~Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50%
C.当粉末为Al~Fe合金时,a<0.2g
D.当粉末为Al~Fe合金时,所需稀硫酸溶质质量分数>
9.8%
5.下列几种常见的测量工具中,其刻度线的分布不均匀的是()
A.刻度尺
B.温度计
C.量杯
D.体温计
6.某同学为了确定Fe、Cu、Hg三种金属的活动性顺序,用铁片、铜片、硝酸汞溶液和盐酸四种试剂设计了下列实验方案,其中可行的是()
A.Fe+HCl
Cu+HCl
Fe+Hg(NO3)2
f
B.Fe+HCl
Cu+Hg(NO3)2
C.Fe+HCl
D.Cu+HCl
7.下列各组离子在溶液中能大量共存,并形成无色溶液的是()
A.Ba2+、H+、OH-、Cl-
B.K+、Na+、Cl-、NO3-
C.K+、Fe3+、SO42-、NO3-
D.Ca2+、H+、CO32-、NO3-
8.下列方程式不符合变化事实的是()
A.敞口放置的氢氧化钠固体部分变质:
2NaOH+CO2═Na2CO3+H2O
B.服用含Al(OH)3的药物治疗胃酸过多:
Al(OH)3+3HCl═AlCl3+3H2O
C.金属铝防腐蚀的原因:
4Al+3O2=2Al2O3
D.用稀盐酸除铁锈:
Fe2O3+6HCl=2Fe2Cl3+3H2O
9.下表是常见的几种酸、碱、盐在水溶液中解离出来离子的情况,根据表中信息分析,得出的结论正确的是()
溶液
酸
盐
碱
HCl
H2SO4
NaCl
NaHSO4
NH4Cl
NaOH
NH3•H2O
解离出来的离子
H+、Cl-
H+、SO42-
Na+、Cl-
Na+、H+、SO42-
NH4+、Cl-
Na+、OH-
NH4+、OH-
A.在水溶液中能解离出H+的物质一定是酸
B.在水溶液中解离出金属阳离子和酸根阴离子的物质一定是盐
C.碱溶液中一定存在金属阳离子和OH-
D.盐溶液中一定存在金属阳离子和酸根离子
10.下列关于质量守恒定律的说法错误的是()
A.木炭在空气中燃烧成灰,质量减少,符合质量守恒定律
B.根据质量守恒定律,4g碳和16g氧气生成20g二氧化碳
C.根据质量守恒定律,镁条在空气中燃烧生成的氧化镁的质量一定大于镁条的质量
D.化学反应的实质是原子的重新组合,不存在原子的得失,因此化学反应前后质量守恒
11.美国发明了月球制氧机,它利用聚焦太阳光产生的高温使月球土壤发生化学反应放出氧气。
由此可推测月球土壤中一定含有()
A.氧元素
B.氧分子
C.水分子
D.氯酸钾
12.使农业生产得到飞速发展是人类掌握了下列技术中的
A.铁器
B.火的使用
C.铜器
D.新型材料
13.实验室的废液不应该采取下列哪种方式处理()
A.排入下水道
B.回收一部分用于要求较低的实验中
C.少量残液置于安全的地点处理后排放
D.将废液分类集中于废液瓶中
14.下列各组物质的名称、俗称、化学式均表示同一种物质的是()
A.硫酸铜晶体,胆矾,CuSO4·
5H2O
B.氯化钠,苏打,NaCl
C.氢氧化钠,纯碱,NaOH
D.碳酸钙,生石灰,Ca(OH)2
15.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质
乙
丙
丁
反应前的质量/g
30
55
20
70
反应后的质量/g
100
X
5
根据质量守恒定律判断,X的值为()
A.50
B.70
C.40
D.15
二、填空题
16.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。
某化学兴趣小组的同学们为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。
每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g)
充分反应后剩余固体的质量(g)
第1次
40
m
第2次
14.8
第3次
12.2
第4次
11.2
第5次
试回答下列问题:
(1)从以上数据可知,最后剩余的11.2g固体的成分是________;
表格中,m=________。
(2)黄铜样品中锌的质量分数为________。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
_______
(4)配制100g该浓度的稀硫酸需要质量分数为98%浓硫酸的质量是多少?
_____
17.一些物质溶解于水或受热熔化而形成自由移动的离子的过程,叫做电离。
如盐酸在水中电离会产生自由移动的_______离子和______离子。
在电离时生成的阳离子都是_______离子的化合物,叫做酸。
常见的酸有:
_________________。
在电离时生成的阴离子____都是_______离子的化合物,叫做碱。
常见的碱有:
_________。
18.硫酸和盐酸是实验室常用的试剂,也是重要的化工原料.
(1)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是盛有________的试剂瓶;
(2)下列是探究酸性质的实验
在盛有少量氧化铜粉末的试管中加入足量稀盐酸,观察到的实验现象是________,反应的化学方程式为________。
19.小童将观察到的现象形象地画了一幅卡通画,每个卡通人物表示一种金属,周围的小黑点表示反应中生成的气体,如图所示:
(1)四种金属的活动性最弱的金属是
。
(2)小童要用其它方法验证铜、铁、镁的活动性顺序,他已经选择了打磨过的铁丝、氯化镁溶液,你认为他还需要选的另外一种溶液是
溶液。
20.用如图所示装置的序号回答下列问题(装置可以重复使用,尾气处理装置未画)
(1)实验室用氯酸钾与二氧化锰混合加热制取氧气的反应装置是
.过氧化氢与二氧化锰混合时发生的如下反应:
2H2O2═2H2O+O2↑.利用此反应制取氧气的反应装置应选
和
.
(2)检验CO中混有的CO2的装置是
装置.除去CO中较多的CO2,最好选用
装置.
(3)水煤气含有CO、H2、CO2、H2O.证明水煤气中含有CO、H2的实验装置连接顺序是
21.
(1)如图,表示测定金属丝直径的办法,根据图示情况,回答细金属丝的直径是________;
(2)如图甲温度计的读数为________;
乙温度计的读数为________;
(3)如图是检查装置气密性的图示,图中①②的名称。
①________;
②________。
置气密性良好的现象是:
________。
22.同学们,你们答题用的黑色碳素笔,用完之后,放在哪一类垃圾里呢?
答案是其他垃圾。
我们考试、填写资料时,常用碳素笔(含炭黑),原因是在常温下炭的化学性质稳定。
炭还具有还原性,可以冶炼金属。
冶炼金属一般有下列四种方法:
①焦炭法;
②水煤气(或H2,或CO)法;
③活泼金属置换法;
④电解法。
四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为____。
(填序号)
A.O2、CO2
B.O2、CO
C.CO2、CO
D.CO、CO2
(2)钛(Ti)有“未来钢铁”之称,工业上常用活泼金属Mg去置换TiCl4,获得海绵状钛,请写出化学方程式______________________________________。
(3)由于钠的活泼性强,故工业上采用电解熔融氯化钠的方法生产单质钠,化学方程式为:
2NaCl(熔融)
2Na+Cl2↑。
(4)归纳和演绎是重要的科学方法。
下列关于金属冶炼的归纳或演绎合理的是(________)
A、由于铝的活泼性强,故工业上不采用活泼金属置换法生产单质铝
B、将钠投入氯化镁饱和溶液中,可置换出镁单质
C、冶炼金属的方法,本质上是由金属的活泼性决定的
D、金属冶炼的实质是将金属元素从其化合物中氧化出来
(5)工业制氯气是用电解饱和食盐水的方法,用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质,在除杂操作时,往粗盐水中先加入过量的____ (填化学式),至沉淀不再产生后,再加入过量的____(填化学式)和NaOH,充分反应后将沉淀一并滤去,再加入稀盐酸调节食盐水的pH。
23.以下内容请你用最合适的化学符号填空:
地壳中含量最多的金属元素_____;
3个碳酸根离子_____;
能保持二氧化氮化学性质的微粒_____;
调味品食盐的阴离子_____;
相对分子质量最小的氧化物_____;
温度计中填充的液态金属_____;
+4价的硫元素_____
;
6个臭氧分子_____
24.某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签(如表所示).他从瓶中倒出200毫升用于配制成稀硫酸,问:
浓硫酸(H2SO4)
500毫升
浓度(质量分数)
98%
密度
1.84克/厘米3
相对分子质量
98
强腐蚀性,阴冷,密封贮藏
(1)这200毫升浓硫酸的质量为_____克,其中含溶质_____克。
(2)欲配制500克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升?
25.将一块生铁投入足量的稀硫酸中放置足够长的时间,能观察到的现象是
,若最后观察到还有少量固体存在,你觉得该固体最有可能的物质是
26.化学家TimRichard将分子结构简式像小狗的某有机物(如图所示),取名为“小狗烯”(化学式为C26H26)。
请计算:
(1)“小狗烯”中碳原子和氢原子的原子个数比
(填最简整数比)。
(2)“小狗烯”中碳元素和氢元素的质量比
27.某工厂排出的废液中主要含有Zn(NO3)2和AgNO3,为了回收金属银和硝酸锌,某学生设计了以下实验步骤:
(1)试推断:
X、Y分别代表的物质是______________、_____________
(2)滤液B、C的主要成分分别是_____________、_____________(以上均填化学式)
(3)溶液C加入适量的Ba(NO3)2溶液,发生的化学方程式为_____________________
28.某同学用一定质量分数的Na2CO3溶液和一定质量的氯化钙粉末做实验。
五次实验结果如下表所示:
实验次数
氯化钙质量/g
碳酸钠溶液的质量/g
碳酸钙的质量/g
1
5.55
200
2
11.1
10
3
22.2
4
33.3
250
25
55.5
400
a
根据实验结果回答下列问题:
(1)实验过程中,最明显的反应现象是________;
(2)表中的a值是________;
(3)实验中所用碳酸钠溶液中溶质的质量分数是多少?
(写出计算过程)________
29.用数字和化学符号表示:
(1)两个氢原子_________________;
(2)铁这种物质_________________。
三、探究题
30.罗根和王明不小心将纯碱洒到白醋(其有效成分为醋酸,可用HAc表示)里,发现有大量气泡产生,这使他们对醋酸产生了新认识:
醋酸像盐酸一样,能与纯碱反应;
此外,他们通过查阅相关资料,还检索到以下信息:
①醋酸与盐酸都具有较强挥发性;
②醋酸是一种有机酸,具有酸的通性,且其钠盐(NaAc)受热不易分解;
③盐酸与纯碱的反应分以下两步进行:
I.Na2CO3+HCl═NaHCO3+NaCl;
Ⅱ.NaHCO3+HCl═NaCl+H2O+CO2↑
试根据以上信息回答下列问题:
(1)醋酸可以跟酸碱指示剂反应。
(2)根据信息①可知醋酸应置于阴凉处密封保存;
(3)试写出醋酸与纯碱第一步反应的化学方程式:
_______
____________;
(4)他们向纯碱溶液中滴加醋酸到不再产生气泡后,将所得溶液蒸发结晶,获得了少量白色固体.王明认为这就是纯净的NaAc,而罗根则认为里面含有HAc.你认为_
_的观点正确,理由是:
_______________
_______________________
31.某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究。
(猜想假设)
猜想
(1)该溶液没有变质,为NaOH溶液。
猜想
(2)该溶液全部变质,为Na2CO3溶液。
猜想(3)该溶液部分变质,为NaOH和Na2CO3的混合溶液。
(查阅资料)Na2CO3溶液呈碱性
(设计方案)请你完善如表几组同学探讨的设计方案
实验操作
可能出现的现象与结论
同学评价
第1组
若溶液变红,则猜想
(2)不成立
第2组同学认为:
此方案结论不正确,理由是:
_____。
第2组
若出现_______现象,则猜想
(1)不成立。
第3组同学认为:
此方案还不能确定猜想
(2)还是猜想(3)成立。
第3组
若滤液不变红,则猜想
(2)成立;
若滤液变红,则猜想(3)成立。
第1组同学认为:
不需过滤也能达到实验目的,更简单的操作方法是:
(探究实验)综合各小组的方案后,动手实验。
(结论与反思)NaOH溶液易与空气中CO2反应而变质,所以要密封保存。
四、简答题
32.某纯碱中含有少量氯化钠杂质,为检验其纯度,小周取出27g纯碱样品,平均分成五份,依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应、待气体充分溢出后,用天平称质量(如图),得到如下表数据。
第一次
第二次
第三次
第四次
第五次
加入纯碱样品的质量/g
5.4
电子天平的示数/g
163.2
166.4
169.6
173.9
179.3
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是________g。
(2)计算纯碱样品中碳酸钠的质量分数是多少?
(精确到0.1%)_______
(3)关于所用稀盐酸的质量分数,三位同学做法各不相同(如图)。
判断谁的做法正确,并分析另两位同学的错误之处。
芳芳的解法:
明明的解法:
秀秀的解法:
_______.
33.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量,进行了如下实验:
取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的
反应过程中所得溶液的
与锥形瓶中物质的总质量的关系如图二所示。
其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。
(忽略二氧化碳在水中溶解的量;
氯化钙溶液显中性。
)
(1)b点的溶质是_______。
(2)a→b段
值升高的原因是________。
(3)求碳酸钠溶液溶质质量分数。
(4)原混合溶液中
的质量。
参考答案
1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
12、
13、
14、
15、