高三年级化学一轮复习同步训练第六章第一节化学反应与能量的变化docWord下载.docx
《高三年级化学一轮复习同步训练第六章第一节化学反应与能量的变化docWord下载.docx》由会员分享,可在线阅读,更多相关《高三年级化学一轮复习同步训练第六章第一节化学反应与能量的变化docWord下载.docx(9页珍藏版)》请在冰豆网上搜索。
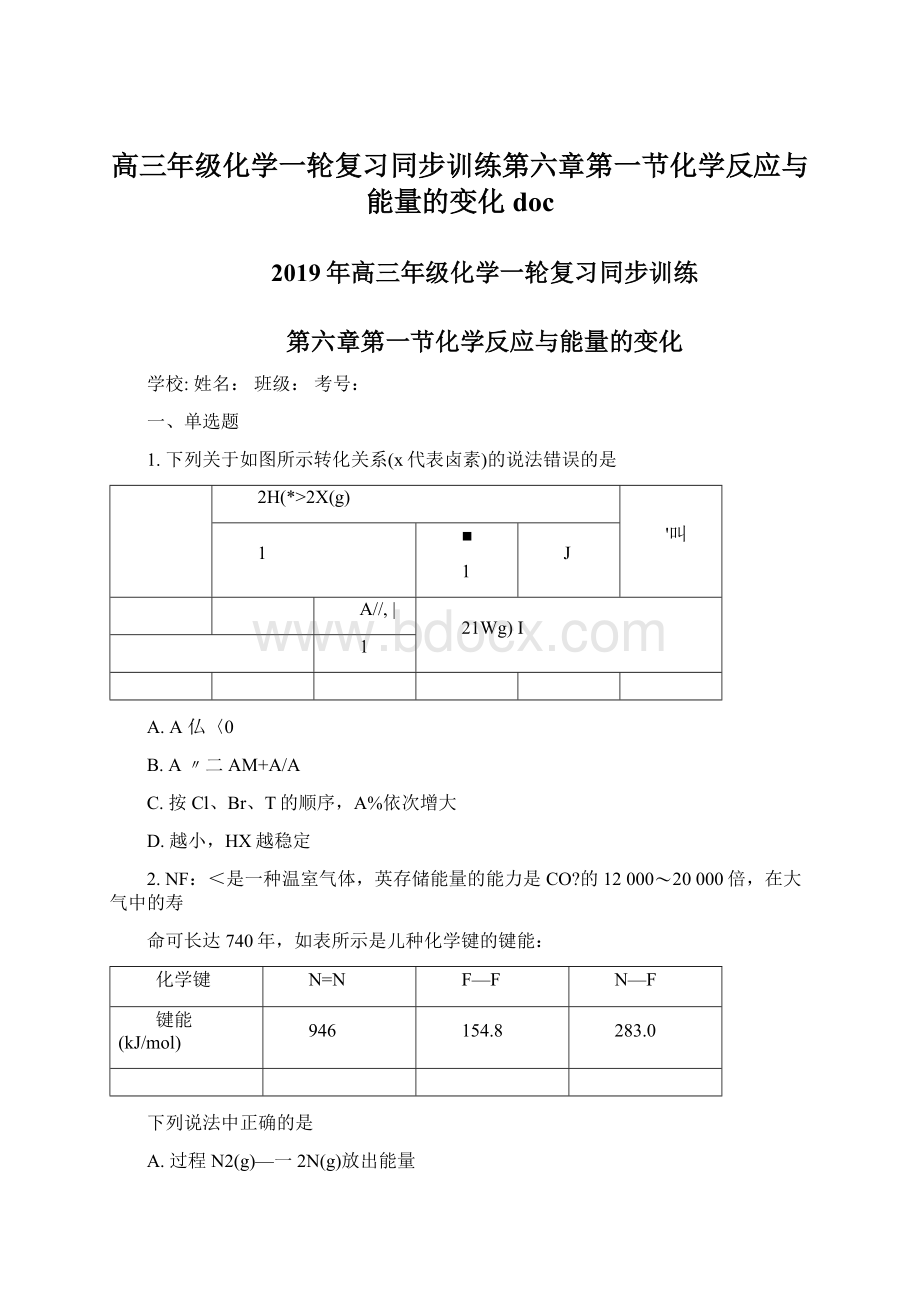
化学键
N=N
F—F
N—F
键能(kJ/mol)
946
154.8
283.0
下列说法中正确的是
A.过程N2(g)—一2N(g)放出能量
B.过程N(g)+3F(g)—-MF,g)放出能量
C.反应N2(g)+3F2(g)==2NFj(g)为吸热反应
D.NE吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
3.下图是金属镁和卤素单质(XJ反应的能量变化示意图。
下列说法正确的是
A.金属镁和卤素单质(XJ的反应能自发进行是因为△H均小于零
B.热稳定性:
Mgl2>
MgBr2>
MgCl2>
MgF2
C.工业上可由电解MgCL溶液冶炼金属Mg,该过程需吸收热量
D.由图可知此温度下MgBr2(s)与C12(g)反应的热化学方程式为:
MgBt2(s)+C12(g)—
MgCl2(s)+Br2(g)AH=+117kJ・mol
4.已知:
①2H2S(g)+S02(g)=3S(s)+2H20
(1)AHl一154kJ・moL
2
△也二-297kJ・moL
AH.,
S(s)+02(g)S02(g)
32H2S(g)+02(g)=2S(s)+2H2O
(1)
42H$(g)+302(g)^=2S02(g)+2比0⑴
A.AH3=143kJ•mol"
B.AH3>
AH<
C.S(g)+0?
(g)(g)AH>
AH2
D.常温下还原性:
H2S<
S<
SO2
5.已知:
2C0(g)+02(g)二2C02(g)AH=-566kJ/mol
Na2()2(s)+CO2(g)==Na2C03(s)+I/2O2(g)AH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283kJ
B.上图可表示由CO生成CO?
的反应过程和能量关系
C.2Na2()2(s)+2CO2(g)==2Na2C03(s)+O2(g)AH<
-452kJ/mol
D.CO(g)与Na202(s)反应放出509kJ热量时,电子转移数约为2X6.02X1023
6.已知:
2@)+3出@)=^2N&
(g)AH二-92.4kJ/mol起始反应物为N?
和比物质的量之比为1:
3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中W的物质的量分数如下表:
温度
物质的量分数
压强
400°
C
450°
500°
600°
20MPa
0.387
0.274
0.189
0.088
30MPa
0.478
0.359
0.260
0.129
A.体系中NH:
用勺物质的量分数越大,则正反应速率越大
B.反应达到平衡时,*2和H2的转化率之比均为1
C.反应达到平衡时,放出的热量均为92.4kj
D.600°
C,30MPa下反应达到平衡时,生成NHs的物质的量最多
7.己知:
CH3C00H(aq)+NaOH(aq)=CHsCOONa(aq)+H20(l)AH=flkj/mol
£
£
2H2SO4(浓)+2NaOH(aq)=Na2S04(aq)+H2O
(1)AH=fikj/mol
HN:
O3(aq)+KOH(aq)=KNO3(aq)+H20(l)AH=ftkJ/mol
上述反应均为溶液中的反应,则©
、Q?
、Qs的绝对值大小的关系为(〉
A.Q\—Qz=QaB.@>
0]>
@C.Q@>
0iD.@=@>
Q\
8.
2(g)与也(g)在铁催化剂表面经历如图所示过稈生成NH3,下列说法正确的是
ImolNH,
A.I中破坏的均为极性键
B.II、III、IV均为放热过程
C.IV屮NH2与比生成NH3
D.N2(g)+3H2(g)=2Nlh(g)AH>
9.利用含碳化合物合成新燃料是发展低碳经济的重要方法,己知:
C0(g)+2出@)“
CHsOH(g)是合成甲醇(CFLOH)的反应,该反应过程的能量变亿如图所示,下列判断正确的是()
A.CO(g)与H2(g)反应生成lmolCH3OH(g)释放出91kJ的能量
B.用碳制备原料气CO、仏的反应属于放热反应
C.反应物总键能高于生成物的总键能
D.若该反应生成液态CH:
QH,则放出的能量更少
10.
在好氧菌和厌氧菌作用下废液屮NH.「能转化为N2(g)和H20(l),示意图如下:
反应I
反应II
反应I:
NHi*(aq)+202(g)=N03(aq)+2H(aq)+H20(l)\H、=akJ•mol-1
反应II:
5NH,(aq)+3N0「(aq)=4N2@)+9H20⑴+2H+(aq)、fh=bkJ•mol'
A.两池发生的反应中氮元素只被氧化
B.两池中投放的废液体积相等时NH「能完全转化为2
C.常温常压下,反应II中生成22.4LN转移的电子数为3.75X6.02X1023
D.4NH,(aq)+302(g)二2N2(g)+4H(aq)+6H2O(l)人〃=扌(3占+方)kJ・mol'
二、填空题
11・碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
则M、7相比,较稳定的是o
(2)根据下列热化学方程式分析,C(s)的燃烧热AH等于(用△山、
△H?
、△FL表75)
C(s)+比0
(1)=C0(g)+出(g);
AHi
2C0(g)+O2(g)=2C()2(g);
AH2
2出(g)+O2(g)二2IL0
(1);
AHs
⑶根据键能数据估算CH,g)+4F2(g)===CF4(g)+4HF(g)的反应热AH=
C—H
C—F
H—F
键能/(kJ•mol-1)
414
489
565
155
(4)使Ch和H20(g)通过灼热的炭层,生成HC1和C02,当有1molCI2参与反应时释放
出145kJ热量,写岀该反应的热化学方程式:
。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下锻烧,所得物质可作耐高温材料,
4Al(s)+3TiO2(s)+3C(s)=2Al203(s)+3TiC(s)A/A-1176kJ-mol-1,则反应过程中,
每转移1mol电子放出的热量为。
三、综合题
12.二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。
利用合成气(CO、CO2、lb)在催化剂作用下合成甲醇,已知
反应相关的化学键键能数据如下:
H-H
c-o
0=0
H-0
C-H
E/(KJ/mol)
436
343
803
465
413
写出C02和山在催化剂作用下生成CHQI(g)和【【20(g)的热化学方程式
⑵CH,超干重整C0,的催化转化原理示意图如图所示:
1过程I,生成lmolH2时吸收123.5kJ热量,其热化学方程式是
2过程II,实现了含然物种与含碳物种的分离,生成氏0(g)的化学方程式是
13.研究NO-SO”CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:
®
C0(g)+NO2(g)=N0(g)+CO2(g)AH=-aKJ•mol1(a>
0)
②2C0(g)+2N0(g)=N2(g)+2C02(g)AH=-bKJ・mol-1(b>
若用标准状况下3.36LN0:
氧化CO至CO,(NO,完全反应)的整个过程中转移电子的物质的量为mol,放出的热量为kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
1CHsCOOH⑴+202(g)二2CO2(g)+2H20(l)AH=-870.3kJ/mol
2C(s)+02(g)=C02(g)AII=-393.5kJ/mol
32C(s)+2H2(g)+02(g)=CH3C00H(l)AH=-488.3kJ/mol
请写出比燃烧热的热化学方程式O
⑶在101kPa下,CH,g)、H2(g)>
C(s)的燃烧热分别为890.3kJ/moh285.8kJ/mol和
393.5kJ/mol,贝I」CHi(g)分解为&
(g)、C(s)的热化学方程式
14.错基催化剂催化CO加氢合成甲醇(CH,OH)、乙醛(CIhCHO).乙醇等碳的含氧化合物是近年来化学界比较活跃的研究课题之一。
(1)已知:
(i)CO(g)+2比(g)CH:
QH(g)AHf-90.lkj/mol
(ii)2CH3OH(g)=CH3OCH3(g)+H2O(g)二-24.5kJ/mol
(iii)C2H5OH(g)=CH30CH3(g)AH3=+50.7kJ/mol
则由CO催化加氢制备乙醇气体(另一产物为水蒸汽)的热化学反应方程式为o
(2)直接甲醇燃料电池(DMFC)成本低、效率高,某研究所尝试用DMFC电解处理含鼠电镀废水。
调节废水pH10~12.5,电解过程中,CN-先被氧化成CNCT俩种离子中氮元素均为-3价),再进一步氧化为碳酸盐和N2o
1请写出CNO一被氧化的电极反应式o
2欲处理ln?
CN-含量为390mg/L的电镀废水,至少需准备kg甲醇。
(3)在2.0L密闭容器中放入1molCO与2叱1出,在反应温度A时进行如下反应:
CO@)+2H2(g)=CH:
QH(g),反应时间(t)与容器内气体总物质的量(n)的数据见下表:
时间t/min
2
3
4
5
6
总物质的量n/mol
3.0
2.7
2.5
2.3
2.1
2.0
1在0〜5min时段,反应速率v(CH:
QH)为;
有利于提高上述反应平衡转化率的
条件是o
A.咼温咼压B.低温低压C.咼温低压D.低温咼压
2计算温度Ti时反应的平衡常数K|;
T|时达平衡后,改变反应温度为T2,平衡
常数增大,则T2彷(填“大于”“小于”),判断理由是°
参考答案
1.C
2.B
3.A
4.B
5.D
6.B
7.C
8.B
9.A
D
===4HC1(g)+CO2(g)△洋一290kJ・mol-198kJ
H=-63kJ/molCHi(g)+C02(g)
△
2CO(g)+2H2(g)AH=+247.OkJ/mol
4H24-Fe3O4=3Fe+4H2O
13.0.6-3/40(2a+b)H2(g)+1/20?
(g)二IbO
(1)△II=-285.8kJ・mo「
CH.i(g)=C(s)+2H2(g)△H=+74.8kJ*mol_1
14.2C0(g)+4H2(g)C2H5OH(g)+H2O(g)△H二-255.4kJ/mol
2CN0_+80H-6e=2C032_+N2t+4氏00.40.05mol・L_1・min-1D1(L/mol)2小于平衡常数增大,说明反应向正方向进行,反应正方向放热,故温度降低