备战高考化学与氮及其化合物有关的压轴题附答案解析Word下载.docx
《备战高考化学与氮及其化合物有关的压轴题附答案解析Word下载.docx》由会员分享,可在线阅读,更多相关《备战高考化学与氮及其化合物有关的压轴题附答案解析Word下载.docx(20页珍藏版)》请在冰豆网上搜索。
4NO+6H2O。
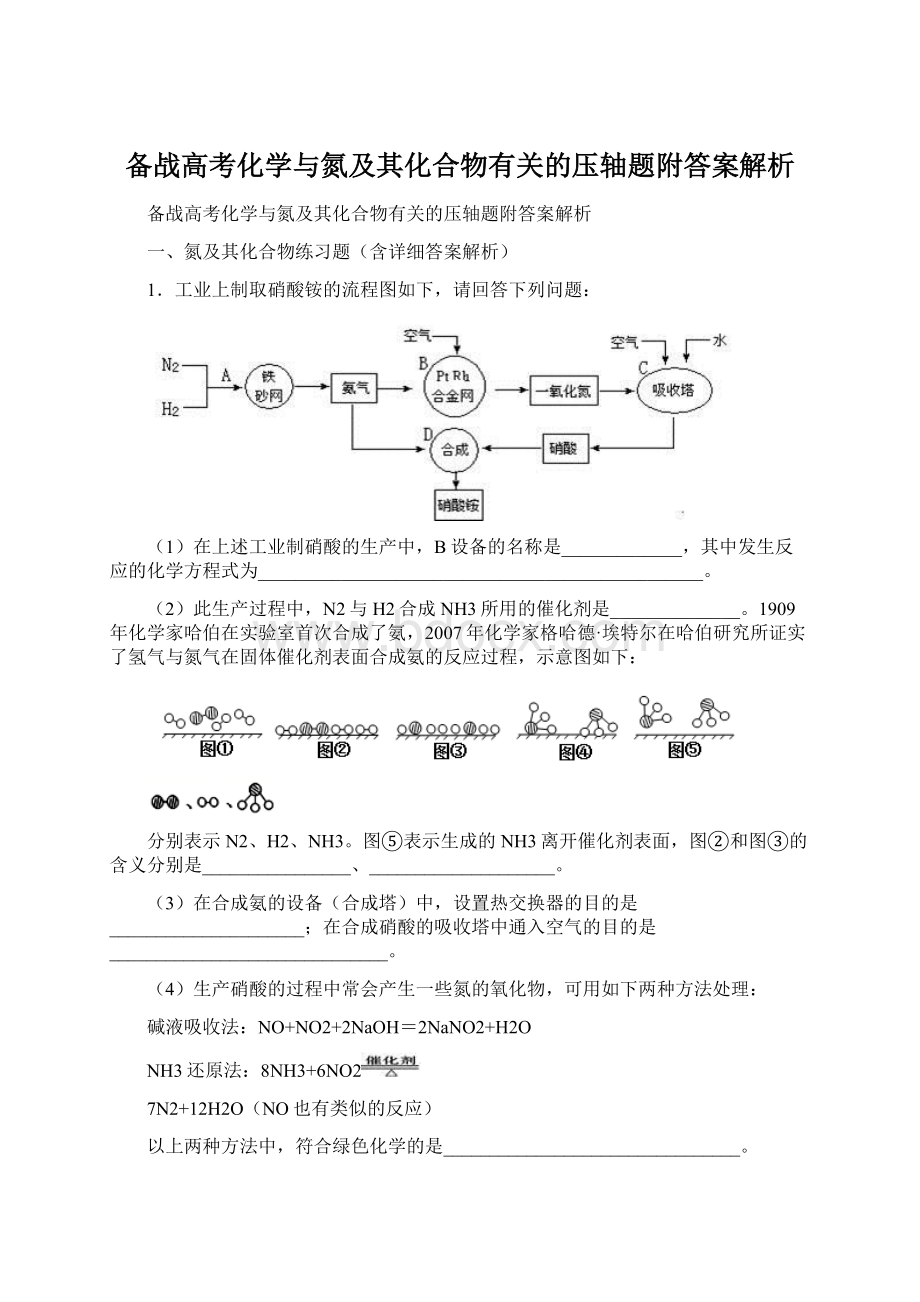
(2)分析工艺流程知此生产过程中,N2与H2合成NH3所用的催化剂是铁砂网(或铁);
分析图示知图②和图③的含义分别是N2、H2被吸附在催化剂表面、N2、H2中化学键断裂。
(3)合成氨的反应为放热反应,在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源;
在合成硝酸的吸收塔中通入空气的目的是可使NO循环利用,全部转化成HNO3。
(4)碱液吸收法中,只有当NO和NO2的物质的量之比小于等于1:
1时尾气才能吸收完全,且生成物亚硝酸钠有毒,而NH3还原法生成物为氮气和水,对环境无影响,故两种方法中,符合绿色化学的是NH3还原法。
(5)设生产硝酸的NH3的物质的量为1mol,根据关系式:
NH3~HNO3和题给信息计算生成HNO3的物质的量为:
1mol×
96%×
92%=0.88mol;
根据反应:
NH3+HNO3=NH4NO3知与硝酸反应的NH3的物质的量为0.88mol,故制HNO3用去NH3的质量占总消耗NH3的质量分数为:
×
100%=53%。
2.下列A~H八种物质存在如下图所示的转化关系(反应条件、部分产物未标出)。
已知A是正盐,B能使品红溶液褪色,G是红棕色气体。
试回答下列问题:
(1)写出下列各物质的化学式:
A________________;
B________________。
(2)按要求写出下列反应的有关方程式
E→F反应的化学方程式_____________________________________________________;
G→H反应的离子方程式_____________________________________________________。
(3)写出H的浓溶液与木炭反应的化学方程式_______________________________________。
(4)检验D中阴离子的方法是___________________________________________________。
【答案】
(NH4)2SO3SO24NH3+5O2
4NO+6H2O3NO2+H2O=2H++2NO3-+NOC+4HNO(浓)
4NO2↑+CO2↑+2H2O取少量该溶液于试管中,加足量稀盐酸酸化,未见沉淀生成.再加入少量BaCl2溶液,如果出现白色沉淀,则证明该溶液中含有SO42-
【分析】
G是红棕色气体,则是NO2,F和氧气反应生成二氧化氮,所以F是NO;
A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;
二氧化氮和某种物质反应后能生成NO和H,则是和水反应生成硝酸和NO,所以H是硝酸;
B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3,三氧化硫和水反应生成硫酸,则D是硫酸,据此分析解答。
(1)通过以上分析知,A是(NH4)2SO3;
B是SO2;
(2)高温、催化剂条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:
4NH3+5O2
4NO+6H2O,二氧化氮和水反应生成硝酸和一氧化氮,离子方程式为:
3NO2+H2O=2H++2NO3-+NO;
(3)加热条件下,碳和浓硝酸反应生成二氧化氮、二氧化碳和水,反应方程式为:
C+4HNO3(浓)
4NO2↑+CO2↑+2H2O;
(4)D中含有硫酸根离子,硫酸根离子的检验方法是:
取少量该溶液于试管中,加足量稀盐酸酸化,未见沉淀生成,再加入少量BaCl2溶液,如果出现白色沉淀,则证明该溶液中含有SO42-。
3.下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;
E、H、I为氧化物,E为黑色固体,I为红棕色气体;
M为红褐色沉淀。
请回答下列问题:
(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
(4)Y受热分解的化学方程式是______________________________________。
(5)检验硫酸铁溶液中是否存在Fe2+的试剂是____________________。
【答案】放出大量的热,产生苍白色火焰2:
13AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓4Fe(NO3)3
2Fe2O3+12NO2↑+3O2↑酸性高锰酸钾溶液
F是地壳中含量最多的金属元素的单质,则F为Al,转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2,B为Cl2,E为MnO2,电解X是电解氯化钠溶液,C为NaOH,与Al反应生成G,G为NaAlO2;
M为红褐色沉淀为Fe(OH)3,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,H、I为氧化物判断H为Fe2O3,I为红棕色气体为NO2,结合转化关系可知,N为HNO3,Y为Fe(NO3)3,结合物质的性质来解答。
(1)A为H2,B为Cl2,H2在Cl2中燃烧的现象是:
气体安静燃烧,放出大量的热,火焰呈苍白色,并有白雾产生;
(2)D+E→B的反应为MnO2+4HCl
MnCl2+Cl2↑+2H2O,MnO2中Mn元素化合价降低,被还原,HCl中Cl元素化合价升高,被氧化,4mol盐酸参与反应,发生氧化反应的盐酸为2mol,另外2mol盐酸显酸性,则n(被氧化的物质HCl):
n(被还原的物质MnO2)=2:
1;
(3)G(NaAlO2)+J(FeCl3)→M(Fe(OH)3)的反应是在水溶液中发生的双水解反应,反应离子方程式是:
3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓;
(4)依据分析推断可知Y为Fe(NO3)3,受热分解生成二氧化氮和氧化铁,依据原子守恒配平书写的化学方程式是:
4Fe(NO3)3
2Fe2O3+12NO2↑+3O2↑;
(5)检验硫酸铁溶液中是否存在Fe2+的方法是取少量待测液于试管中,滴加几滴酸性高锰酸钾溶液,若溶液紫色褪去,证明原溶液中含有Fe2+,反之没有Fe2+。
4.有一无色透明溶液,欲确定是否含有下列离子:
Na+、Mg2+、Al3+、Fe2+、Ba2+、NO
、SO
、Cl-、SO32-、HCO
,取该溶液进行以下实验:
①取少量待测液,加入几滴石蕊试液,溶液呈红色。
②取少量待测液,浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色。
③取少量待测液,加入BaCl2溶液,有白色沉淀产生。
④取实验③中上层清液滴加AgNO3溶液,有白色沉淀产生,此沉淀不溶于稀硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀产生,当NaOH过量时,沉淀部分溶解。
(1)根据以上实验,溶液中肯定存在的离子是_________________;
肯定不存在的离子是______________;
尚不能确定的离子是_______________。
(2)写出②中有关反应的离子方程式:
________________________________________。
(3)写出⑤中沉淀溶解的离子方程式:
(4)实验室检验Na+一般用焰色反应即可确定,此实验做之前要用______清洗铂丝。
【答案】Mg2+、Al3+、
、
Fe2+、Ba2+、SO32-、
Na+、Cl-3Cu+8H++2
===3Cu2++2NO↑+4H2OAl(OH)3+OH-===
+2H2O稀盐酸
无色溶液中,有色离子不能存在,氢氧化铝是两性氢氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或硫酸钡,在酸性环境下,能和氢离子反应的离子不能共存,根据离子反应的现象以及离子共存的知识加以分析。
因是无色溶液,Fe2+是浅绿色,所以不含Fe2+;
①由于滴加几滴石蕊试液,溶液呈红色,证明溶液显酸性,因此溶液中一定没有SO32-、HCO3-;
②待测液浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色,说明原溶液中一定含有NO3-;
③取少量待测液,加入BaCl2溶液,有白色沉淀产生,则原溶液中一定含有SO42-,故一定没有Ba2+;
④由于③的上层清液滴中加AgNO3溶液,有白色沉淀产生且不溶于稀硝酸,说明含有Cl-,但由于③中加入了BaCl2溶液,无法证明原溶液中是否存在Cl-;
⑤由于原溶液中加入NaOH溶液有白色沉淀产生,当NaOH过量时,沉淀部分溶解,则含有Al3+、Mg2+;
Na+在水溶液里无色,不会参与上述反应,所以无法判断原溶液中是否存在Na+;
(1)根据以上分析可知,溶液中一定存在的离子有Mg2+、Al3+、NO3-、SO42-;
肯定不存在的离子是Fe2+、Ba2+、SO32-、HCO3-;
尚不能确定的离子是Na+、Cl-;
答案为:
Mg2+、Al3+、NO3-、SO42-;
Fe2+、Ba2+、SO32-、HCO3-;
Na+、Cl-;
(2)②中原溶液加入铜片和浓硫酸并加热生成NO,离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(3)⑤中加NaOH溶液,生成的白色沉淀为Mg(OH)2和Al(OH)3,当NaOH过量时,部分溶解的是Al(OH)3,离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O;
Al(OH)3+OH-=AlO2-+2H2O。
(4)溶液里的钠离子是否存在一般用焰色反应来确定,钠离子的焰色反应为黄色,实验之前,为防止杂质的干扰,用稀盐酸先清洗铂丝;
稀盐酸。
5.如图,根据图示回答:
(1)A的分子式为_____;
B的分子式为_____;
C的分子式为_____。
(2)将E溶于水,配制成0.1mol·
L-1的溶液,滴入酚酞,显_____色。
(3)写出NH4Cl溶液与NaOH溶液共热反应的离子方程式:
__________________。
(4)D→B的化学方程式为:
_____。
(5)A→B的化学反应方程式:
【答案】NH3NONO2无NH4++OH−
NH3↑+H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O4NH3+5O2
4NO+6H2O
氯化铵受热分解生成氨气和氯化氢,A催化氧化生成一氧化氮和水,则A为NH3,E为HCl,B为NO,C为NO2,二氧化氮溶于水生成硝酸和一氧化氮,D为HNO3,硝酸和铜反应生成一氧化氮。
(1)结合分析可知A为NH3,B为NO,C为NO2,故答案为:
NH3;
NO;
NO2;
(2)E为HCl,溶于水溶液显酸性,配制成0.1mol/L的溶液,滴入酚酞不变色,故答案为:
无;
(3)氯化铵溶液和氢氧化钠溶液共热反应生成氨气、氯化钠和水,反应的离子方程式:
NH4++OH−
NH3↑+H2O,故答案为:
NH3↑+H2O;
(4)D→B是稀硝酸和铜反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(5)A→B是氨气和氧气在催化剂条件下反应生成一氧化氮和水,反应的化学方程式为:
4NO+6H2O,故答案为:
4NO+6H2O;
6.A、B、C、D是四种常见气体单质。
E的相对分子质量比F小16,且F为红棕色。
有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?
__,理由是__。
【答案】H2NH3NO2NH3+3CuO
N2+3Cu+3H2O6NO+4NH3
5N2+6H2O有二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3,据此解答。
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3;
(1)由上述分析可知,D的化学式为H2,Y的化学式为NH3,E的化学式为NO;
(2)NH3与氧化铜反应,每生成1mol
N2消耗3mol氧化铜,还原产物中Cu应是化合价为a,则:
3(2-a)=2×
3,解得a=0,故生成Cu,该反应的化学方程式为:
2NH3+3CuO
N2+3Cu+3H2O;
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为4NH3+6NO
5N2+6H2O;
(4)二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀,故气体NO2和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中,洗瓶中有沉淀生成。
7.某混合溶液中可能大量含有的离子如下表所示:
阳离子
H+、K+、Al3+、NH4+、Mg2+
阴离子
Cl-、OH-、CO32-、AlO2-
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
(1)该溶液中一定含有的阳离子是________________________________,其对应物质的量浓度之比为____________,溶液中一定不存在的阴离子是_______________________。
(2)写出沉淀减少的离子方程式________________________________________________。
【答案】H+、Al3+、NH4+、Mg2+2:
2:
3OH-、CO32-、AlO2-Al(OH)3+OH-=AlO2-+2H2O
(1)根据生成的沉淀总物质的量最大量为5mol、最终得到3mol可知,最终得到的沉淀为3mol氢氧化镁沉淀,溶解的2mol沉淀为氢氧化铝;
根据气体的物质的量最后有增加可知,增加的气体为氨气,溶液中一定存在铵离子;
根据开始加入过氧化钠时没有沉淀生成,说明原溶液中存在氢离子,根据题中数据计算出氢离子的物质的量;
(2)沉淀中氢氧化铝沉淀能够与氢氧化钠溶液反应而导致沉淀减少,据此写出反应的离子方程式。
(1)根据图象中沉淀先增加后部分溶解可知:
溶液中一定含有:
Mg2+和Al3+,所以一定不含CO32-、AlO2-,并且含有镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol,根据元素守恒,所以含有铝离子的物质的量2mol;
加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以一定不含有氢氧根离子;
图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,由于加入8mol过氧化钠时生成的沉淀达到最大量5mol,8mol过氧化钠会生成16mol氢氧化钠,而生成2mol氢氧化铝、3mol氢氧化镁、2mol氨气消耗的氢氧化钠为:
2mol×
3+3mol×
2+2mol=14mol,所以有2mol氢氧化钠与氢离子反应,氢离子的物质的量为2mol;
并且物质的量为2mol,溶液中一定还含有阴离子,可能为氯离子,钾离子不能确定是否存在,根据电荷守恒:
n(H+)+3n(Al3+)+n(NH4+)+2n(Mg2+)≤16mol,所以氯离子物质的量≥16mol,所以溶液中一定存在的阳离子为:
H+、Al3+、NH4+、Mg2+;
含有的阳离子的物质的量之比为:
n(H+):
n(Al3+):
n(NH4+):
n(Mg2+)=2:
2:
3;
溶液中一定不存在的阴离子为:
OH-、CO32-、AlO2-;
(2)生成的沉淀为氢氧化镁和氢氧化铝,其中氢氧化铝能够与氢氧化钠溶液反应,反应的离子方程式为:
Al(OH)3+OH-═AlO2-+2H2O。
8.下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
(1)A的化学式是___,C的电子式是 __________ ,Y的名称是_____。
(2)反应①的化学方程式为 __________________________。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) _________________。
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与_______LO2(标准状况下)混合,恰好能被水完全吸收。
【答案】CuO
浓硫酸C+4HNO3(浓)=CO2↑+4NO2↑+2H2O2NO2⇌N2O43.36L
已知,A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,可推测A为CuO,B为C,C为二氧化碳,D为Cu;
E是红棕色气体为二氧化氮,G是具有漂白性的气体为二氧化硫,H的水溶液呈蓝色为硫酸铜。
(1)分析可知,A为氧化铜,化学式是CuO;
C为二氧化碳,电子式为:
;
Y为浓硫酸;
(2)反应①为碳与浓硝酸反应生成二氧化碳、二氧化硫和水,方程式为:
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O;
(3)验室测定气体二氧化氮的相对分子质量时,存在可逆反应2NO2⇌N2O4得到的实验值总是比理论值偏大;
(4)19.2g的Cu即0.3mol,与足量的一定浓度的硝酸溶液反应,生成氮的氧化物,化合价降低与Cu升高的化合价总数相等,则消耗的氧气化合价降低的总数也相等,消耗0.15mol氧气即标况下的3.36L。
9.某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
(1)白色沉淀为______________________(填化学式,下同),产生的有刺激性气味的气体是_____________________。
(2)该白色固体粉末是___________________(填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:
_______________________________
【答案】CaCO3NH3NH4HCO3NH4HCO3
NH3↑+CO2↑+H2O
该白色固体加入CaCl2溶液,迅速溶解,溶液中无CO32-,加入澄清石灰水中有白色沉淀生成,说明白色固体中含有HCO3-,加热加入澄清石灰水后所得滤液,有刺激性气味的气体产生,且该气体能使湿润的红色石蕊试纸变蓝,说明白色固体粉末中有NH4+,故该白色固体是NH4HCO3。
(1)白色固体粉末加入CaCl2溶液,迅速溶解,溶液中无有CO32-,加入澄清石灰水中有白色沉淀生成,说明白色固体中含有HCO3-,白色沉淀为CaCO3,加热加入澄清石灰水后所得滤液,有刺激性气味的气体产生,且该气体能使湿润的红色石蕊试纸变蓝,故该气体是NH3;
(2)有白色固体中含有NH4+、HCO3-,故该白色固体粉末是NH4HCO3;
(3)该白色固体粉末受热分解即NH4HCO3受热分解,化学方程式为:
NH4HCO3
NH3↑+CO2↑+H2O
【点睛】
本题是物质中的成分鉴别,从特殊的性质去判断,考生应该熟练掌握常见的物质的性质,碳酸铵和碳酸氢铵性质不完全相同