专题复习10化学计算Word文档下载推荐.docx
《专题复习10化学计算Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《专题复习10化学计算Word文档下载推荐.docx(17页珍藏版)》请在冰豆网上搜索。
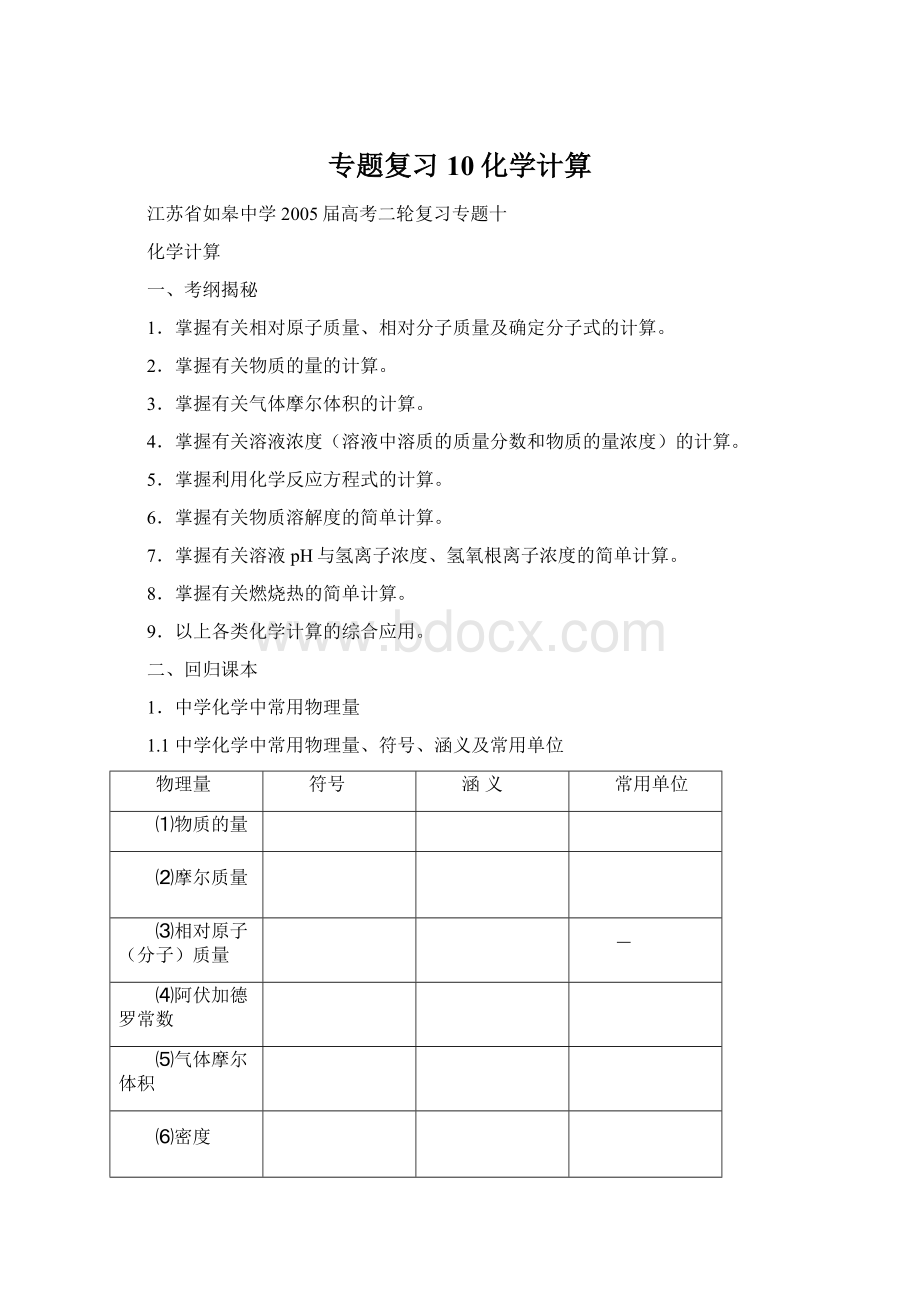
1.2.1摩尔质量的计算
⑴M=
=m(粒子)·
NA
⑵M以g/mol为单位时,数值等于相对原子(分子)质量。
设钠原子的质量为m(Na),12C原子的质量为m(12C),阿伏加德罗常数为NA,试证明钠的相对原子质量[Ar(Na)]在数值上等于以g/mol为单位的摩尔质量[M(Na)]。
证明过程:
_________________________________________________。
⑶平均摩尔质量:
=
,若已知由两种物种组成的混合物的平均摩尔质量,则两种组分的物质的量之比为
=_______________。
1.2.2密度ρ=_________=_________;
1.2.3溶液的物质的量浓度与溶质的质量分数间的关系:
c=______________。
2.气体摩尔体积
2.1影响物质体积大小的因素
⑴物质体积的大小取决于构成这种物质的_________、__________和___________三个因素。
⑵对固体、液体而言,由于____________很小,体积的大小主要取决于_____________和______________。
⑶对气体而言,由于_______________很大,体积的大小主要取决于____________和______________;
当气体的物质的量相同时,影响体积的主要因素是分子之间的距离,而分子之间的距离又取决于气体所处的温度和压强。
温度越高,气体体积________;
压强越大,气体体积________。
不同气体在一定的温度和压强下,分子之间的距离可以看作是________的,其体积的大小主要由____________决定。
2.2阿伏加德罗定律及其推论
2.2.1阿伏加德罗定律(形象地称为“四同定律”):
在相同的温度和压强下,相同体积的任何气体都含有_______________________。
2.2.2阿伏加德罗定律推论:
推论Ⅰ:
同温同压下:
=________。
推论Ⅱ:
推论Ⅲ:
同温同压同体积的气体:
=__________。
推论Ⅳ:
同温同压同质量的气体:
推论Ⅴ:
同温同体积时:
阿伏加德罗定律换一种表述方法,就是“在一定的温度和压强下,一定物质的量的气体具有一定的体积”,即在一定的温度和压强下,气体的物质的量和气体体积的比值是一定的(常数),这个常数就是“气体摩尔体积”,不同的温度、不同的压强下,这个常数的值不相同。
2.3气体摩尔体积的概念
________________________叫做气体摩尔体积,符号为_____,计算式为________为常用的单位有____________________,在标准状况下的量值为___________________。
2.4混合气体的平均摩尔质量
2.4.1若已知标准状况时的密度:
=______________________。
2.4.2若已知同温同压下与某一气体的相对密度:
=___________。
(相对密度符号为D,表示两种气体的密度之比,即D=
,对同温同压下的气体而言,D=
。
)
2.4.3若已知混合气体的总质量和总物质的量:
2.4.4若已知组成成分的摩尔质量和物质的量分数:
=_______________________。
3.有关溶液组成的计算
3.1有关溶液组成的表示方法
3.1.1常用表示方法
3.1.1.1溶质的质量分数(w):
溶质的质量占_____________的分数,计算式为:
w=________________=______________________=_______________________。
3.1.1.2物质的量浓度(cB):
以____________________________________来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
物质的量浓度的符号为____________,常用的单位是_________________,计算式为__________________________________。
⑴计算物质的量浓度时各物理量之间的换算关系如下:
⑵配制一定物质的量浓度的溶液,是中学阶段的一个很重要的也是我们遇到的第一个化学定量实验,高考常考。
在配制一定物质的量浓度的溶液时,凡引起___________
_____________的,所配溶液浓度偏大,凡引起__________________________的,所配溶液浓度偏小。
具体见第五章第二讲第4课时《化学定量实验与数据处理》。
3.1.1.3w和cB的换算:
cB=___________________________________。
3.1.2特殊的表示方法
溶液组成的表示方法是视需要而定的,不同情况下可以采用不同的表示方法。
3.1.2.1当溶液极稀时,可用ppm浓度来表示溶液的组成,即用溶质质量占全部溶液质量的百万分比(pointpermillion),例如5ppm表示某溶液中溶质质量占全部溶液质量的_______。
3.1.2.2当用两种液体配制溶液时,可用两种液体的体积比来表示溶液的组成,这叫做体积比浓度。
例如实验室常用到的1∶4的硫酸溶液,就是指1体积硫酸(一般是指质量分数为98%,密度为1.84g·
cm-3的硫酸)跟_____________配制成的溶液。
3.1.2.3当酸性溶液或碱性溶液的浓度很小时,可用pH来表示溶液中c(H+)的大小,pH=___________。
除了以上三种常见的特殊表示方法以外,还有其他的表示方法,我们在具体的习题里遇到再说(这些表示方法往往作为信息给出)。
3.2溶解度及其相关计算
3.2.1固体物质的溶解度(S):
在一定温度下,某固态物质在________g溶剂(一般是水)里达到__________状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度与饱和溶液中溶质、溶剂、溶液质量的关系为:
_______________或_______________。
3.2.1.1一般来讲,固体的溶解度随着温度的升高而_____________,但也有例外,比如___________。
3.2.1.2饱和溶液、不饱和溶液、浓溶液、稀溶液关系的关系是________________________________。
3.2.1.3关于溶解度的计算
关于溶解度的计算,一般有这样几种类型:
稀释、浓缩、混合、加入晶体(结晶水合物或不带结晶水的晶体)、降温结晶(析出结晶水合物或不带结晶水的晶体)等等。
计算时要紧抓一个“不变”来列等式求解,这个“不变”可以是溶质质量不变(稀释、浓缩或混合)、溶剂质量不变(溶解或析出不带结晶水的晶体),也可以是溶质和溶剂的质量比不变,或者根据“质量守恒”列式计算。
3.2.2气体的溶解度:
在一定的温度和压强下,1体积的溶剂(一般是水)最多所能溶解的气体的体积。
比如常温常压下,NH3、HCl、SO2的溶解度分别是_____、_____、_____。
3.3有关溶液稀释、浓缩或混合的计算
3.3.1有关溶液的体积问题
⑴相同的纯液体混合或相同浓度同溶质的溶液相混合时,体积_____(填“能”或“不能”)相加。
⑵同溶质不同浓度的溶液相混合时,体积_________(填“能”或“不能”)相加。
⑶浓溶液稀释时,浓溶液与水体积_________(填“能”或“不能”)相加。
⑷溶剂中通入气体溶质或加入固体后,溶液的体积__________溶剂的体积。
3.3.2关于溶液的稀释或浓缩
溶液在稀释或浓缩前后,_____________________不变,因而溶液稀释或浓缩时物质的量浓度的计算式为:
_______________,溶质质量分数的计算式为:
___________。
(不包括浓缩时由溶质气体挥发或有溶质析出的情况。
3.3.3关于溶质相同的溶液的混合
今有两种密度和溶质质量分数分别为ρ1、ρ2(g·
cm-3)和w1、w2的同质溶液,等体积相混合后所得溶液的溶质的质量分数为w,试通过计算填写下表:
序号
条件
用>、=、<比较
w与
的大小
结论
①
w1>0,w2=0
ρ1>1,ρ2=1
②
ρ1<1,ρ2=1
③
w1>w2ρ1>ρ2
④
w1>w2ρ1<ρ2
三、近五年典型考题示例
例1(2001·
全国)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。
试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以17.0计,水的密度以1.00g/cm3计)
解析本题考查了物质的量浓度的计算。
题中要求计算的实际上是氨气和水的体积比,给出的数据有物质的量浓度和密度,它们也都是比例式,因此只要假设某个物理量的数值为1,其他问题就迎刃而解了。
计算时可假设氨水的体积为1L,计算NH3与水的体积比,也可假设水的体积为1L计算NH3的体积、或假设NH3的体积为1L计算水的体积。
若假设氨水体积为1L,则:
=378
答案1体积水吸收378体积的氨气可制得上述氨水。
例2(2002·
全国)向300mLKOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。
请回答下列问题:
⑴由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
⑵若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。
请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?
所用的KOH溶液的物质的量浓度为多少?
解析这是一道由于反应物的用量不确定导致生成物(或反应剩余物)不确定的过量计算,计算涉及的技法有讨论法和极限假设法。
首先通过讨论确定白色固体的可能组成,然后假设是其中一种组成(一般假设是纯净物),算出极限值。
请通过下面的解题过程注意解计算题的规范
答案⑴①K2CO3+KOH②K2CO3③K2CO3+KHCO3④KHCO3
⑵由:
①CO2+2KOH=K2CO3+H2O②CO2+KOH=KHCO3
22.4L(标况)138g22.4L(标况)100g
2.24L(标况)13.8g2.24L(标况)10.0g
因为13.8g>11.9g>10.0g
所以得到的白色固体是K2CO3和KHCO3的混合物。
设白色固体中K2CO3xmol,KHCO3ymol,即
xmol2xmolxmolymolymolymol
xmol+ymol=2.24L/22.4mol•L-1=0.100mol(CO2)
138g•mol-1×
xmol+100g•mol-1×
ymol=11.9g(白色固体)
解此方程组,得
x=0.0500mol(K2CO3)
y=0.0500mol(KHCO3)
所以白色固体中,K2CO3质量为138g•mol-1×
0.0500mol=6.90g
KHCO3质量为100g•mol-1×
0.0500mol=5.00g
消耗KOH物质的量为
2xmol+ymol=2×
0.0500mol+0.0500mol=0.150mol
所用KOH溶液物质的量浓度为
0.150mol/0.300L=0.500mol•L-1
例3(2003·
江苏)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL1.00mol·
L-1过量盐酸反应,生成2.016LCO2(标准状况),然后加入500mL0.100mol·
L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL1.00moL·
L-1盐酸恰好完全中和。
计算混合物中各物质的质量。
解析本题共涉及4个反应:
Na2CO3+2HCl=2NaCl+CO2↑+H2O①
NaHCO3+HCl=2NaCl+CO2↑+H2O②
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH③
Ba(OH)2+2HCl=BaCl2+2H2O④
从生成CO2的角度看,反应①、②可看作平行反应;
从与HCl反应的角度看,反应①、②、③可看作平行反应;
从与Ba(OH)2反应的角度看,反应③、④可看作平行反应。
根据反应③生成BaSO4的质量,可求混合物中Na2SO4的质量。
根据两次加入盐酸的量、Ba(OH)2的量和反应④,可求反应①、②用去HCl的量,再根据反应①、②生成CO2的量,可求Na2CO3、NaHCO3的量。
答案混合物中Na2SO4的质量=
×
142g·
mol-1=1.42g
设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=
=0.0900mol与Na2CO3、NaHCO3反应的盐酸的物质的量为:
0.250L×
1.00mol·
L-1-0.500L×
0.100mol·
L-1×
2+0.0100L×
L-1=0.160mol
解得:
x=0.0700mol,y=0.0200mol
Na2CO3质量=0.0700mol×
106g·
mol-1=7.42g
NaHCO3质量=0.0200mol×
84g·
mol-1=1.68g
答:
混合物中Na2CO3、NaHCO3和Na2SO4的质量分别为7.42g、1.68g和1.42g。
例4(2004·
江苏)某结晶水合物含有两种阳离子和一种阴离子。
称取两份质量均为1.96g的该结晶水合物,分别制成溶液。
一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;
加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;
用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。
另一份加入含0.001molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
⑴该结晶水合物中含有的两种阳离子是_________和_________,阴离子是________。
⑵试通过计算确定该结晶水合物的化学式。
解析:
这是一道综合运用元素守恒、电荷守恒和电子守恒计算物质组成的高考题,堪称守恒法解决化学计算问题的经典。
解题时,首先根据题中信息定性判断出该结晶水合物中含有的离子,然后用元素守恒计算出1.96g化合物中SO42-的物质的量、用电子守恒算出Fe2+的物质的量、用电荷守恒算出NH4+的物质的量,最后再用质量守恒算出H2O的物质的量,进而得出该结晶水合物的化学式。
答案:
⑴NH4+Fe2+SO42-
⑵据题意:
n(SO42-)=n(BaSO4)=
=0.01mol
根据“电子守恒”:
n(Fe2+)×
1=n(MnO4-)×
5
则:
n(Fe2+)=0.001mol×
5=0.005mol
根据“电荷守恒”:
n(NH4+)+2n(Fe2+)=2n(SO42—)
算出:
n(NH4+)=0.01mol
n(H2O)=
=0.03mol
该结晶水合物的化学式为(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O]。
四、训练感悟
1.将1.0mLpH等于5的稀盐酸加水稀释到1000mL后,溶液的pH为
A.2B.5C.7D.8
2.在相同的温度和压强下,A容器中H2和B容器中的NH3所含原子数相等,则A、B两容器的容积比为
A.1∶2B.2∶1C.2∶3D.1∶1
3.下列说法中正确的是
A.水的摩尔质量与NA个水分子的质量在数值上相等
B.28g氮气所含的原子数目为NA
C.2.3g金属钠中含有0.1NA个电子
D.在标准状况下,0.5NA个水分子所占体积是11.2L
4.右图为装有活塞的密闭容器,内盛22.4mLNO,若通入11.2mLO2(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度
A.等于1.396g/LB.等于2.054g/L
C.在1.396g/L和2.054g/L之间D.大于2.054g/L
5.今有下列物质①10.0gNH3;
②标准状况下11.2LCH4;
③4℃时10mL的水;
④标准状况下22.4L氦气。
所含质子数由少到多的顺序是
A.②③①④B.②①④③C.④①③②D.②④③①
6.青霉素试验针用它的稀溶液(200国际单位青霉素/mL)。
现有一小瓶20万国际单位青霉素,1.0mL注射器(分刻度为0.1mL),注射用水和几个干净小瓶。
现吸取1.0mL注射用水,注入第一瓶内溶解青霉素。
吸取0.1mL溶液在第二小瓶中用水稀释成1.0mL,再吸取0.1mL在第三小瓶中稀释成1.0mL。
又……在第几小瓶中青霉素浓度为200国际单位青霉素/mL
A.3B.4C.5D.6
7.100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42—离子的物质的量浓度为
A.0.20mol/LB.0.25mol/LC.0.40mol/LD.0.50mol/L
8.要用vL水制得物质的量浓度为amol/L的氨水(密度为dg/cm3),需标准状况下氨气的体积为
A.
LB.22.4avLC.
LD.
L
9.工业上以废铜屑和硫酸为原料,通过最合理的方法制备胆矾晶体,为了确保制备过程中既不补充水,也无多余水分,所用硫酸溶液中n(H2SO4):
n(H2O)应为
A.1:
5B.1:
4C.2:
3D.2:
10.已知某饱和溶液的:
①溶液质量②溶剂质量③溶液体积④溶质摩尔质量⑤溶质的溶解度⑥溶液的密度,以上条件的组合中,不能用来计算饱和溶液的物质的量浓度的是
A.④⑤⑥B.①②③④C.①③④D.①③④⑤
11.反应NO+O2+NO2+H2O——HNO3(未配平)是多组化学计量数的化学方程式,当氧气有1/3被NO还原时,此反应各物质化学计量数之比为
A.4:
9:
24:
14:
28B.1:
1:
2C.8:
12:
10:
20D.任意比均可
12.在常温常压下,将16mL的甲烷、乙烷和乙烯的混合物与足量的氧气混合,点燃使之完全燃烧,冷却后发现总体积比原来缩小了35mL,则混合气体中,甲烷的体积可能为
A.8mLB.10mLC.12mLD.无法判断
13.将Na2CO3、Na2CO3·
10H2O和NaHCO3的混合物43.8g溶于水制成1L溶液,取20mL该溶液,向溶液中加入0.2mol/L的H2SO4溶液,当加入H2SO4溶液25mL时,反应恰好完全。
另取43.8g的该混合物加热至质量不再变化时,其质量应为
A.26.5gB.42gC.34.3gD.24.8g
14.在一密闭容器中,用一不漏气滑动活塞隔开,常温时,左边充入1/4体积N2,右边充入3/4体积的H2和O2的混合气体。
用电火花引燃右边的气体,充分反应后,冷却至室温,此时活塞停留在容器的正中央。
则原来气体中H2和O2的体积比为
A.4:
5B.8:
1C.5:
4D.7:
2
15.反应:
2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(g)已达到平衡。
若增大压强,平衡移动,但混合气体的平均相对分子质量不变。
下列说法正确的是
A.原混合气体的平均相对分子质量为30
B.原混合气体的平均相对分子质量为18
C.起始时,NH3与CO2的体积比为13:
14
D.起始时,NH3与CO2的体积比为26:
1
16.某学生为了测定醋酸溶液中醋酸的含量,进行了如下实验:
①准确称取12gNaOH固体,配制1000mL溶液。
②取10mL醋酸溶液,用第一步配得的NaOH溶液进行滴定。
用去NaOH溶液19.9mL。
③重复上述滴定一次,此次用去NaOH溶液20.1mL。
⑴在称样时,若称重前天平的指针偏向于标尺的右方,且把砝码和被称量物质的位置放反;
而称量读数时,指针刚好在标尺的零点上。
那么所得样品的质量(填编号)
A.大于12gB.小于12gC.恰好等于12gD.不能确定
⑵配制NaOH溶液所用的主要玻璃仪器中除了玻璃棒、滴管外,还需要;
滴定时应选用的指示剂是:
。
⑶终点时,溶液中各离子浓度的大小关系为:
⑷由以上数据,计算醋酸溶液中醋酸的质量分数还缺什么物理量:
(请注明单位)。
如缺少的数据用a表示,则醋酸溶液中醋酸的质量分数为。
⑸下列操作会使结果偏高的是.
A.碱式滴定管用蒸馏水洗净后,即注入标准NaOH溶液。
B.用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失。
C.滴定前,读碱液体积时仰视;
滴定后,读碱液体积时俯视。
D.NaOH溶液露置时间太长。
17.某学生用图示装置进行实验,试回答:
⑴甲池利用电解原理在铁上镀银,则A是(填电极材料和电极名称)、,
电极反应式是;
B(要求同上)是、,
应选用的电解质溶液是
⑵乙池中若滴入少量酚酞试液,开始电解一段时间时,铁极附近呈色,C极附近呈色。
⑶若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标准状况下的体积是mL。
⑷若乙槽中剩余溶液仍为400mL,则电解后所得碱溶液的物质的量浓度为mol/L,pH值等于。
18.已知t℃时,某物质的不饱和溶液ag中含mg溶质,若该溶液蒸发掉bg水并恢复到t℃时,析出溶质m1g,若该溶液蒸发掉cg水并恢复到t℃时,析出溶质m2g。
用S表示该物质在t℃时的溶解度,下列各式正确的是。
19.难溶电解质在水溶