高考化学培优专题复习化学反应速率与化学平衡练习题含答案1文档格式.docx
《高考化学培优专题复习化学反应速率与化学平衡练习题含答案1文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学培优专题复习化学反应速率与化学平衡练习题含答案1文档格式.docx(18页珍藏版)》请在冰豆网上搜索。
(2)装置a中的浓硫酸可以吸收空气中的水蒸气,防止水蒸气进入反应装置b中发生危险,同时根据冒出的气泡的快慢来控制气体的通入量,故答案为bd;
(3)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然需要通入一段时间的空气,可以将b、d装置中的二氧化硫全部排出去,使结果更加精确;
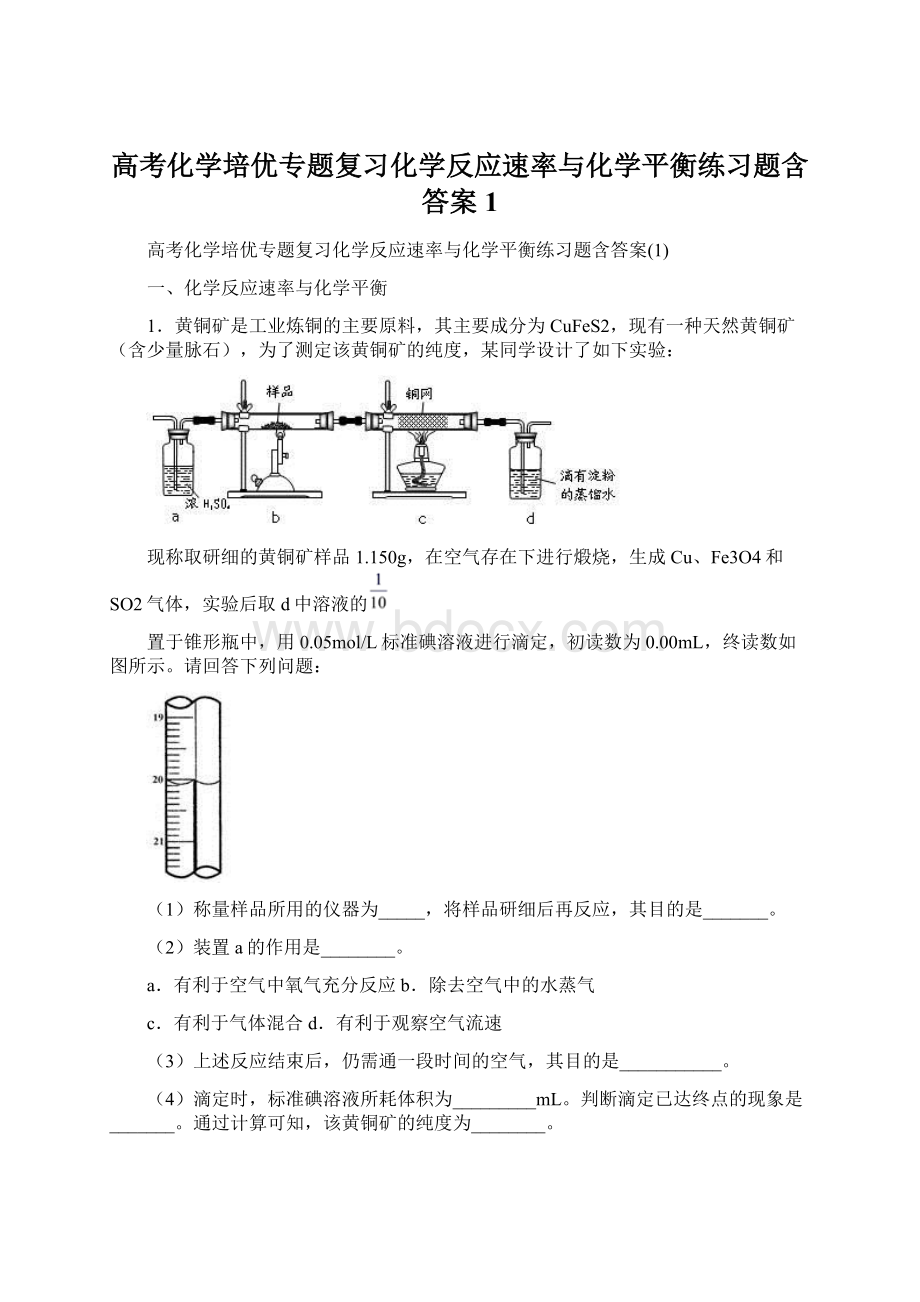
(4)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.10mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝;
根据硫原子守恒和电子守恒找出关系式:
CuFeS2~2SO2~2I2,消耗掉0.05mol/L标准碘溶液20.10mL时,即消耗的碘单质的量为:
0.05mol/L×
0.0201L=0.00105mol,所以黄铜矿的质量是:
0.5×
0.00105mol×
184g/mol×
10=0.9246g,所以其纯度是:
×
100%=80.4%;
(5)由于图2中,②硝酸钡溶液中通入二氧化硫能够生成硫酸钡沉淀,过滤干燥后,根据硫酸钡的质量计算出二氧化硫的质量,故答案为②;
(6)将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,在实验操作均正确的前提下,引起误差的可能原因主要有空气中的CO2与Ba(OH)2反应生成BaCO3沉淀或BaSO3被氧化成BaSO4。
2.某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:
橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
__________________________.
②设计实验方案:
在_________________下,测定________________________________.
③在答卷的图中将A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已画出)_______________.
④测定前,为避免NO被氧化为NO2,要用CO2排出锥形瓶和橡胶管中的空气:
在锥形瓶中加入铜片后松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是____________,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:
温度25℃、50℃;
时间t1、t2、t3;
收集气体体积V1、V2.请完成下表:
____________
实验
编号
稀硝酸的浓度/(mol/L)
稀硝酸的体积/mL
温度
/℃
时间
/min
收集气体
的体积/mL
①
a
V
25
t1
V1
②
③
【答案】
相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)相同时间内产生气体体积(或产生相同体积的气体所需的时间)
松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止
b
t1(或t2)
V2(或V1)
a(或b)
50
t2(或t1)
V1(或V2)
(只要组合体现唯一变量、时间同则气体体积不同;
时间不同则气体体积相同,均给分)
(1)①因铜失去电子,HNO3得到电子,铜作还原剂被氧化,而稀硝酸中的氮元素被还原为NO,化学方程式为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
电子转移方向和数目用单线桥表示为
;
②从所给的药品和仪器可知,本实验可以探究硝酸浓度的不同或温度的不同对反应速率的影响,而要探究一个影响因素,则必须保持其他影响因素一致,故若探究硝酸浓度对反应速率的影响,则温度相同,反之,若温度不同,则硝酸浓度相同;
测定反应速率的快慢,可以通过测定相同时间内产生气体体积或产生相同体积的气体所需的时间来进行,故答案为:
相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度);
相同时间内产生气体体积(或产生相同体积的气体所需的时间);
③根据题意可知,此装置应为排水量气装置,而D为反应的发生装置,生成的气体通过软管进入量气管,将其中的水排出,即量气管起排水量气的作用,排出的水进入贮水管,而贮水管起到贮水的作用,故橡胶软管的应D接C接B接A,故图为:
④由于量气管起到收集NO的作用,故要将锥形瓶到量气管间的空气排干净,从K2处的橡胶管向装置中通入CO2,松开K1弹簧夹,在K1处接盛有澄清石灰水的烧杯,直到石灰水变浑浊时为止,故答案为:
松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止;
(2)要设计实验探究浓度对化学反应速率的影响,则必须保持其他影响反应速率的影响因素一致,故若②的稀硝酸的浓度为b,则应保持温度与①的相同即25℃,而由于稀硝酸的浓度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;
或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2;
既然①②对比试验探究的是浓度的不同对反应速率的影响,则①③探究的是温度的不同对反应速率的影响,故③中温度应为50℃,则稀硝酸的浓度应为a,而由于温度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;
或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2,故答案为:
。
3.N2+3H2
2NH3合成氨工业对化学工业和国防工业具有重要意义。
工业合成氨生产示意图如图所示。
①X的化学式为___;
②图中条件选定的主要原因是(选填字母序号)___;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。
如图表示随条件改变,氨气的百分含量的变化趋势。
当横坐标为压强时,变化趋势正确的是(选填字母代号)___,当横坐标为温度时,变化趋势正确的是(选填字母序号)___。
【答案】NH3BCCa
根据题中工业合成氨生产示意图可知,本题考查合成氨原理及影响合成氨的因素,运用化学平衡移动原理分析。
①由合成氨生产示意图可知,原料氮气和氢气经过氨的合成、氨的分离,在冷却设备和分离器中得到最终产物,所以X为氨气,化学式为NH3。
故答案为:
NH3;
②A.合成氨是放热反应,升温会使平衡向逆反应方向移动,不利于合成氨,因此选择500℃的温度比较合适;
增大压强,能加快反应速率,也能使反应正向移动,但是过高的压强会提高反应成本,因此选择20MPa~50MPa的压强,A项错误;
B.实际生产中采用400℃~500℃的高温,催化剂铁触媒活最高,B项正确;
C.工业生产以利益最大化为目的,所以工业生产受受动力、材料、设备等条件的限制,C项正确;
BC;
③合成氨工业的原理是:
N2+3H2
2NH3,H<
0,因△H<
0,从化学平衡的角度看,
正反应为放热反应,温度越低,越有利于合成氨,增加温度,平衡向逆反应方向移动,氨气的百分含量减少;
正反应为体积缩小的反应,所以压强越大,越有利于合成氨,增大压强时平衡向右进行,氨气的百分含量增大,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;
C;
a。
4.甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:
通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。
某同学进行实验,其中A、B的成分见表:
序号
A溶液
B溶液
2mL0.2mol/LH2C2O4溶液
4mL0.01mol/LKMnO4溶液
2mL0.1mol/LH2C2O4溶液
4mL0.01mol/LKMnO4溶液和少量MnSO4
(1)该反应的离子方程式为____;
乙组:
通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号
1
2
3
4
水/mL
10
5
X
0.5mol/LH2C2O4/mL
0.2mol/LKMnO4/mL
时间/s
40
20
___
(2)X=___,4号实验中始终没有观察到溶液褪色,你认为可能的原因是____。
(3)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;
但不久突然褪色,反应速率明显加快。
某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/S
15
30
温度/℃
26
26.5
27
结合实验目的与表中数据,你得出的结论是____。
(4)从影响化学反应速率的因素看,你的猜想还可能是____的影响。
若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是___。
a.硫酸钾b.水c.氯化锰d.硫酸锰
【答案】5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O5H2C2O4的量太少,KMnO4过量反应速率加快不是温度的影响催化剂d
(1)KMnO4酸性溶液与H2C2O4溶液反应生成二氧化碳、硫酸锰和水,该反应的离子方程式为:
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(2)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1-4中溶液的总体积应该为20,则X=20-10-5=5;
环境表中数据可知H2C2O4的量太少,KMnO4过量,所以4号实验中始终没有观察到溶液褪色;
(3)根据表中数据知,20s时温度不最高,但20s前突然褪色,说明温度不是反应速率突然加快的原因;
(4)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,答案选d。
【点睛】
锰离子对于高锰酸钾和草酸的反应具有催化作用,在人教版选修四提到过,应该熟记以便于以后的应用。
5.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。
实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的______________。
a.烧杯b.容量瓶c.玻璃棒d.滴定管
(2)加入NH3•H2O调节pH=8可除去_____(填离子符号),滤渣Ⅱ中含______(填化学式)。
加入H2C2O4时应避免过量,原因是_________________。
已知:
Ksp(BaC2O4)=1.6×
10﹣7,Ksp(CaC2O4)=2.3×
10﹣9
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
2CrO42﹣+2H+═Cr2O72﹣+H2OBa2++CrO42﹣═BaCrO4↓
步骤Ⅰ:
移取xml一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol•L﹣1盐酸标准液滴定至终点,测得滴加的盐酸体积为V0mL。
步骤Ⅱ:
移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol•L﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的______________(填“上方”或“下方”)。
BaCl2溶液的浓度为______________mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
【答案】增大接触面积从而使反应速率加快acFe3+Mg(OH)2、Ca(OH)2H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少上方
偏大
制备BaCl2•2H2O的流程:
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),向其中加盐酸溶解,碳酸钡和盐酸反应:
BaCO3+2H+=Ba2++CO2↑+H2O,然后加入氨水,调节溶液的pH为8,由于Fe3+完全沉淀时的pH为3.2,此时只有Fe3+完全沉淀,所以滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,再加入氢氧化钠溶液调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;
溶液中主要含Ca2+、Ba2+,然后再加入H2C2O4,得到CaC2O4沉淀,除去Ca2+,将滤液蒸发浓缩冷却结晶可得到BaCl2•2H2O。
(1)可以通过增大固体反应物的接触面积方法增大反应速率;
根据配制物质的量浓度溶液的要求确定需要使用的仪器;
(2)根据流程图和表中数据分析加入NH3•H2O调节pH=8,利用不同金属阳离子形成沉淀的pH的不同,确定沉淀的成分及去除的离子;
结合加入H2C2O4的量的多少,分析发生的反应及造成的影响;
(3)根据滴定管的构造分析0刻度在滴定管的位置;
利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行,根据反应中物质的相应量的关系,计算出BaCl2溶液的浓度;
然后根据操作分析消耗标准溶液的体积多少,判断误差,据此判断。
(1)毒重石是固体物质,由于化学反应的速率与反应物的接触面积有关,所以可以将毒重石在用盐酸浸取前充分研磨的方法,增大反应物的接触面积,提高反应速率;
在实验室用37%的盐酸配置15%的盐酸,需先计算出浓盐酸的体积和水的体积,用量筒量取;
浓盐酸稀释为稀盐酸,需用烧杯作为容器,并用玻璃棒搅拌加速溶解,所以除量筒外还需使用量筒、玻璃棒,选项是ac;
(2)根据流程图和表中数据可知:
Fe3+完全沉淀时的pH为3.2,加入氨水,调节溶液的pH为8,发生反应:
Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3;
加入氢氧化钠调节pH=12.5,由于Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×
10-7,Ksp(CaC2O4)=2.3×
10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,使产品的产量减少;
(3)无论酸式还是碱式滴定管,0刻度都位于滴定管的上方;
待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol/L盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H2O的盐酸的物质的量为:
V1×
10-3×
bmol,步骤Ⅰ:
用bmol/L盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:
V0×
bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×
bmol-V1×
bmol=(V0-V1)b×
10-3mol,步骤Ⅱ:
移取ymLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:
c(BaCl2)=
mol/L=
mol/L;
若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则V1减小,使得Ba2+浓度测量值将偏大。
本题考查了实验室利用毒重石制备BaCl2•2H2O的设计方法,侧重考查影响反应速率的因素、实验基本操作、沉淀溶解平衡的应用等知识,实验步骤结合物质的性质分析是解答的关键。
6.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
[实验一]配制并标定醋酸溶液的浓度
取冰醋酸配制250mL0.2mol·
L-1的醋酸溶液,用0.2mol·
L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。
回答下列问题:
(1)配制250mL0.2mol·
L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000mol·
L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
消耗NaOH溶液的体积(mL)
20.05
20.00
18.80
19.95
则该醋酸溶液的准确浓度为________(保留小数点后四位)。
[实验二]
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下,回答下列问题:
醋酸浓度
(mol·
L-1)
0.0010
0.0100
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.73
(3)从表中的数据,还可以得出另一结论:
随着醋酸浓度的减小,醋酸的电离程度将________(填“增大”“减小”或“不变”)。
(4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:
______。
[实验三]探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案:
___________________________________。
【答案】胶头滴管250mL容量瓶0.2000mol·
L-1增大0.0100mol·
L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1(或其他合理答案)用pH计(或pH试纸)测定相同浓度的醋酸在几种不同温度时的pH
实验一:
(1)根据仪器的用途选取仪器,用胶头滴管定容,用250mL容量瓶配制溶液,
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;
实验二:
(1)以0.1000mol/L、0.0100mol/L醋酸为例,设0.1000mol/L的醋酸溶液体积为1L,将其稀释至0.0100mol/L,体积变为10L,两溶液中H+的物质的量分别为:
10-2.88mol、10-2.38mol,可见溶液变稀,电离出的H+的物质的量增大;
(1)根据仪器的用途选取仪器,用胶头滴管定容,用250mL容量瓶配制溶液,答案为:
胶头滴管;
250mL容量瓶;
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;
另外三次所用NaOH平均体积为:
mL=20.00mL,则氢氧化钠溶液平均浓度:
=0.2000mol/L,答案为:
0.2000mol/L;
10-2.88mol、10-2.38mol,可见溶液变稀,电离出的H+的物质的量增大,说明醋酸的电离程度增大,答案为:
增大;
(2)看每次测量值,H+浓度远小于醋酸的浓度,说明醋酸不完全电离;
联系起来看,浓度为0.1000mol/L、0.0100mol/L及0.0010mol/