电化学方程式电化学总结与测试Word文档下载推荐.docx
《电化学方程式电化学总结与测试Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《电化学方程式电化学总结与测试Word文档下载推荐.docx(18页珍藏版)》请在冰豆网上搜索。
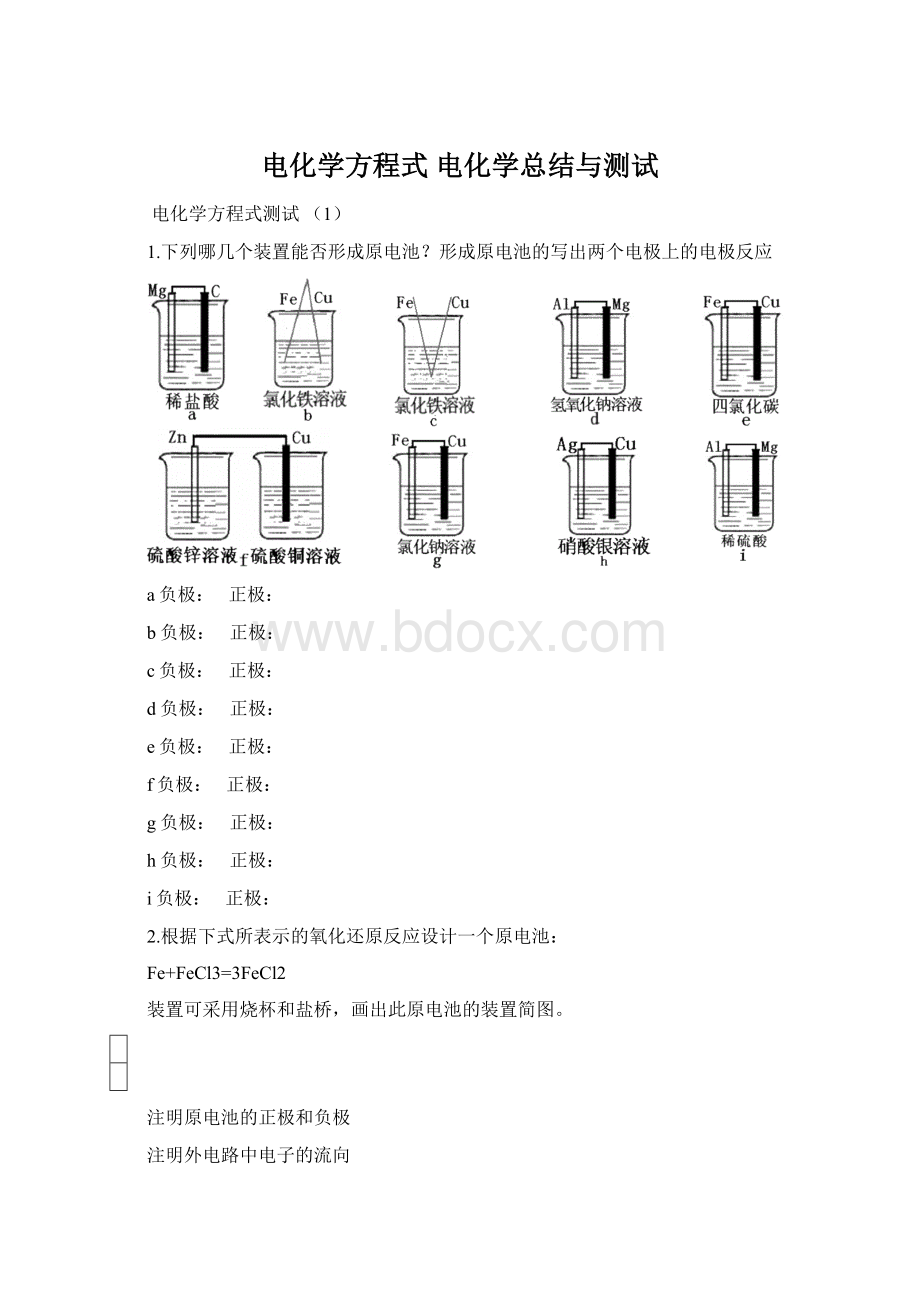
2.Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2
放电时负极
充电时阳极
电化学方程式测试(3)
燃料电池
1、氢氧燃料电池(碱性介质)
2、氢氧燃料电池(酸性介质)
3、甲烷燃料电池(碱性电池)
4、甲烷燃料电池(酸性介质)
5、甲醇燃料电池(碱性电池)
6、乙烷燃料电池(碱性电池)
电化学方程式测试(4)
1燃料电池
介质
电池反应:
2H2+O2=2H2O
酸性
负极
正极
中性
碱性
2.海水电池
电池总反应式为:
4Al+3O2+6H2O=4AlOH3
正极:
3.、锂电池
8Li+3SO2Cl2=6LiCl+Li2SO3+2S
4.某原电池中,电解质溶液为KOH(aq),分别向负极通入C2H4、C2H2,分别向正极通入O2.试完成下列问题:
(1)当分别通入C2H4和O2时:
(2)当分别通入C2H2和O2时:
电化学测试(5)
完成下列溶液的电极反应。
(以石墨为电极电解)
1.硫酸溶液:
阴极:
阳极:
总反应化学方程式:
2.盐酸:
3.NaOH溶液:
4.CuBr2溶液:
5.KCl溶液:
6.CuSO4溶液:
7.Na2SO4溶液:
8.硝酸银溶液
电化学方程式测试(6)
铜电极的电极反应
银电极的电极反应
总反应离子方程式
Fe棒上电极的电极反应
C棒上电极的电极反应
总反应化学方程式
Fe棒上电极的电极反应
总反应化学方程式
铁棒上的电极反应
C棒上的电极反应
总反应化学方程式
铁棒上的电极反应
C棒上的电极反应
总反应化学方程式
铜棒上的电极反应
C棒上电极反应
总反应化学方程式
铜棒上的电极反应
棒上电极反应
总反应化学方程式
Ag棒上电极的电极反应
Cu棒上电极的电极反应
a极的电极反应:
b极的电极反应:
粗铜精炼
阳极:
(写主要反应即可)
A池名称为___________B池名称为______________
⑵锌极为________极,电极反应式为_________________________
铜极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2为______极,电极反应式为________________________
电化学小结
池
池
装置实例
定 义
将 能转变成 能装置
将 能转变成 能的装置
形成条件
①活泼性不同的两电极
②电解质溶液或熔融电解质
③形成闭合回路
①两电极接直流电源
活泼性不同或相同的两电极
电极名称
极:
较活泼金属
较不活泼金属(或能导电的非金属)
与电源正极相连
与电源负极相连
电极反应
发生 反应,金属失电子
发生 反应,溶液中的 离子得电子
发生 反应,溶液中的阴离
失电子或电极金属失电子
电子流向
极→ 极
电源 极→电解池 极
电解池 极→电源 极
电解质溶液用惰性电极电解的示例
电解
类型
举例
溶液PH
变化
溶液复原方法
物质类别
实例
仅溶剂
水电解
仅溶质
溶质和
溶剂同
时电解
三池的原理都是电解,但在装置和具体反应上略有差异。
池型
电解池
电镀池
铜的精炼池
装置
特征
惰性电极
不一定是惰性电极
金属
电镀液:
含 金属离子
铜
电解液:
CuSO4溶液
电极
反应
易放电的 离子首先放电
M-ne-==Mn+
Mn++ne-==M
Cu-2e-==Cu2+
Cu2++2e-==Cu
电解质溶液的浓度
电化学测试
(一)
一、选择题(每题只有一个正确选项)
1已知外电路中,电子由铜流向a极。
有关下图所示的装置分析合理的一项是
A.该装置中Cu极为正极
B.当铜极的质量变化为12.8g时,
a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:
H2-2e-=2H+
D.一段时间后锌片质量减少
2关于如图所示装置的叙述正确的是
A.电流由锌经导线流向铂,电子由铜经导线流向碳棒
B.碳棒是正极,铜片是阳极
C.锌片的质量逐渐减少,铂片的质量逐渐增加
D.锌片上发生还原反应,碳棒上发生氧化反应
3.铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:
Pb+PbO2+2H2SO4
2PbSO4+2H2O,有关该电池的说法正确的是
A.放电时,蓄电池内电路中H+向负极移动
B.放电时,每通过1mol电子,蓄电池就要消耗2molH2SO4
C.充电时,阳极反应:
PbSO4+2e-=Pb+SO42-
D.充电时,铅蓄电池的负极与外接电源的负极相连
4.我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是(设NA代表阿伏加德罗常数)
A.该氢氧燃料电池是一种具有应用前景的绿色电源
B.该电池工作一段时间后,电解液中KOH的物质的量不变
C.该氢氧燃料电池工作时氢气在负极被氧化
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时理论上有0.1NA电子转移
5.右图中,两电极上发生的电极反应为:
a极:
Cu2++2e-=Cu
b极:
Fe-2e-=Fe2+
下列说法不正确的是
A.装置中电解质溶液一定含有Cu2+B.该装置一定是化学能转化为电能
C.a、b可能是同种电极材料D.a极上一定发生还原反应
6.下列叙述正确的是
A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:
2
C、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
7.如右图所示的装置,C、D、E、F都是惰性电极。
将电源接通后,向饱和NaCl溶液中滴入酚酞溶液,在F极附近显红色。
则以下说法正确的是
A.电源B极是正极
B.电极D是阳极
C.两烧杯内溶液的pH都逐步增大
D.C、D、E、F电极均有单质生成,
其物质的量比为1:
2:
8关于如图所示装置的叙述,正确的是
A.甲乙装置中锌片都作负极
B.甲乙装置中,溶液内的氢离子在铜片表面被还原
C.甲乙装置中,锌片上发生的反应都是还原反应
D.甲装置中,铜上面有气泡生成,乙装置中铜片质量减少
9如图所示,a、b、c、d均为石墨电极,通电进行电解。
下列说法正确的是
A.乙烧杯中d的电极反应为2Cl––2e–=Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
D.乙烧杯中发生的反应为:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
10.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气。
有关此电池的推断正确的是
A.负极反应为14H2O+7O2+28e—=28OH—
B.放电一段时间后,负极周围的pH升高
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电过程中KOH的物质的量浓度不变
11某蓄电池充放电的反应如下:
Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
。
下列推断中正确的是
A.放电时铁为正极;
NiO2为负极
B.充电时阴极的电极反应式为:
Fe(OH)2+2e-===Fe+2OH-
C.充电时,铁为阳极
D.放电时,正极附近溶液的碱性减弱
12下列能够使反应:
Cu+2H2O=Cu(OH)2+H2↑获得成功的是:
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜——锌合金在潮湿的空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解氯化钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
二、填空题
13
如上图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。
通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。
请回答下列问题:
(1)电源P极为 极;
请分别写出b极和c极上发生的电极反应式:
;
(2)c极上析出固体铜的质量为
g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
Pb+SO42-=PbSO4+2e-
PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050mol,这时电池内消耗的H2SO4的物质的量至少是
mol
14下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是
,电极名称是
,N的电极反应式为
,通入乙醇的铂电极的电极反应式为
。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
L(标准状况下);
若此时乙池溶液的体积为400mL,则乙池中溶液的pH为
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为
答案
1.B2.C3.D4.D5.B6.C7.D8.D9.D10.C11.B12C
13
(1)负, 4OH――4e-=2H2O+O2↑;
Cu2++2e—=Cu;
(2)16g,
(3)0.10mol
14
(1)铁
阴极
4OH—-4e—=2H2O+O2↑
C2H5OH-12e+16OH—=2CO32—+11H2O
(2)0.224;
1
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol
电化学测试
(二)
1.
某课外活动小组进行电解饱和食盐水的实验(如图1)。
请回答下列问题:
(1)通电一段时间后,可观察到 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为 。
(2)该溶液电解反应的化学方程式为
(3)若开始时改用铁棒做阳极,阳极的电极反应式为
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图2),两个电极均由多孔性炭制成,通入气体由孔隙中逸出,并在电极表面放电。
其中a是 极(填“正”或“负”)。
B极的电极反应式为
2
(1)若开始时开关K与a连接,则B极的电极反应式为
(2)若开始时开关K与b连接,则B极的电极反应式为
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子.
3.在25℃时,用石墨电极电解
,
溶液,如有
电子发生转移,试回答下列问题:
(1)阴极发生反应,电极反应为。
(2)阳极发生反应,电极反应为。
(3)电解后得到的
的质量是,得到
的体积(标准状况)是
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的
(填“变小”、“变大”或“不变”)
4.如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。
一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被 (填“氧化”或“还原”);
向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应
为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子
方程式为 。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。
反应一段时间后,停止通电。
向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;
甲烧杯中铁电极的电极反应为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况
下体积为 mL。
5.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题:
①计算电极b上生成的气体在标准状态下的体积:
L
②电极c的质量变化是g;
(二)答案
1.
(1).阴极
2.(I)2Cl—+2H2O
2OH—+Cl2↑+H2↑,阴极
(II)
(1)0.1;
CuO或CuCO3(仅答1种即可)
3..
(1)还原反应、2Cu2++4e-=2Cu
(2)氧化反应、4OH--4e-=2H2O+O2↑
(3)6.4g(4)12.8g,不变
4.
(1)氧化
O2+4e-+2H2O===4OH-
(2)正
2Fe3++
Cu===2Fe2++Cu2+
(3)①正
Fe-2e-===Fe2+
②2Cu2++2H2O
2Cu+O2↑+4H+
③224
5.2.816g