材料与方法Word格式文档下载.docx
《材料与方法Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《材料与方法Word格式文档下载.docx(17页珍藏版)》请在冰豆网上搜索。
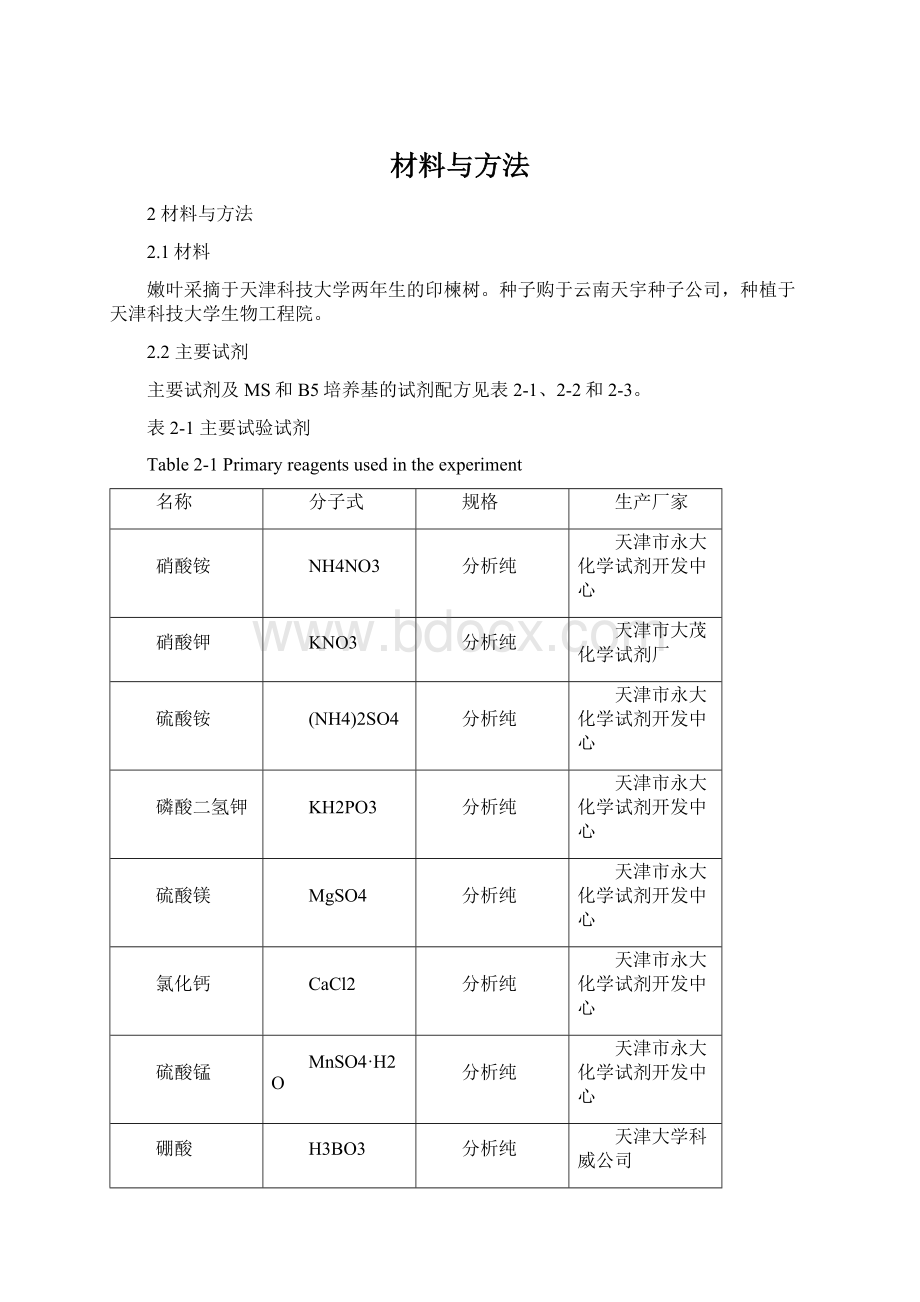
NaMO4·
2H2O
天津市化学试剂四厂
硫酸铜
CuSO4·
5H2O
氯化钴
CoCl2·
6H2O
天津市北方天医化学试剂厂
碘化钾
KI
硝酸银
AgNO3
天津市化学试剂二厂
甘氨酸
C2H5NO2
天津市光复精细化工研究所
肌醇
C6H12O6
中国惠兴生化试剂有限公司
烟酸
C6H5NO2
VB1
C12H17ClN4OS·
HCl
VB6
C8H11NO3·
醋酸钠
NaCH3COOH
苯丙氨酸
C9H11NO2
亮氨酸
C6H13NO2
MJ
C13H20O3
2,4-D
C8H6Cl2O3
北京马氏精细化学品有限公司
NAA
C12H10O2
IBA
C12H13NO2
KT
C10H9N5O
6-BA
C12H11N5
次氯酸钠
NaClO
葡萄糖
果糖
蔗糖
C12H22O11
甲醇
CH3OH
天津康科德
色谱纯
冰醋酸
CH3COOH
乙醇
CH3CH2OH
表2-2MS培养基配方表
Table2-2FormulaofMSmedium
化合物
使用浓度(mg/L)
硝酸铵(NH4NO3)
1650
硼酸(H3BO3)
6.2
硝酸钾(KNO3)
1900
硫酸锌(ZnSO4·
7H2O)
8.6
磷酸二氢钾(KH2PO4)
170
硫酸亚铁(FeSO4·
27.8
硫酸镁(MgSO4·
370
乙二胺四乙酸二钠(Na2EDTA)
37.3
氯化钙(CaCl2·
2H2O)
440
2
钼酸钠(NaMoO4·
0.25
盐酸硫胺素
0.4
硫酸铜(CuSO4·
5H2O)
0.025
盐酸吡哆素
0.5
氯化钴(CoCl2·
6H2O)
碘化钾(KI)
0.83
100
硫酸猛(MnSO4·
4H2O)
22.3
表2-3B5培养基配方表
Table2-3FormulaofB5medium
硫酸铵((NH4)2SO4)
134
10
2500
3
250
150
盐酸硫胺
1
0.75
2.3主要试验仪器
主要试验仪器,如表2-4.
表2-4主要试验仪器
Table2-4Instrumentsusedintheexperiment
电子分析天平
上海梅特勒-托利多仪器公司
电热恒温鼓风干燥箱
天津市天宇实验仪器有限公司
TDL-40B低速台式大容量离心机
上海安亭科学仪器厂
LDZX-40B不锈钢立式灭菌消毒器
上海申安医疗器械厂
FE-20-pH计
梅特勒-托利多仪器(上海)有限公司
HPS-280生化培养箱
哈尔滨市东联电子技术开发有限公司
HNY-82摇床
天津市欧诺仪器仪表有限公司
BCN-1360超级洁净工作台
TU-1810紫外可见光分光光度计
北京普析通用仪器有限责任公司
AS20500AT型超声波清洗器
天津奥特赛恩斯仪器有限公司
DZKW-4电热恒温水浴锅
北京市长风仪器仪表公司
HelzdadWB型旋转蒸发仪
德国Heidolph公司
SHB-B95循环水式多用真空泵
郑州长城科工贸有限公司
DDSJ-30BA电导率仪
上海精密科学仪器有限公司
SPD-10A紫外检测器
日本岛津公司(SHIMDZU)
2.4试验方法
2.4.1印楝愈伤组织的诱导
在进行愈伤组织培养前,先洗衣粉对幼叶进行小心清洗,然后再自来水冲洗3小时左右。
转移到超净台中,用70%(v/v)的乙醇对叶子表面进行杀毒1min,然后用无菌蒸馏水(SDW)冲洗3次,并重复操作2-3次。
随后,再用0.1%(w/v)的HgCl2消毒8min,SDW冲洗3–4次。
然后,用无菌滤纸将叶片上水珠吸附干净后,将叶片边缘上的不规则锯齿状叶尖切去,同时去除叶柄,之后将幼叶切割成约1cm2的小块[45],继而作为外植体分别转接到含有不同激素种类及配比的MS培养基上,在25±
2℃下进行暗培养。
MS培养基的激素含量分别是:
(2,4-D1.0mg/L:
6-BA1.0mg/L),(2,4-D2.0mg/L:
BA1.0mg/L);
(2,4-D3.0mg/L:
BA1.0mg/L),(2,4-D4.0mg/L:
6-BA1.0mg/L);
(NAA3.0mg/L:
BA1.0mg/L),(2,4-D3.0mg/L:
(IBA3.0mg/L:
6-BA1.0mg/L),(IAA3.0mg/L:
6-BA1.0mg/L)。
30天后观察并统计不同培养条件下,外植体叶子的出愈情况以及愈伤的形态特征等,并确定最佳激素配比,对长出的愈伤予以继代。
第一次继代时间间隔为30天,以后每隔20天对颜色浅黄、质地松散的愈伤继代一次。
2.4.2印楝悬浮细胞培养体系的建立
在无菌条件下,取继代3次的浅黄松散的愈伤适量并切碎,过80目筛网。
然后分别取鲜重约5g过筛的愈伤,放置于100mL含有3%蔗糖和不同激素种类、激素配比的MS培养液和B5培养液(方案如表2-5)中进行震荡培养。
培养条件为温度25±
2℃,转速125rpm,光暗周期8/16h。
每隔12天继代一次,继代接种量为30%(v/v)。
继代3次后收集细胞,测定生物量和印楝素含量。
表2-5悬浮细胞培养体系培养基及单中生长激素配比
MS培养基
IBAmg/L
6-BAmg/L
B5培养基
NAAmg/L
8
4
按上述方法分别取鲜重约5g过筛的愈伤,接种于不同比例的IBA、NAA的MS+B5+6-BA培养液中(方案如表2-6),在温度25±
2℃,转速125rpm,光暗周期8/16h的条件下震荡培养。
每隔12天对应继代一次,继代接种量为30%(v/v)。
继代3次后收集细胞,测定生物量和印楝素含量,结合上述结果以确定最佳培养基、激素及最佳配比。
表2-6悬浮细胞培养体系组合生长激素配比
MS培养基
+
6
通过上述结果,以最佳成分比对悬浮细胞体系进行细胞生长周期的测定,期间考查指标为培养液中蔗糖剩余量、氮源(NO3-、NH4+)剩余量、磷源(PO43-)的剩余量、生物量以及印楝素含量。
2.4.3铵态氮与硝态氮对愈伤组织的影响
取2.0g浅黄松散的愈伤3×
3份,分别接种于蔗糖含量和琼脂含量均为3%和0.65%的MS+6-BA+NAA+NO3-:
NH4+(2:
1)培养基、MS+6-BA+NAA+NO3-:
NH4+(3:
1)培养基和MS+6-BA+NAA+NO3-:
NH4+(4:
1)培养基上,然后在25±
2℃条件下进行24h暗培养。
每隔20天继代一次,继代3次后分别收集三种培养基上的愈伤,观察并测定其生物量、细胞色素含量、可溶性蛋白含量、柠檬苦素类物质含量、印楝素A含量以及转录基因表达差异性。
2.4.3铵态氮与硝态氮对愈伤组织的影响
分别从含3%蔗糖和0.65%琼脂的MS+6-BA+NAA+NO3-:
1)培养基上取浅黄松散的愈伤组织5.0g,切碎过筛(80目)后接种于含对应成分的培养液中,并在温度25±
继代3次后,分别收集三种培养液中的悬浮细胞。
然后观察并测定其生物量、细胞色素含量、可溶性蛋白含量、柠檬苦素类物质含量、印楝素A含量以及转录基因表达差异性。
2.5分析方法
2.5.1愈伤组织诱导率的测定
诱导率,即愈伤形成数与诱导用总外植体数之百分比,如公式2-1.
×
100%公式2-1.
2.5.2印楝细胞生物量的测定
将一定体积的悬浮细胞液置于离心管中,转速3000r/min,离心10min,弃去上清液,用重蒸水洗涤细胞2次,弃去上清液,称得离心管底部细胞的质量,即为细胞鲜重(FreshWeight,FW);
至于烘箱中50℃干燥7−8h以至恒重,取出置于干燥箱中冷却至室温,称其质量为细胞干重(DryWeight,DW)。
细胞干重与体积之比即为细胞生物量,如公式2-2.
(g/L)公式2-2.
2.5.3柠檬苦素类的含量测定
(1)样品溶液的制备
样品分别按照不同实验的相应提取方法准备。
(2)对照品溶液的制备
精确称取干燥至恒重的柠檬苦素类对照品印楝素5mg,用二氯甲烷溶解,定容至50mL,配制成0.1mg/mL的对照品溶液。
(3)最大吸收峰的确定
精确吸取印楝素对照品溶液1.4mL,加入香草醛甲醇溶液(0.02g/mL)溶液0.4mL,用手振荡混合均匀,室温放置2min后,分3次加入0.6mL浓硫酸,每次加入后迅速震荡10s,再加入1.4mL的甲醇溶液。
用二氯甲烷做空白对照,静置10min后于400−600nm波长范围内扫描,结果在579nm处有最大吸收[a1]。
(4)标准曲线绘制
分别取0.0,0.3,0.5,0.7,0.9,1.1,1.4mL标准品溶液置于7支10mL试管中,用甲醇分别定容到1.4mL,加入香草醛甲醇溶液(0.02g/mL)溶液0.4mL,用手振荡混合均匀,室温放置2min后,分3次加入0.6mL浓硫酸,每次加入后迅速震荡10s,再加入1.4mL的甲醇溶液。
静置10min后用紫外可见分光光度计测定其在579nm处的吸光度值。
以吸光度对柠檬苦素类质量浓度作回归处理,得回归曲线和回归方程见图2-1。
图2-1柠檬苦素对照品标准曲线
Fig.2-1Standardcurveofazadirachtinrelatedlimonoidscontent
(5)样品中柠檬苦素类含量的测定
精密称取干细胞样品0.15g,用10mL甲醇浸泡过夜,超声提取两次,30min/次,按60∶40的比例把水加到甲醇液里,再用与甲醇同样体积的二氯甲烷萃取含水的甲醇溶液两次。
合并的二氯甲烷溶液在40℃下真空旋干,再用5mL二氯甲烷重溶。
分别取1.4mL样液于试管中,加入香草醛甲醇溶液(0.02g/mL)溶液0.4mL,用手振荡混合均匀,室温放置2min后,分3次加入0.6mL浓硫酸,每次加入后迅速震荡10s,再加入1.4mL的甲醇溶液,用二氯甲烷做空白对照,按照标准曲线的方法测定吸光度,由回归方程计算样品溶液中总柠檬苦素类含量质量浓度,按下式计算样品中总柠檬苦素类含量:
公式2-3.
式中:
C为样品中柠檬苦素类浓度,mg/L;
L为柠檬苦素类的稀释因素;
M为样品质量,g.
2.5.4印楝素A的含量测定
(1)色谱条件
色谱柱为PromosilC18(5μm,4.6×
250mm)柱;
流动相A:
乙腈,B:
水,A为90%。
流速0.5mL/min。
检测波长214nm,柱温45℃,进样量20μL[45]。
a
图2-2印楝素A保留时间
Fig.2-2TheretentiontimeofazadirachtinA
(2)标准品溶液的制备
精确称取干燥至恒重的样品10.0mg,用二氯甲烷溶解,定容至50mL,配制成0.2mg/mL的样品储备溶液,在0-0.2mg/mL范围内对样品液进行稀释,各对照品储备液用0.22μm微孔滤膜过滤后密封置冰箱中保存备用。
标准曲线和回归方程见图2-2。
图2-2印楝素A对照品标准曲线
Fig.2-2StandardcurveofazadirachtinAcontent
(3)样品溶液的制备
精密称取干细胞样品0.2g,用10mL甲醇浸泡过夜,超声提取两次,30min/次,按60∶40的比例把水加到甲醇液里,再用与甲醇同样体积的二氯甲烷萃取含水的甲醇溶液两次。
合并的二氯甲烷溶液在40℃下真空旋干,再用10mL甲醇重溶。
样品液也用0.22μm微孔滤膜过滤后用于检测。
(4)样品中印楝素含量的测定
根据回归方程算出样液中印楝素的质量浓度,再按式2-5计算出样品中印楝素含量。
公式2-4.
C为样品中印楝素浓度(mg/L),L为印楝素的稀释因素,M为样品质量(g)。
2.5.5印楝细胞悬浮培养过程中的动力学分析
2.5.5.1蔗糖含量的测定
取稀释成一系列0−200μg/mL的不同浓度标准蔗糖溶液1mL,加入200μL2mol·
L-1NaOH,100℃煮沸5min,冷却后加入2.8mL30%HCl,0.8mL0.1%间苯二酚,摇匀,80℃水浴反应10min,冷却后480nm处测定吸光度。
其回归曲线和标准曲线方程见图2-3。
由标准曲线方程计算蔗糖的含量。
图2-3蔗糖标准曲线
Fig.2-3Standardcurveofsucrosecontent
2.5.5.2葡萄糖含量的测定
取稀释成一系列0-100ug/mL的不同浓度标准葡萄糖溶液1mL,加入4mL蒽酮-硫酸试液(称取0.33g蒽酮,加100mL浓硫酸,置于棕色瓶中,混合摇匀置于冰箱中,现用现配),立即摇匀,置于冰水浴中,然后一起置于沸水浴中加热7min,之后用流动自来水迅速冷至室温,放置10min后,于480nm处测定吸光度[a2]。
其标准曲线和回归方程见图2-4。
由标准曲线方程计算葡萄糖的含量。
图2-4葡萄糖标准曲线
Fig.2-4Standardcurveofglucosecontent
2.5.5.3果糖含量的测定
分别取0−200μg/mL间的不同浓度果糖溶液各1mL,加入2.8mL30%的HCl,0.8mL0.1%间苯二酚,80℃水浴反应10min,冷却后480nm处测定吸光度[a2]。
回归方程和标准曲线见图2-5。
由标准曲线方程计算果糖的含量。
图2-5果糖标准曲线
Fig.2-5Standardcurveoffructosecontent
2.5.5.4硝态氮(NO3---N)浓度的测定
取稀释成一系列0-100μg/mL的不同浓度的标准KNO3溶液100μL,加入0.4mL5%的水杨酸-浓硫酸溶液,摇匀,静置20min,再加入9.5mL8%的NaOH溶液,混匀,冷却至室温后,410nm处测定吸光度值[a3]。
其标准曲线和回归方程见图2-6。
由标准曲线方程计算NO3--N的浓度。
图2-6硝酸根含量的标准曲线
Fig.2-6Standardcurveofnitratecontent
2.5.5.5铵态氮(NH4+-N)的浓度测定
取稀释成一系列0-5μg/mL的不同浓度亮氨酸的标准溶液2mL,加入3mL茚三酮试剂(1.2g重结晶的茚三酮放到锥形瓶中,加入15mL正丁醇,摇匀使之溶解,加入30mL正丁醇和60mL乙二醇,混匀再加入9mLpH5.4醋酸缓冲液,混匀,置于棕色瓶中,冰箱中保存),加入0.1mL1%抗坏血酸,沸水浴15min,取出后用冷水迅速冷却并不时摇动,使加热时形成的红色被空气逐渐氧化而褪去,进而呈现蓝紫色,之后加酒精补到5mL,混匀,在550nm处测定吸光度[a4]。
其标准曲线和回归方程见图2-7。
由回归方程计算NH4+-N的浓度。
图2-7铵态氮的标准曲线
Fig.2-7Standardcurveofammoniumcontent
2.5.5.6PO43+--P的浓度测定
分别取0−50μg/mL的不同浓度的标准KH2PO4溶液各1mL置于试管中,加入钼酸铵-硫酸溶液(25g钼酸铵溶于200mL去离子水。
将280mL浓硫酸慢慢倒入400mL去离子水中,冷却。
然后把上述配好的钼酸铵溶液加入硫酸溶液中并用去离子水稀释至1L)3mL,摇匀,再加SnCl2(称5.7gSnCl2于大烧杯中,加入60mL浓HCl并加热,溶解后用去离子水稀释至300mL。
溶液中加入少量锡粒,以防Sn2+氧化)0.1mL,混匀,静置10-15min,然后于660nm处测定吸光度[a3]。
其标准曲线和回归方程见图2-8。
由回归方程计算PO43+-P的浓度。
图2-8磷标准曲线
Fig.2-8Standardcurveofphosphatecontent
2.5.6印楝细胞中叶绿素含量的测定[a5,a6]
(1).取悬浮细胞或愈伤组织5g于研钵中,加入少许石英砂(0.5~1g)和CaCO3,充分研磨后倒入100mL容量瓶中,然后用丙酮分几次洗涤研钵并倒入容量瓶中,用丙酮定容至100mL。
(2).充分摇匀后,用滤纸过滤,取滤液。
以95%的丙酮溶液作空白对照,用分光光度计分别于645nm和663nm波长下,测定滤液的吸光度。
(3).按公式2-5分别计算样品组织中叶绿素a、b和总叶绿素含量
叶绿素含量a=(12.7×
D663-2.69×
D645)×
V/1000×
W(mg/gFW)
叶绿素含量b=(22.9×
D645-4.68×
D663)×
W(mg/gFW)
总叶绿素含量=(20.2×
D645+8.02×
D--吸光度读数;
V--丙酮提取液的最终体积(g);
W--样品鲜重(g).
公式2-5.
2.5.7印楝细胞中可溶性蛋白的测定(考马斯亮蓝法)[a7,a8]
(1).标准蛋白质溶液(200μg/mL牛血清白蛋白)配制:
称取牛血清蛋白25mg,加蒸馏水溶解并定容至100mL,吸取上述溶液80mL,用蒸馏水稀释至100mL.
(2).最大吸收波长扫描:
取牛血清白蛋白制成一定浓度梯度的标准品溶液,全波长扫描后在最大吸收峰作处测定吸光度。
(3).考马斯亮蓝试剂配制:
称取100mg考马斯亮蓝G-250,溶于50mL90%乙醇中,加入100mL85%(W/V)磷酸,再用蒸馏水定容到1000mL,摇匀,过滤,贮于棕色瓶中。
(4).磷酸缓冲液(PBS)的配制:
先配制母液A液和B液,然后依据表2-7,分别取母液A、B液,配制不同pH磷酸缓冲液。
A液--0.2MNaH2PO4(H2O27.6g/L;
2H2O35.88g/L);
B液--0.2MNa2HPO4(2H2O35.6g/L;
7H2O53.6g/L;
12H2O71.6g/L);
表2-7不同pH磷酸缓冲液(PBS)的配制
pH
A液
B液
7.3
23.0
77.0
7.7
10.0
90.0
7.4
19.0
81.0
7.8
8.5
91.5
7.5
16.0
84.0
7.9
7.0
93.0
7.6
13.0
87.0
8.0
5.3
94.7
(5).样品液可溶性蛋白质的提取:
称取植物组织或细胞鲜样0.5g,加入3mL磷酸缓冲液(PBS)和适量石英砂,冰浴上充分研磨匀浆,移入10mL离心管中,再用5mLpH7.8缓冲液冲洗,一并转入10mL离心管中,于4℃、12000×
g离心15min,收集上清液即为可溶性蛋白质提取液,低温保存备用。
(6).可溶性蛋白质含量标准曲线测定:
取6支试管,按表2-8相应地加入标准蛋白质溶液和蒸馏水,混匀后,向各管中加入5mL考马斯亮蓝G-250溶液。
每加完一支试管,立即在旋涡混合器上混合(注意不要太剧烈,以免产生大量气泡而难于消除)。
混合后静置5