高考化学专题复习钠及其化合物Word文件下载.docx
《高考化学专题复习钠及其化合物Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学专题复习钠及其化合物Word文件下载.docx(13页珍藏版)》请在冰豆网上搜索。
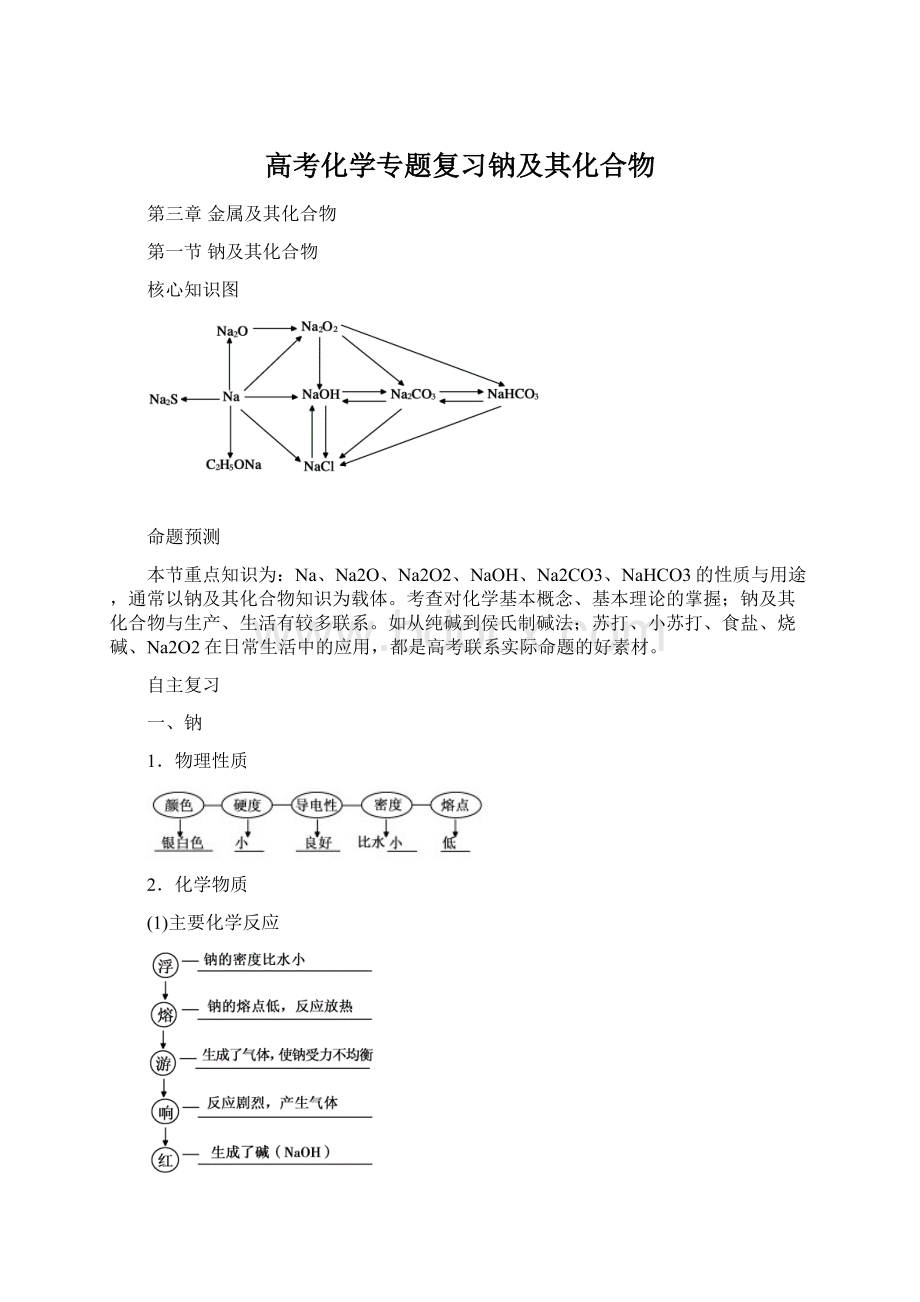
①钠与煤油、CCl4均不反应,所以可以保存在煤油或CCl4中 ②钠可以保存在酒精中 ③在自然界中,没有游离态的钠 ④1mol钠分别与足量水、氧气、氯气充分反应时,均转移1mol电子 ⑤钠与水反应可能产生O2 ⑥Na可以把Cu从其盐溶液中置换出来 ⑦钠在常温下与空气充分接触,因为氧气过量,所以会生成Na2O2
3.NaOH和CO2的反应
(1)方程式
2NaOH+CO2===Na2CO3+H2O
Na2CO3+CO2+H2O===2NaHCO3
NaOH+CO2===NaHCO3
(2)产物
(1)怎样鉴别Na2O、Na2O2?
答:
_______________________________________________________________________。
(2)利用澄清石灰水能否鉴别Na2CO3、NaHCO3溶液?
用盐酸呢?
_____________________________________________________________________________。
三、焰色反应
1.概念
金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,属于______变化,属于元素的性质。
2.操作步骤
铂丝
_________―→醮取待测物
观察火焰颜色
________。
3.常见元素的焰色
钠元素:
_____;
钾元素:
_____(透过蓝色钴玻璃)。
4.应用
检验部分金属元素的存在(包括单质和化合物)。
①焰色反应是化学反应 ②不论灼烧Na2CO3、NaCl、Na2SO4还是钠单质燃烧,均发出黄色火焰 ③用焰色反应检验钾时,可直接观察火焰的颜色 ④用焰色反应可以鉴别NaCl和KCl
自主评估
1.钠与水反应时的现象中与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小D.有强还原性
2.(2013·
郑州模拟)取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.②⑤B.①②③
C.①④⑤D.④⑤
3.下列推断正确的是( )
A.1molNa2O2与水反应,转移电子1mol
B.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同
C.钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH
D.将Na2O2加入酚酞试液中,得到红色溶液
4.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是( )
A.只含有Na+
B.一定含有Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
5.碱金属钫(Fr)具有放射性,它是碱金属元素中最重要的元素,根据碱金属元素性质的递变规律预测其性质,其中不正确的是( )
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
C.它的氢氧化物的化学式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
6.(2013·
山东省潍坊一中高三12月月考)对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法错误的是( )
A.相同温度下两种溶液的pH:
Na2CO3>
NaHCO3
B.若分别升高温度,两种溶液的pH均减小
C.若分别加入少量NaOH,两溶液中c(CO
)均增大
D.两溶液中的离子浓度均存在关系:
c(Na+)+c(H+)=c(OH-)+c(HCO
)+2c(CO
)
7.把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体测量均在标准状况下),则这3.36L气体的质量是( )
A.3.8g B.4.8g
C.5.6gD.6.0g
8.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:
2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
课堂师生互动
考点1Na2O2的化学性质
【生之思】
1.7.8gNa2O2与足量的H2O或CO2反应,转移电子的物质的量是多少?
2.2.1gCO和H2的混合气体在O2中完全燃烧,将生成物与足量的Na2O2固体充分反应,固体质量增加了多少?
3.将5.6L(标准状况)的CO2气体迅速通过一定量的Na2O2固体后得到4.48L(标准状况)气体,你能确定这4.48L气体的成分及体积吗?
【师之导】
Na2O2与CO2和H2O反应的“五大关系”
Na2O2与H2O、CO2反应的化学方程式:
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)物质的量的关系:
2CO2~O2 2H2O~O2
即无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2:
1。
(2)气体体积关系:
2CO2~O2~ΔV 2H2O~O2~ΔV
即CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量等于原混合气体体积的一半且等于生成氧气的体积。
(3)电子转移关系:
2CO2~2Na2O2~O2~2e- 2H2O~2Na2O2~O2~2e-
即当Na2O2与CO2、H2O反应时,转移的电子的物质的量与参加反应的Na2O2的物质的量相同,是生成O2的物质的量的2倍。
(4)固体质量关系:
相当于固体(Na2O2)只吸收了CO2中的“CO”、H2O中的“H2”;
可以看作发生相应的反应:
Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(实际上两反应不能发生)。
(5)反应先后顺序关系:
一定量Na2O2与一定量CO2和H2O(g)的混合物反应时,可视作Na2O2先与CO2反应,等CO2反应完成后,Na2O2再与H2O(g)发生反应。
例题1(双选题)过氧化钠可作为氧气的来源。
常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
二氧化碳
碳酸钠
转移的电子
A
1mol
NA
B
22.4L
C
106g
D
2NA
【考点过关】
1.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3D.Na2O2 NaOH Na2CO3
2.200℃时,11.6gCO2和H2O的混合气体与足量的Na2O2反应,反应后固体质量增加了3.6g,则原混合气体的平均相对分子质量为( )
A.5.8 B.11.6
C.23.2D.46.4
考点2Na2CO3和NaHCO3与酸反应情况的分析与计算
1.仅用试管和胶头滴管,你能鉴别Na2CO3溶液和稀盐酸吗?
2.往等浓度的Na2CO3和NaHCO3溶液中滴加等浓度的盐酸,哪种物质放出CO2的速率快?
3.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,哪种物质放出的CO2多?
哪种物质消耗的盐酸多?
4.标准状况下,将2.24LCO2通入100mL、1.5mol/L的NaOH溶液中充分反应,所得溶液中溶质的成分是什么?
用数形结合思想解答Na2CO3、NaHCO3与盐酸的反应。
(1)向Na2CO3溶液中逐滴加入盐酸,开始无明显现象,后有无色气体放出:
CO
+H+===HCO
、HCO
+H+===H2O+CO2↑。
(2)向盐酸中逐滴加入碳酸钠溶液,开始即有无色气体放出:
+2H+===H2O+CO2↑。
(3)Na2CO3、NaHCO3与盐酸反应的基本图像:
①向Na2CO3溶液中逐滴加入盐酸,消耗HCl的物质的量与产生CO2的物质的量的关系如图1所示;
②向NaHCO3溶液中逐滴加入盐酸,消耗HCl的物质的量与产生CO2的物质的量的关系如图2所示;
③向NaOH、Na2CO3的混合溶液中逐滴加入盐酸,消耗HCl的物质的量与产生CO2的物质的量的关系如图3所示(设NaOH、Na2CO3的物质的量之比为1:
1);
④向Na2CO3、NaHCO3的混合溶液中逐滴加入盐酸,消耗HCl的物质的量与产生CO2的物质的量的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比为1:
1)。
例题2将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·
L-1稀盐酸。
下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
3.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸
m(混合物)
9.2g
15.7g
27.6g
V(CO2)(标准状况)
2.24L
3.36L
则下列分析推理中不正确的是( )
A.根据表中数据不能计算出混合物中NaHCO3的质量分数
B.加入混合物9.2g时盐酸过量
C.盐酸的物质的量浓度为3.0mol·
L-1
D.15.7g混合物恰好与盐酸完全反应
4.将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1mol·
L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式_________________________________________________。
(2)当加入35mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)原混合物中NaOH的质量为________g,碳酸钠的质量分数为________。
学科素养提升
Na2CO3、NaHCO3的性质实验探究
Na2CO3和NaHCO3的性质是元素化合物的重要内容,特别是NaHCO3的热稳定性更是高考的常考点;
教材中通过测量Na2CO3和NaHCO3溶液的酸碱性、比较两者的热稳定性以及两者与盐酸的反应等实验详细地介绍了Na2CO3和NaHCO3性质的差异。
要求学生掌握Na2CO3和NaHCO3的鉴别方法。
而高考却将这一知识点迁移到Na2CO3和NaHCO3混合物质量分数的测定,NaHCO3与Na2O2固体混合物在密闭容器中的反应及产物的确定等内容,着重考查了学生设计实验方案及运用知识解决实际问题的能力。
教材实验
创新实验
实验装置
注意事项
①管口略向下倾斜
②实验完毕先撤去盛石灰水的试管,再撤去酒精灯
①小试管壁不与大试管壁接触
②大试管内装Na2CO3,小试管内装NaHCO3
Na2CO3受热不分解,NaHCO3受热分解,常利用这一性质采用差量法来计算二者混合物中各自的质量分数。
在化学反应中,根据质量守恒定律,反应物和生成物按一定的质量比发生反应。
若讨论固体质量的变化,可以是前后固体质量的差值,也可以是非固体物质的质量的和,将非固体物质中的比例关系合并为一个比例量,与原方程式中各种量成比例关系。
具体如下:
2NaHCO3
Na2CO3+CO2↑+H2O Δm(固)
2×
84g106g44g18g62g
其固体差量可用下列两种方法得出:
(2NaHCO3-Na2CO3)即(2×
84g-106g)
或(CO2+H2O)即(44g+18g)。
典型例题有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06gNa2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
【过关训练】
1.(2011·
北京高考)下列实验方案,能否测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数:
取ag该混合物充分加热,减重bg。
__________________________________________________________________________________________________________________________________________________________________________
2.往Na2CO3溶液和NaHCO3溶液中分别逐滴加入稀盐酸,实验现象相同吗?
反应原理相同吗?
___________________________________________________________________________________________________________________________________________________________________________
3.如何除去NaHCO3溶液中的少量Na2CO3杂质?
4.取agNa2CO3和NaHCO3的混合物与足量的稀H2SO4反应,将逸出的气体用碱石灰吸收,增重bg,该方案能否测定混合物中Na2CO3的质量分数?
5.取agNa2CO3和NaHCO3的混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得到bg固体,该方案能否测定混合物中Na2CO3的质量分数?