届高考化学综合题分类强化训练Word格式文档下载.docx
《届高考化学综合题分类强化训练Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《届高考化学综合题分类强化训练Word格式文档下载.docx(21页珍藏版)》请在冰豆网上搜索。
L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·
xAl(OH)3中的x值(写出计算过程)____。
【答案】0.41
(1)2.50mL溶液中:
n(SO42-)=n(BaSO4)=
,
2.50mL溶液中:
n(Al3+)=n(EDTA)-n(Cu2+)=0.1000mol/L×
25.00mL×
10-3L/mL-0.08000mol/L×
20.00mL×
10-3L/mL=9.000×
10-3mol,
n(Al3+)=9.000×
1mol(1−x)Al2(SO4)3·
xAl(OH)3中n(Al3+)=(2-x)mol;
n(SO42-)=3(1-x)mol;
n(Al3+):
n(SO42-)=(2-x)mol:
3(1-x)mol=9.000×
10-3mol:
00100mol,解得x=0.41。
4.碱式硫酸铝溶液可用于烟气脱硫。
室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·
xAl(OH)3]+3xCaSO4↓+3xCO2↑,生成物(1−x)Al2(SO4)3·
xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
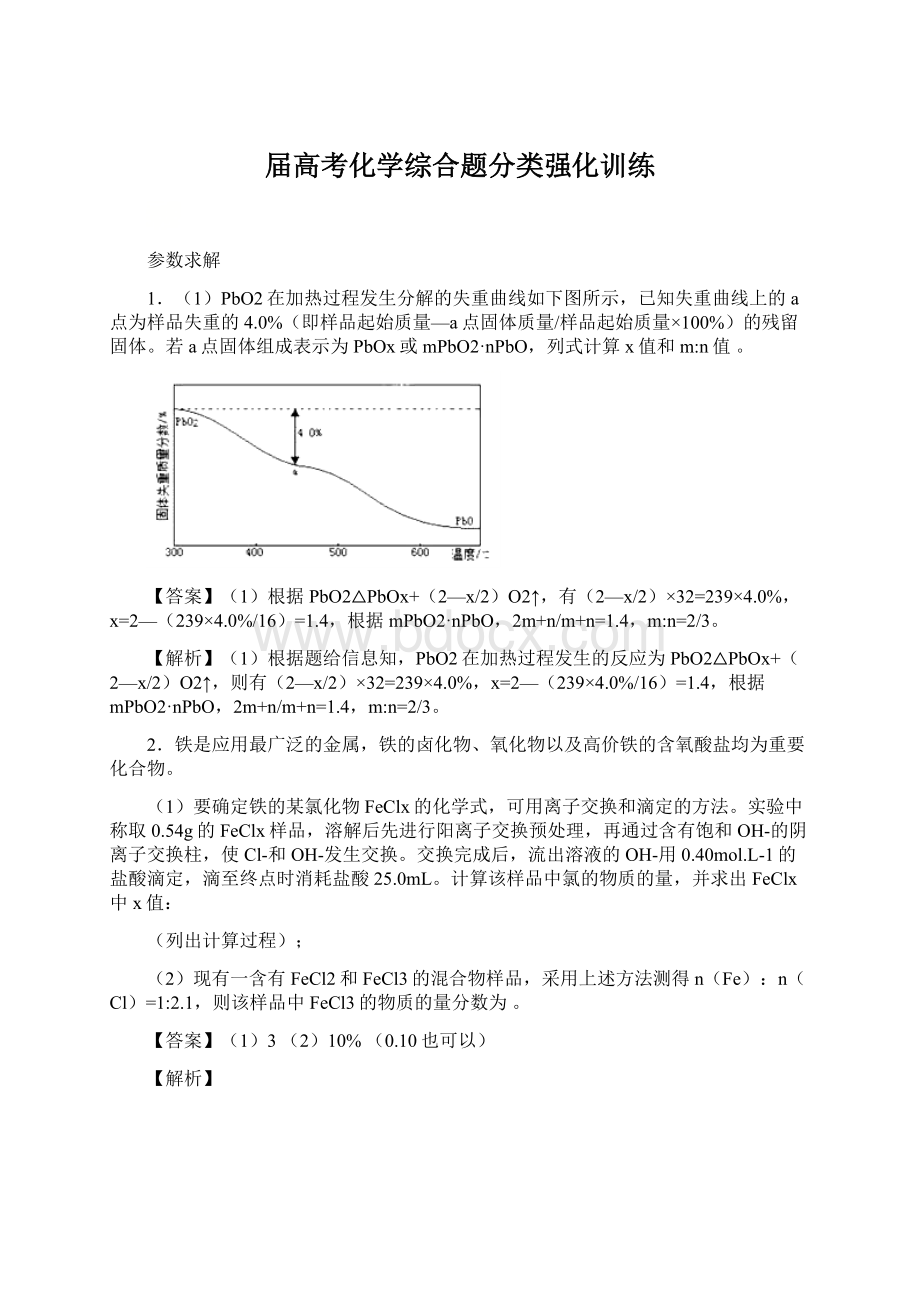
①取碱式硫酸铝溶液25.00mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300g。
②取碱式硫酸铝溶液2.50mL,稀释至25mL,加入0.1000mol·
L−1EDTA标准溶液25.00mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000mol·
L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
xAl(OH)3中的x值____(写出计算过程)。
【答案】25mL溶液中:
n(SO42−)=n(BaSO4)=
=0.0100mol;
2.5mL溶液中:
n(Al3+)=n(EDTA)−n(Cu2+)=0.1000mol·
L−1×
25.00mL×
10−3L·
mL−1−0.08000mol·
20.00mL×
10−3L·
mL−1=9.000×
10−4mol;
25mL溶液中:
n(Al3+)=9.000×
10−3mol。
1mol(1−x)Al2(SO4)3·
xAl(OH)3中n(Al3+)=(2−x)mol;
n(SO42−)=3(1−x)mol,x=0.41
(1)25mL溶液中:
n(SO42-)=n(BaSO4)=
=0.0100mol
10−4mol
10−3mol
1mol(1-x)Al2(SO4)3·
n(SO42-)=3(1-x)mol
=
,解得x=0.41。
5.[2017新课标Ⅲ]绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。
某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。
将样品装入石英玻璃管中,再次将装置A称重,记为m2g。
按下图连接好装置进行实验。
①根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
【答案】
偏小
【解析】①样品的质量是(m2-m1)g,加热后剩余固体是硫酸亚铁,质量为(m3-m1)g,生成水的质量为(m2-m3)g,
FeSO4·
xH2O
FeSO4+xH2O
15218x
(m3-m1)g(m2-m3)g
则:
,解得:
x=
;
若实验时按a、d次序操作,在加热过程中硫酸亚铁被空气氧化为硫酸铁,导致m3增加,因此x偏小。
6.碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·
xH2O。
为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;
③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·
L-1的EDTA(Na2H2Y·
2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。
通过计算确定该样品的化学式(写出计算过程)__________。
【答案】n(Cl-)=n(AgCl)×
=4.800×
10-3mol,n(Cu2+)=n(EDTA)×
=0.08000mol·
L-1×
30.00mL×
10-3L·
mL-1×
=9.600×
10-3mol,n(OH-)=2n(Cu2+)-n(Cl-)
=2×
9.600×
10-3mol-4.800×
10-3mol=1.440×
10-2mol,m(Cl-)=4.800×
10-3mol×
35.5g·
mol-1=0.1704g,m(Cu2+)=9.600×
64g·
mol-1=0.6144g,m(OH-)=1.440×
10-2mol×
17g·
mol-1=0.2448g,n(H2O)=
10-3mol,a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,化学式为Cu2(OH)3Cl·
H2O
(1)由实验②可以求出该样品中所含Cl-的物质的量,由氯离子守恒得:
n(Cl-)=n(AgCl)×
10-3mol
由实验③结合反应信息Cu2++H2Y2-
CuY2-+2H+,可以求出样品中所含Cu元素的物质的量:
n(Cu2+)=n(EDTA)×
10-3mol
再由化合物中电荷守恒得:
n(OH-)=2n(Cu2+)-n(Cl-)=2×
10-3mol=1.440×
10-2mol
分别求出这3种离子的质量,根据质量守恒,求出H2O的质量:
m(Cl-)=4.800×
10-3mol×
35.5g·
mol-1=0.1704g
m(Cu2+)=9.600×
64g·
mol-1=0.6144g
m(OH-)=1.440×
17g·
mol-1=0.2448g
再求出结晶水的物质的量:
n(H2O)=
=4.800×
最后求出各粒子的个数之比,写出化学式:
因为a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,所以该样品的化学式为Cu2(OH)3Cl·
H2O。
7.碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·
xH2O]常用作塑料阻燃剂。
(1)MgaAlb(OH)c(CO3)d·
xH2O中a、b、c、d的代数关系式为。
(2)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×
100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-):
n(CO32-)(写出计算过程)。
(1)2a+3b=c+2d
(2)
试题分析:
(1)物质中各元素的合价代数和为0,2a+3b=c+2d;
(2)根据分解图像和已知信息,得出第一段是失去结晶水,第二段是分解为氧化物;
应根据后一段计算OH-和CO32-的关系,加热时前者生成水,后者生成二氧化碳,二者的和可以根据图中的数据换算,再根据二氧化碳的质量计算出水的质量,进而得到OH-和CO32-的物质的量。
8.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌(含有Fe(Ⅱ),Mn(Ⅱ),Ni(Ⅱ)等杂质)的流程如下:
工业ZnO
浸出液
滤液
滤饼
ZnO
提示:
在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应④中产物的成分可能是ZnCO3·
xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1g.则x等于。
【答案】
(1)1
(1)根据关系式ZnCO3·
xZn(OH)2--------------(x+1)ZnO
125+99x81(x+1)
11.2g8.1g
解得:
x=1。
9.氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。
以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:
请回答下列问题:
(1)为了测定CoCl2•nH2O中结晶水数目进行如下实验:
取16.6g样品在一定条件下脱水得13.0gCoCl2,则n=__________。
【答案】2
(1)16.6g样品在一定条件下脱水得13.0gCoCl2,
,n(CoCl2)=0.10mol,n(H2O)=0.20mol,物质的量之比为1:
2,故n=2。
答案为2。
10.一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。
__________________________。
【答案】由步骤2在2.855g样品中:
160g·
mol-1×
(Fe2O3)=0.4000g,
(Fe2O3)=0.0025mol,相当于5.710g样品中含n(Fe2O3)=0.0050mol,由步骤1在5.710g样品中:
102g·
mol-1×
n(Al2O3)+160g·
n(Fe2O3)=3.350g,102g·
n(Al2O3)=3.350g-2×
0.4000g,n(Al2O3)=0.025mol,n(Al)/n(Fe)=
(1)由步骤2在2.855g样品中:
0.4000g,n(Al2O3)=0.025mol,n(Al):
n(Fe)=(2×
0.025mol):
(2×
0.005mol)=5:
1,故答案为:
5:
1。
11.CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。
以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
(1)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
【答案】Co3O4
(1)0.672L(标准状况)CO2的物质的量为0.03mol,根据C元素守恒,n(CoCO3)=n(CO2)=0.03mol;
根据Co元素守恒,n(Co)=0.03mol,m(Co)=0.03mol×
59g/mol=1.77g,则氧化物中m(O)=2.41g-1.77g=0.64g,所以n(O)=0.04mol,n(Co):
n(O)=0.03mol:
0.04mol=3:
4,故该钴氧化物的化学式为Co3O4。
12.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气。
过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。
其工业制备的主要流程如下:
(1)取上述制得的CaO2·
nH2O晶体进行热重分析,其热分解时晶体的质量随温度变化的曲线如右图。
请通过计算给出过氧化钙晶体(CaO2·
nH2O)的化学式(写出计算过程)__________________。
【答案】从图中看出:
m(CaO2)=1.08g,m(H2O)=3.24g-1.08g=2.16g,则由CaO2·
nH2O可知m(CaO2):
m(H2O)=72:
18n=1.08g:
2.16g,解得n=8,所以化学式为CaO2·
8H2O
(1)由图可知,分解前CaO2·
nH2O的质量为3.24g,分解后CaO2的质量为1.08g,最后的0.84g是CaO2加热分解放出氧气后的质量,则根据反应的方程式可知:
CaO2·
nH2O
CaO2+nH2O
72+18n72
3.241.0g
即(72+18n):
3.24=72:
1.08
解得n=8
故晶体的化学式为CaO2·
8H2O。
13.利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2,工艺流程如下:
回答下列问题
(1)ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为________________。
【答案】Zn3CO3(OH)4
(1)浓硫酸增重为分解生成水的质量,碱石灰增重为分解得到二氧化碳的质量,结合原子守恒计算碳酸根、氢氧根的物质的量,再结合电荷守恒计算Zn2+的物质的量,计算x、y、z的比例关系确定化学式。
【详解】
(1)浓硫酸增重为分解生成水的质量,水的物质的量为n(H2O)=
=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)=
=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=
×
(0.08mol+0.02mol×
2)=0.06mol,则x:
y:
z=0.06:
0.02:
0.08=3:
1:
4,故该碱式碳酸锌的化学式为:
Zn3CO3(OH)4。
14.无机研究开创绝不无“钴”的时代,例如:
CoCl2·
6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。
其中草酸钴的制备可用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·
2H2O工艺流程如下图所示:
(5)CoC2O4·
2H2O热分解质量变化过程如图2所示。
其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。
A、B、C均为纯净物;
用化学方程式表示从A点到B点的物质转化___________。
C点所示产物的化学式是___________。
(Co的相对原子质量是59)
【答案】CoC2O4=350℃=Co+2CO2Co2O3
(1)18.30g的CoC2O4·
2H2O,为0.1mol,A到B的过程质量减少3.6g,为0.2molH2O,A为CoC2O4,B到C的过程中,质量减少8.8g,只能为0.2molCO2的质量,B处的为Co单质,可以写出反应方程式,B到C在空气中加热,生成Co的氧化物,0.1mol的Co质量为5.9g,剩余2.4g为O的质量,0.15mol,则产物为Co2O3。
答案为CoC2O4
Co+2CO2,Co2O3。
15.铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:
Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。
聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
用高岭土制备碱式氯化铝的工艺流程如下:
根据流程图回答下列问题:
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·
nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);
继续向溶液中加入足量的NaOH溶液得到5.22g白色沉淀。
试通过计算确定该碱式碳酸盐的化学式________。
(写出计算过程,只有答案不给分)
【答案】Al2Mg6(OH)16CO3·
4H2O
(1)取该碱式盐9.03g溶于足量的盐酸中,收集到气体体积为336mL,该气体为CO2,336mL的CO2气体的物质的量为0.336L÷
22.4L/mol=0.015mol,故n(CO32-)=n(CO2)=0.015mol,继续向溶液中加入足量的NaOH溶液得到5.22g白色沉淀,该沉淀为Mg(OH)2,故n[Mg(OH)2]=5.22g÷
58g/mol=0.09mol,则n(Mg2+)=n[Mg(OH)2]=0.09mol,取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g,该固体为Al2O3和MgO,Al2O3的物质的量为(5.13g-0.09mol×
40g/mol)÷
102g/mol=0.015mol,则n(Al3+)=2n(Al2O3)=0.03mol,利用电荷守恒2n(Mg2+)+3n(Al3+)=n(OH-)+2n(CO32-),故n(OH-)=0.03mol×
3+0.09mol×
2-0.015mol×
2=0.24mol,故:
m(CO32-)=0.015mol×
60g·
mol-1=0.9g,m(OH-)=0.24mol×
mol-1=4.08g,m(Mg2+)=0.09mol×
24g·
mol-1=2.16g,m(Al3+)=0.03mol×
27g·
mol-1=0.81g,所以m(H2O)=9.03g-0.9g-4.08g-2.16g-0.81g=1.08g,故n(H2O)=1.08g÷
18g/mol=0.06mol,则n(Al3+):
n(Mg2+):
n(OH-):
n(CO32-):
n(H2O)=0.03:
0.09:
0.24:
0.015:
0.06=2:
6:
16:
4,该碱式碳酸盐的化学式为Al2Mg6(OH)16CO3·
4H2O,故答案为:
Al2Mg6(OH)16CO3·
4H2O。
16.钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:
(1)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
【答案】
Co3O4
(1)计算二氧化碳物质的量,根据CoCO3的化学式可以确定Co原子数目,再根据CoxOy的质量确定O原子物质的量,计算Co、O原子数目之比确定化学式。
(1)在空气中焙烧CoCO3生成CoxOy和CO2,产生CO2的物质的量为n(CO2)=1.344L÷
22.4L/mol=0.06mol,由Co、