工业流程的设计题文档格式.docx
《工业流程的设计题文档格式.docx》由会员分享,可在线阅读,更多相关《工业流程的设计题文档格式.docx(19页珍藏版)》请在冰豆网上搜索。
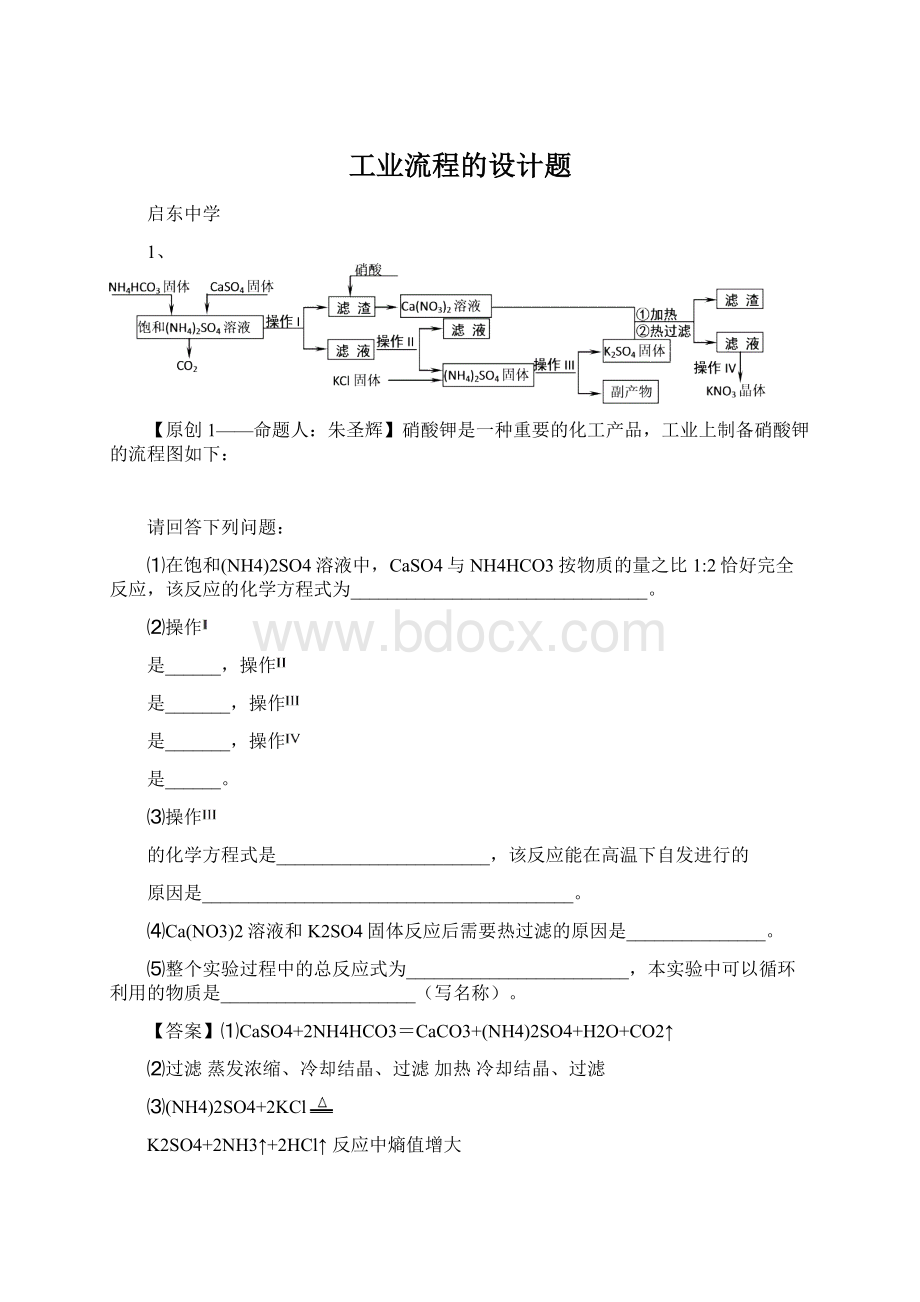
(3)、碱浸时主要反应的离子方程式为。
(4)、酸浸时反应的化学方程式为。
(5)、生成Li2CO3的化学反应方程式为。
已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应该。
[答案]
(1)Al(OH)3、CoSO4、Li2CO3
(2)隔绝空气和水分
(3)2Al+2OH-+2H2O→2AlO2-+3H2↑
(4)2LiCoO2+H2O2+3H2SO4→Li2SO4+2CoSO4+O2↑+4H2O
(5)Li2SO4+Na2CO3→Na2SO4+Li2CO3↓趁热
[陶炳春改编]2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。
(1)上述工艺回收到的产物有。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是。
(3)碱浸后的滤液中加入稀硫酸调节溶液的pH较难操作,可改用,离子方程式为
(4)酸浸时如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是,化学方程式为。
(5)生成Li2CO3的化学反应方程式为。
(3)通入足量的CO2气体AlO2-+CO2+2H2O=Al(OH)2+HCO3-
(4)有氯气生成,污染较大2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O
3、[原题]钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。
但在较高温度下,钛可与多种单质和化合物发生反应。
工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应:
TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S=57.74J/K)▲(选填:
“能”或“不能”)。
②已知:
Ti(s)+2Cl2(g)=TiCl4(l)△H=-804.2kJ/mol;
2Na(s)+Cl2(g)=2NaCl(s)△H=-882.0kJ/mol
Na(s)=Na(l)△H=2.6kJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=▲kJ/mol
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的是▲。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。
试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为:
▲。
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
,下列说法正确的是▲。
(a)该反应正反应为的△H>0
(b)在不同温度区域,Ti
I4的量保持不变
(c)在提纯过程中,I2的量不断减少
(d)在提纯过程中,I2的作用是将粗钛从低温区转移到高温区
[答案:
]
(1)①不能(2分);
②-970.2(2分);
③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(1分)
(2)①TiO2+4e-=Ti+O2-(或:
Ca2++2e-=Ca,2Ca+TiO2=2CaO+Ti)(2分)
②H2(1分)(3)d(2分)
[顾春燕改编]钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。
①沸腾氯化炉中反应的化学方程式为:
▲,试判断反应TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S=57.74J/K)▲(选填:
请写出用液态钠与四氯化钛置换出钛的热化学方程式▲
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,在阴极,被还原的Ca进一步还原TiO2获得钛,可能发生的反应或电极反应为:
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是单质,可以是 ▲ ,则阳极点击反应式为▲。
答案:
(1)①TiO2+2Cl2+2C=TiCl4+2CO(2分);
不能(2分);
②TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=-970.2kJ/mol(2分);
③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(2分)
(2)①Ca2++2e-=Ca,2Ca+TiO2=2CaO+Ti(2分)
②H2(1分);
H2+O2--2e-=H2O(1分)
4、[原题]美国科学家理查德-海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。
有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:
铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。
一种由废催化剂制取氯化钯的工艺流程如下:
(1)甲酸在反应中的作用是(选填:
“氧化剂”、“还原剂”)。
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是(写化学式)。
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为:
。
(4)700℃焙烧1的目的是:
;
550℃焙烧2的目的是:
(1)还原剂(2分)
(2)Fe(OH)3(2分)
(3)3Pd+12HCl+2HNO3=3H2PdCl4+2NO↑+4H2O(2分)
(4)除去活性炭及有机物(2分);
脱氨[将Pd(NH3)2Cl2转变为PdCl2](2分)。
[陆海峰改编]美国科学家理查德-海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。
(1)废钯催化剂经烘干后,再在700℃的高温下焙烧,焙烧过程中需通入足量空气的原因是;
甲酸还原氧化钯的化学方程式为。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件为、、。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是(写化学式)。
(4)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为:
(5)700℃焙烧1的目的是:
(1)使活性炭充分燃烧而除去(2分)
PdO+HCOOH=Pd+CO2↑+H2O(2分)
(2)80~90℃(或90℃左右)、反应时间约为8h、钯精渣与王水的质量比为1∶8
(3)Fe(OH)3
(4)3Pd+12HCl+2HNO3=3H2PdCl4+2NO↑+4H2O(2分)
(5)除去活性炭及有机物(2分);
5、[原题]氢溴酸在医药和石化工业上有广泛用途。
下图是模拟工业制备氢溴酸粗品并精制的流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)混合①中使用冰水的目的是。
(3)操作Ⅱ和操作Ⅲ的名称分别是、。
操作Ⅲ一般适用于分离____________混合物。
(选填编号)
a.固体和液体b.固体和固体c.互不相溶的液体d.互溶的液体
(4)混合②中加入Na2SO3的目的是。
(1)SO2+Br2+2H2O→2HBr+H2SO4。
(2)降低体系温度,防止溴蒸发,使反应完全。
(3)过滤、蒸馏。
d。
(4)除去粗品中未反应完的溴。
[倪汉斌改编]海水中提取溴占溴年产量的1/3,空气吹出法是用于工业规模海水提溴的常用方法。
其中一种工艺是先将海水酸化浓缩,通入某气体Z置换Br-使之成为单质,继而通入热空气和水蒸气将溴蒸气吹入吸收塔,Na2CO3饱和溶液是吸收塔中常用试剂,已知Na2CO3吸收溴蒸气是歧化反应生成两种盐,同时有能使澄清石灰水变浑浊的气体产生;
浓缩该两盐溶液,再加酸A酸化得溴水,操作B便可得液溴。
回答下列问题:
(1)海水浓缩的最低碳环保的方法是________________________
(2)Na2CO3吸收溴蒸气的反应方程式为。
(3)酸A最佳试剂是______________
(4)酸化反应的方程式是________________________;
产生1mol溴,转移电子______mol;
(已知+1价溴的化合物少见)
(5)热空气和水蒸气吹出的是溴蒸气,为什么还要用Na2CO3吸收和酸化得溴?
____________________________________________________
(6)操作B的名称是_______________。
以溴为原料制氢溴酸在医药和石化工业上有广泛用途。
(7)混合①中发生反应的化学方程式为。
(8)混合①中使用冰水的目的是。
(9)操作Ⅰ操作Ⅱ和操作Ⅲ的名称分别是、、_______。
(10)混合②中加入Na2SO3的目的是。
Na2SO3不能过量,否则副反应的离子方程式为________________________________。
(11)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。
于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为,若假设成立可观察到的现象为。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为。
(1)海水暴晒蒸发
(2)3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2
(3)H2SO4
(4)5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H205mol
(5)是为了达到浓缩的目的。
(6)蒸发浓缩
(7)SO2+Br2+2H2O→2HBr+H2SO4。
(8)降低体系温度,防止溴蒸发,使反应完全。
(9)蒸馏、过滤、蒸馏。
(10)除去粗品中未反应完的溴。
(本空2分)
(11)KSCN溶液,溶液变成血红色。
含有Br2,CCl4。
6、[原题]稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。
其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:
①有关金属离子形成氢氧化物沉淀时的pH如下表:
开始沉淀时的pH
完全沉淀时的pH
Fe3+
2.7
3.7
Y3+
6.0
8.2
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为▲。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。
则
①最好选用盐酸、▲(填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液b.氨水c.CO2气d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在▲的范围内;
检验Fe3+是否沉淀完全的操作方法是▲。
(1)Y2O3·
FeO·
2BeO·
2SiO2(2分)
(2)①b(2分)②BeO22-+4H+==Be2++2H2O(2分)
(3)3.7~6.0(2分)取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+沉淀完全(2分)
[成爱群改编]稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。
检验草酸钇沉淀是否洗涤干净的操作方法是▲。
(4)10mL0.1mol/LH2C2O4溶液与10mL0.1mol/LNaOH溶液混合后溶液显酸性,溶液中离子浓度由大到小的排列顺序是。
(3)3.7~6.0(2分)取少量滤液,测其pH值,若呈中性,则已洗净(2分)
(4)c(Na+)>
c(HC2O4—)>
c(H+)>
c(C2O42-)>
c(OH-)(2分)
7、【原题】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
软锰矿
闪锌矿
MnO2约70%,SiO2约20%,Al2O3约4%,
其余为水分
ZnS约80%,FeS、CuS、SiO2共约7%,
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
MnCO3、ZnCO3
(1)反应Ⅰ后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。
试写出反应Ⅰ中生成CuSO4的化学方程式______________________________。
(2)反应Ⅱ加入适量锌的作用是_________________。
如果锌过量,还会进一步发生反应的离子方程式为_______________________________。
(3)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为
_______________________________________________________。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要______________等原料。
【参考答案】
(1)MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O
(2)将溶液中的硫酸铜转化为铜Zn+Fe2+=Fe+Zn2+
(3)Mn2+-2e-+2H2O=MnO2+4H+
(4)Na2CO3、Zn、MnO2
【陈金春改编】
(1)流程Ⅰ所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程Ⅰ中被氧化的物质有种,完成反应Ⅰ中生成CuSO4和MnSO4的化学方程式:
MnO2+CuS+=↓++CuSO4+。
氢氧化物
Fe(OH)3
Al(OH)3
Fe(OH)2
开始沉淀pH
1.5
3.3
7.6
(2)氢氧化物开始沉淀的pH如下表:
流程Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)2沉淀的原因是
;
MnCO3和ZnCO3的作用是。
(3)反应V的条件是电解,均用惰性电极,写出电解反应方程式:
,
从整个流程看,参与循环生产的物质有(写化学式)。
(4)MnO2和Zn可按物质的量之比1:
1生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
(1)3种,MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O
(2)当Fe2+完全沉淀时碱过量得不到Al(OH)3沉淀;
调节溶液的pH使Fe3+和Al3+生成沉淀。
(3)MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4
MnO2、Zn和H2SO4
(4)1.03(或1)
8、[原题]某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
Fe2+
6.34
9.7
Fe3+
1.48
3.2
Zn2+
6.2
8.0
⑴氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:
Ksp(CuS)▲Ksp(ZnS)(选填“>”“<”或“=”)。
⑵物质A可使用下列物质中的▲。
A.KMnO4B.O2C.H2O2D.Cl2
⑶除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在▲范围之间。
⑷物质B可直接用作氮肥,则B的化学式是▲。
⑴<⑵BC
⑶3.2~6.2⑷(NH4)2SO4
[黄彩菊改编]请回答下列问题:
⑵堆浸后加入Fe粉发生的反应的离子方程式有:
,
⑶加入A物质的目的是,物质A可使用下列物质中的▲。
⑷除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在▲范围之间。
(5)加入(NH4)2CO3、氨水沉淀Zn2+时发生反应的化学方程式为
(6)物质B的化学式是▲,列举其的一种用途
[答案]⑴<⑵Fe+2H+=Fe2++H2↑Fe+Cu2+=Fe2++Cu
⑶将Fe2+氧化成Fe3+,以便除去BC(4)3.2~6.2
(5)2NH4HCO3+2ZnSO4+2NH3••H2O=2(NH4)2SO4+Zn2(OH)2CO3↓+CO2↑+H2O
(6)(NH4)2SO4氮肥
9、[原题]Ag/α-Al2O3中石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂回收实验如下图所示。
其中的转化反应为:
6AgCl+Fe2O3→3Ag2O+2FeCl3
Ag/α-Al2O3HNO3蒸馏水NaCl
(Ⅰ)
酸溶
(Ⅳ)
(Ⅲ)
沉淀
(Ⅱ)
过滤、洗涤
NOxα-Al2O3NaNO3
NaOH溶液HNO