从实验学化学教案Word格式.docx
《从实验学化学教案Word格式.docx》由会员分享,可在线阅读,更多相关《从实验学化学教案Word格式.docx(14页珍藏版)》请在冰豆网上搜索。
若二者均易溶,但溶解度受温度的影响差别较大,可用重结晶法;
还可加入某种试剂使杂质除去,然后再结晶得到主要物质。
②固体与液体混合物:
若固体不溶于液体,可用过滤法;
若固体溶于液体,可用结晶或蒸馏方法。
③液体与液体混合物:
若互不相溶,可用分液法,若互溶在一边且沸点差别较大,可用蒸馏法;
若互溶在一起且沸点差别不大,可选加某种化学试剂萃取后再蒸馏。
④气体与气体混合物:
一般用洗气法,可选用液体或固体除杂试剂。
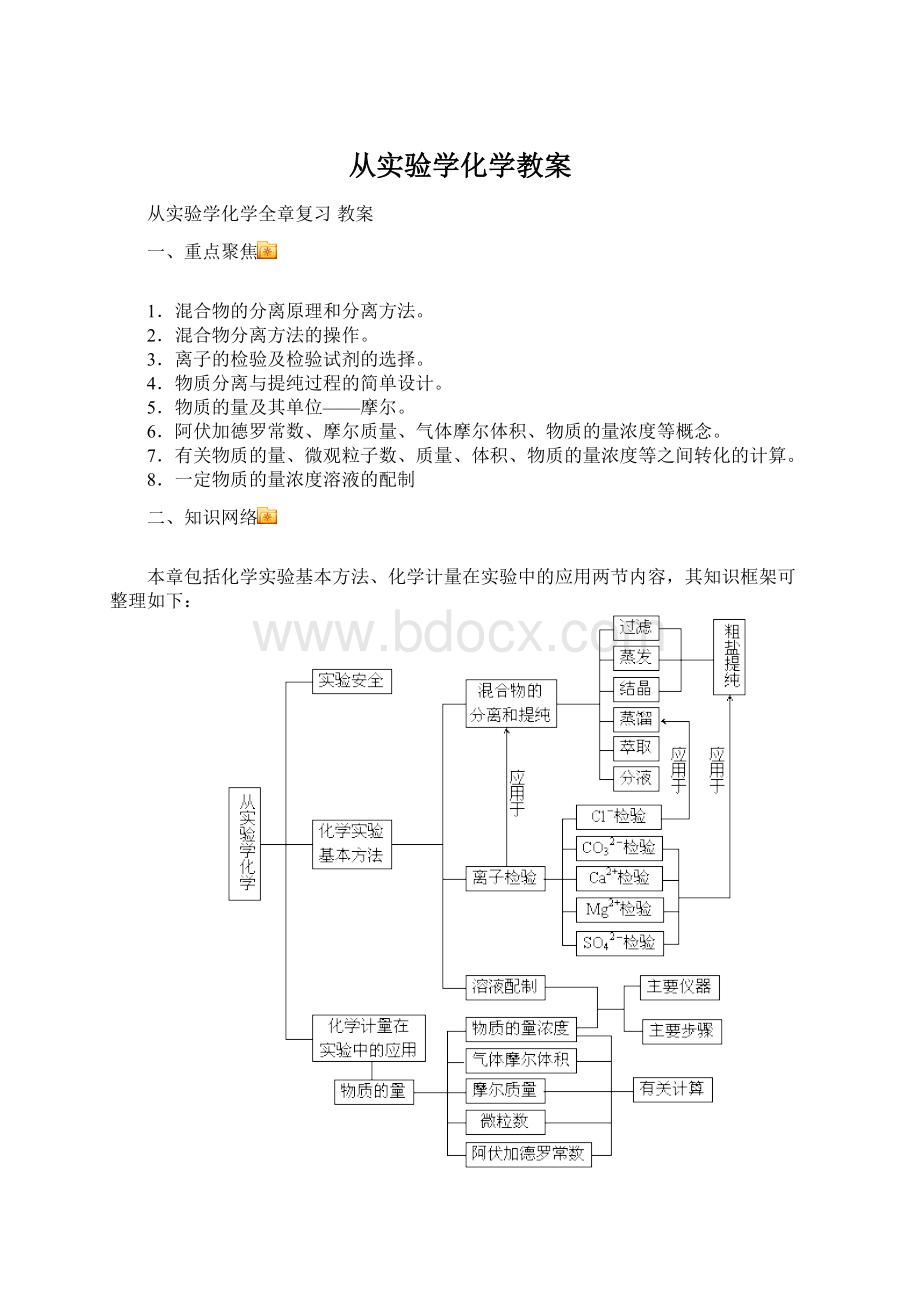
(2)几种常见的混合物的分离和提纯方法
分离和提
纯方法
分离的物质
主要仪器
应用举例
倾 析
从液体中分离密度较大且不溶的固体
烧杯、玻璃棒
分离沙和水
过 滤
从液体中分离不溶的固体
漏斗、滤纸、铁架台(带铁圈)、玻璃棒、烧杯
粗盐提纯
溶解和
过滤
分离两种固体,一种能溶于某溶剂,另一种则不溶
分离食盐和沙
离心分离法
离心试管,离心机
分离泥和水
结晶法
从溶液中分离已溶解的溶质
烧杯、玻璃棒、蒸发皿、铁架台(带铁圈)、酒精灯
从海水中提取食盐
分 液
分离两种不互溶的液体
分液漏斗、铁架台(带铁圈)、烧杯
分离油和水
萃 取
加入适当溶剂把混合物中某成分溶解及分离
用苯提取水溶液中的溴
蒸 馏
从溶液中分离溶剂和非挥发性溶质
蒸馏烧瓶、冷凝管、锥形瓶、酒精灯、石棉网、铁架台、牛角管、温度计
从海水中制取纯水
分 馏
分离两种互溶而沸点差别较大的液体
石油的分离
升 华
分离两种固体,其中只有一种可以升华
铁架台(带铁圈)、酒精灯、烧杯、圆底烧瓶
分离碘和沙
吸 附
除去混合物中的气态或固态杂质
干燥管或U形管
用活性炭除去黄糖中的有色杂质
色层分
析法
分离溶液中的溶质
层析纸及层析试剂
分离黑色墨水中不同颜色的物质
4.离子的检验
一般来讲,阳离子的检验需选择合适的阴离子,阴离子的检验需选择合适的阳离子,并要求具有特别的明显现象。
这就需要选择合适的检验试剂及其添加顺序,以避免干扰离子的干扰。
待检离子
选用试剂
反应现象
Al3+
NaOH
白色沉淀,碱过量后沉淀溶解
Fe3+
KSCN
出现血红色溶液
Ca2+
Na2CO3
HCl
白色沉淀,加盐酸后产生无色无味气体
Cl-
AgNO3
HNO3
不溶于HNO3的白色沉淀
SO42-
BaCl2或Ba(NO3)2
HCl或HNO3
不溶于强酸的白色沉淀
CO32-
CaCl2或BaCl2
白色沉淀,加酸后产生无色无味使澄清石灰水变浑浊的气体
5.化学计量之间的转化关系
(1)理解物质的量及其单位摩尔、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度等概念。
(2)以物质的量为核心的计算
(3)有关溶液稀释(稀释前后溶质守恒):
C(浓)·
V(浓)==C(稀)·
V(稀)
(4)溶质质量分数(W)与溶质的物质的量浓度(c)的转化:
(注意其中的单位换算)
6.一定物质的量浓度溶液的配制及误差分析
(1)容量瓶是配制一定物质的量浓度溶液的仪器,其常用规格有100mL、250mL、500mL、1000mL等,使用时一定要注意其规律,如500mL的容量瓶。
并且使用前一定要检查其是否漏水。
(2)配制步骤,所用仪器及注意事项
配制步骤
使用仪器
注意事项
计算
——
固体求溶质质量,液体求其体积。
称量/量取
托盘天平或滴定管
(量筒)、小烧杯
天平的精确度为0.1g,量筒的精确度为0.1mL,量筒量取液体后不需要洗涤。
溶解/稀释
溶解要在小烧杯中,切不可在容量瓶中直接溶解。
冷却
将液体恢复到室温(20℃)
转移
一定体积的容量瓶
转移时要用玻璃棒引流,以防液体溅失
洗涤
洗烧杯和玻璃棒2—3次,并将洗涤液转入容量瓶
振荡
使溶液充分混合
定容
胶头滴管
加水至刻度线1—2cm时,用胶头滴管滴加,并使视线、刻度线、凹液面相切。
摇匀
两手握住容量瓶,上下颠倒摇匀。
装瓶贴签
试剂瓶
容量瓶不能用于长期贮存溶液。
具体要做到:
移量要精确,溶解要安全,冷却要充分,洗涤要洁净,定容要准确,混合要均匀。
(3)误差分析
由公式
知,凡是溶质的物质的量减少或使溶液体积增大的操作,都会使c偏低,反之偏高。
三、方法整合
本章包括化学实验基本方法和化学计量在实验中的应用两节内容,就其主要题型有:
(1)实验安全知识及常用危险化学品的分类识别;
(2)混合物分离和提纯过程的简单设计;
(3)过滤、蒸发、萃取、分液、蒸馏等分离方法的选择根据、涉及的化学仪器及操作过程等;
(4)常见离子(SO42―、CO32―、Cl―、Ca2+等)的检验;
(5)有关物质的量、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度等概念的辩析理解;
(6)有关化学计量的简单计算;
(7)一定物质的量浓度溶液的配制等等。
无论是化学实验基本方法,还是化学计量,都贯穿于整个高中化学,所以这就要求理解准确,应用到位。
类型一:
化学实验安全
题1.下列行为中符合安全要求的是( )
A.进入煤矿井时,用火把照明
B.节日期间,在开阔的广场燃放烟火爆竹
C.用点燃的火柴在液化气钢瓶口检验是否漏气
D.实验时,将水倒入浓硫酸配制稀硫酸
思路点拨:
本题考查安全常识。
通过化学的学习,在生活实际中,要知道什么行为是安全的,什么行为是不安全的,并尽量知道这些行为为什么是不安全的,怎样处理就是安全的。
解析:
煤矿井中常含有易燃易爆的瓦斯气体,所以用火把照明显然是不安全的,A错误;
在开阔的广场燃放烟火爆竹一般是安全的,B正确;
液化气是易燃易爆气体,所以C中叙述是不安全的;
实验中将水倒入浓硫酸会因剧烈放热使液体暴沸,所以D中叙述也是不安全的。
答案:
B
总结升华:
安全意识是未来合格公民的基本素质之一,实验中掌握正确的操作方法,是减少安全事故的必要保证。
举一反三:
[变式1]一些装有化学物质的容器上常贴有危险化学品的标志。
下列标志中,应贴在装有浓硝酸的容器上的是( )
[答案]C
变式2]下列实验操作与安全事故处理错误的是( )
A.使用温度计测量烧杯中的水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶,残破的温度计插入装有硫粉的广口瓶中
B.用试管夹从试管底由下往上夹住距离管口约
处,手持试管夹长柄末端,进行加热
C.将浓硫酸放入容量瓶中,然后加水稀释制取稀硫酸
D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中
类型二:
混合物的分离和提纯
题2.电制法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42―杂质,不符合电解要求,因此必须经过精制。
某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是____________,所用玻璃仪器是________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________溶液。
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式________________。
思路点拨:
本题考查混合物的提纯中的相关问题。
包括分离方法的选择及所用仪器、除杂试剂的选择等等
解析:
(1)把泥沙等不溶性杂质与溶液分离的操作是过滤,过滤操作中所需玻璃仪器是玻璃棒、漏斗和烧杯。
(2)过入试剂甲后生成两种沉淀,分析杂质离子必然是Mg(OH)2和Fe(OH)3,所以甲为NaOH。
(3)液体F中有过量的NaOH和Na2CO3,应加入盐酸可将其除去。
(1)过滤 玻璃棒、漏斗、烧杯
(2)NaOH
(3)HCl+NaOH==NaCl+H2O Na2CO3+2HCl==2NaCl+H2O+CO2↑
看似比较大的实验题,往往问题都设在一些小的基本操作,所以做好此类题要注意两点:
其一要从宏观把握整个实验方案,其二是准确规范地表述基本操作。
[变式3]关于粗盐提纯的下列说法正确的是( )
A.溶解粗盐时,应尽量使溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩有少量液体时,停止加热利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中用大量水进行洗涤
[变式4]
(1)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO42-,依次加入的溶液为(填溶质的化学式)__________________。
[答案]
(1)溶解 过滤
(2)BaCl2[或Ba(OH)2]、K2CO3、HCl
题3.下列实验操作中错误的是( )
A.蒸馏操作时,先得到的少量液体可能会与器壁等接触而含杂质较多,可以弃掉
B.分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.萃取分液后,要得到被萃取的物质,通常还要进行蒸馏,为了更好的控制温度,用水浴加热比直接加热要好
本题考查蒸馏、分液、萃取三种基本操作,并且都是考查的细节问题,所以需要对其操作非常熟悉,才能做好此类题目。
蒸馏时,开始收集到的液体会含杂质较多,因此弃去是正确的;
分液时为了保证下层液体能够顺利流下,应使分液漏斗中内外气压相等,需要先打开上口活塞或使活塞上的小孔与上口部的小孔对准,因此B是正确的;
萃取剂要与原溶剂互不溶解,且溶质在萃取剂中溶解更大即可,密度可比水大,也可比水小,因此C是错误的;
萃取分液后,被萃取的物质仍与萃取剂溶解在一起,进一步分离的方法就是蒸馏,一般萃取剂的沸点较低,用水浴加热可以较好地控制温度。
C
总结升华:
萃取是从含少量固体或液体的溶液中富集固体或液体物质的方法,萃取剂的选择要遵循以下三个原则:
(1)与原溶剂互不相溶,
(2)与原溶质不反应,(3)溶质在其中的溶解度大于在原溶剂中的溶解度。
分液是分离互不相溶的两种液体的方法。
蒸馏是从液体混合物中分离出液体的方法,它利用了液体物质沸点的不同。
举一反:
[变式5]下列操作中不正确的是( )
A.过滤时,玻璃棒与三层滤纸的一边接触
B.过滤时,漏斗下端紧贴烧杯内壁
C.加热试管内物质时,试管底部与酒精灯灯芯接触
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
[答案]CD
[变式6]下列仪器不能用于直接加热的是( )
A.试管 B.烧杯 C.量筒 D.坩埚
[答案]BC
类型三:
物质的检验
题4.有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、H2SO4、BaCl2中的某一种,为确定各是何种溶液,进行以下实验:
(1)A+B→溶液+气体;
(2)C+D→溶液+沉淀;
(3)B+D→溶液+沉淀(X);
(4)A+D→溶液(Y)+沉淀;
(5)沉淀(X)+溶液(Y)→溶液+气体。
由以上实验可知A为________,B为________,C为________,D为________。
请写出有关的化学方程式:
(1)___________________________
(2)_________________________ (3)________________________
(4)_________________________ (5)________________________
本题考查物质的检验,涉及到CO32―、SO42―与Ba2+分别产生Ba2CO3、BaSO4的白色沉淀,而BaCO3可溶于强酸产生气体CO2,BaSO4则不能。
据此我们即可将四种溶液检验出来。
由
(2)(3)(4)分析可知,A、B、C都能与D反应产生沉淀,所以D为BaCl2溶液;
而由(5)可知沉淀X为BaCO3,溶液Y为一种酸,由此产生沉淀X的(3)中B为Na2CO3,产生溶液Y的(4)中A为H2SO4,因此C为Na2SO4。
H2SO4 Na2CO3 Na2SO4 BaCl2
(1)H2SO4+Na2CO3==Na2SO4+CO2↑+H2O
(2)Na2SO4+BaCl2==BaSO4↓+2NaCl
(3)Na2CO3+BaCl2==BaCO3↓+2NaCl (4)H2SO4+BaCl2==BaSO4↓+2HCl
(5)BaCO3+2HCl==BaCl2+CO2↑+H2O
解答此类题要善于分析给出物质间的反应,然后对比实验的代号,使其找到一一对应关系。
善于抓特殊现象、特殊反应等突破口,是迅速解题的关键,但一定不要忙燥,要一一验证清楚,再按题目要求一一作答。
举一反三:
[变式7]下列各组物质仅用蒸馏水不能鉴别出来的是( )
A.苯、酒精、四氯化碳
B.食盐、烧碱、硝酸铵
C.蔗糖、硫酸铜粉末、碳酸钙粉末
D.氧化铜、二氧化锰、活性炭
[答案]D
[变式8]有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。
为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。
表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。
试回答下面问题。
A
B
C
D
E
F
G
—
↓
(1)A的化学式是________,G的化学式是________。
判断理由是______________________。
(2)写出其余几种物质的化学式。
B:
________,C:
________,D:
________,E:
________。
F:
[答案]
(1)KCl AgNO3 混合时只生成一种沉淀的KCl,生成的沉淀是AgCl,所以A是KCl,G是AgNO3
(2)Na2SO4 MgCl2 Na2CO3 Ca(NO3)2 Ba(OH)2
类型四:
化学计量之间的关系
题5.下列说法正确的是( )
A.物质的量是物质所含微粒的数量
B.阿伏加德罗常数是人们规定的数,没有单位
C.H2的摩尔质量等于NA个H2的质量之和
D.标准状况下,H2的摩尔体积为22.4L·
mol-1
思路点拨:
本题考查物质的量、阿伏加德罗常数、摩尔质量、气体摩尔体积四个概念的理解,除对相关概念要深刻理解外,还应特别注意其单位。
物质的量是一个物质量,表示含有一定数目粒子的集合体,其单位为摩尔,A错误;
阿伏加德罗常数是人们规定12g12C中含有的碳原子数,其单位为mol―1,B错误;
单位物质的量的物质所具有的质量,其单位为g·
mol―1,H2的质量单位一般用g,C错误;
单位物质的量的气体所占的体积叫做气体摩尔体积,单位为L·
mol―1,在标准状况下Vm=22.4L·
mol―1,D正确。
答案:
D
对于概念的理解,应抓住处延,认真分析其内涵,要善于辩析概念。
[变式9](2011北京四中模拟)在下列条件下,两种气体的分子数一定相等的是
A.同温度、同体积的N2和O2 B.同压强、同体积的H2和CH4
C.同质量、不同密度的N2和CO D.同体积、同密度的CO2和N2
[答案]C
[变式10]下列叙述错误的是( )
A.0.012kg的12C所含的原子数为6.02×
1023
B.1molH2O中含有2molH和1molO
C.2molNaOH溶于1L水中配成溶液的浓度为2mol·
l―1
D.1L2mol·
L―1NaOH溶液中含有NaOH2mol
[答案]C
题6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.2gH2所含的原子数目为NA
B.标准状况下,22.4L水中含有水分子数为NA
C.常温下,1L0.1mol·
L―1的MgCl2溶液中含有的Cl―数为0.2NA
D.常温常压下,11.2LCH4中含有的氢原子数为2NA
本题借助阿伏加德罗常数考查以物质的量为核心的计算。
要特别注意气体摩尔体积适应的条件和状态。
2gH2的物质的量为1mol,1molH2中含有的原子数为2NA,A错误;
标准状况下,水为液态,22.4L水不是1mol,所含分子数也就不是NA,B错误;
1L0.1mol·
L―1的MgCl2溶液中含n(MgCl2)=1L×
0.1mol·
L―1=0.1mol,
含Cl―的物质的量n(Cl―)=0.1mol×
2=0.2mol,C正确;
常温常压下11.2LCH4不是0.5mol,所以所含H原子的物质的量不是2mol,D错误。
此类题的解决一定要以物质的量为核心,其解题基本模式为:
题中条件
某粒子的物质的量n
某粒子的粒子数nNA。
其中要注意由n到nNA过程中的粒子变化;
另外一定特别注意22.4L某个倍数时,粒子物质的量一定要遵循气体摩尔体积的适用条件和范围。
[变式11]下列说法中不正确的是( )
A.磷酸的摩尔质量与6.02×
1023个磷酸分子的质量在数值上相等
B.6.02×
1023个氮气分子和6.02×
1023个氢气分子的质量之比等于14∶1
C.32g氧气所含的原子数目为2×
6.02×
D.常温常压下,0.5×
1023个一氧化碳分子所占的体积为11.2L
[答案]A、D
[变式12]相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1∶1
②它们所含的氧原子数目之比为1∶2
③它们所含的原子总数目之比为2∶3
④它们所含的碳原子数目之比为1∶1
A.①和④ B.②和③ C.③和④ D.①②③④
[答案]D
题7.标准状况下,1L水可溶解700L氨气,所得氨水密度为0.9g/mL,求氨水的物质的量浓度。
本题考查全体溶于水后物质的量浓度的计算。
首先求气体溶质的物质的量:
,然后再由
,其中
。
氨气的物质的量:
,溶液的体积:
,所以
18.4mol·
L-1
抓住定义表达式,准确理解各物理量的含义,同时化学计算中一定要带单位运算。
类型五:
一定物质的量浓度溶液的配制
题8.用18mol/L的硫酸溶液配制500mL1mol/L的硫酸溶液,有下列操作步骤:
(1)将溶解后的硫酸溶液立即沿玻璃棒转入容量瓶中;
(2)将量得浓硫酸倒入烧杯中,加水溶解,然后用蒸馏水洗涤量筒2~3次倒入烧杯中;
(3)盖上瓶塞,轻轻摇匀即配制完毕。
(4)洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中,加水至离刻度1~2cm处,改用胶头滴管加水至刻度线;
(5)用量筒量取27.78mL的浓硫酸。
先将以上步骤按实际操作的先后顺序排列,________________指出操作中所有