高考化学二轮复习物质结构与性质学案全国通用4Word文件下载.docx
《高考化学二轮复习物质结构与性质学案全国通用4Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学二轮复习物质结构与性质学案全国通用4Word文件下载.docx(31页珍藏版)》请在冰豆网上搜索。
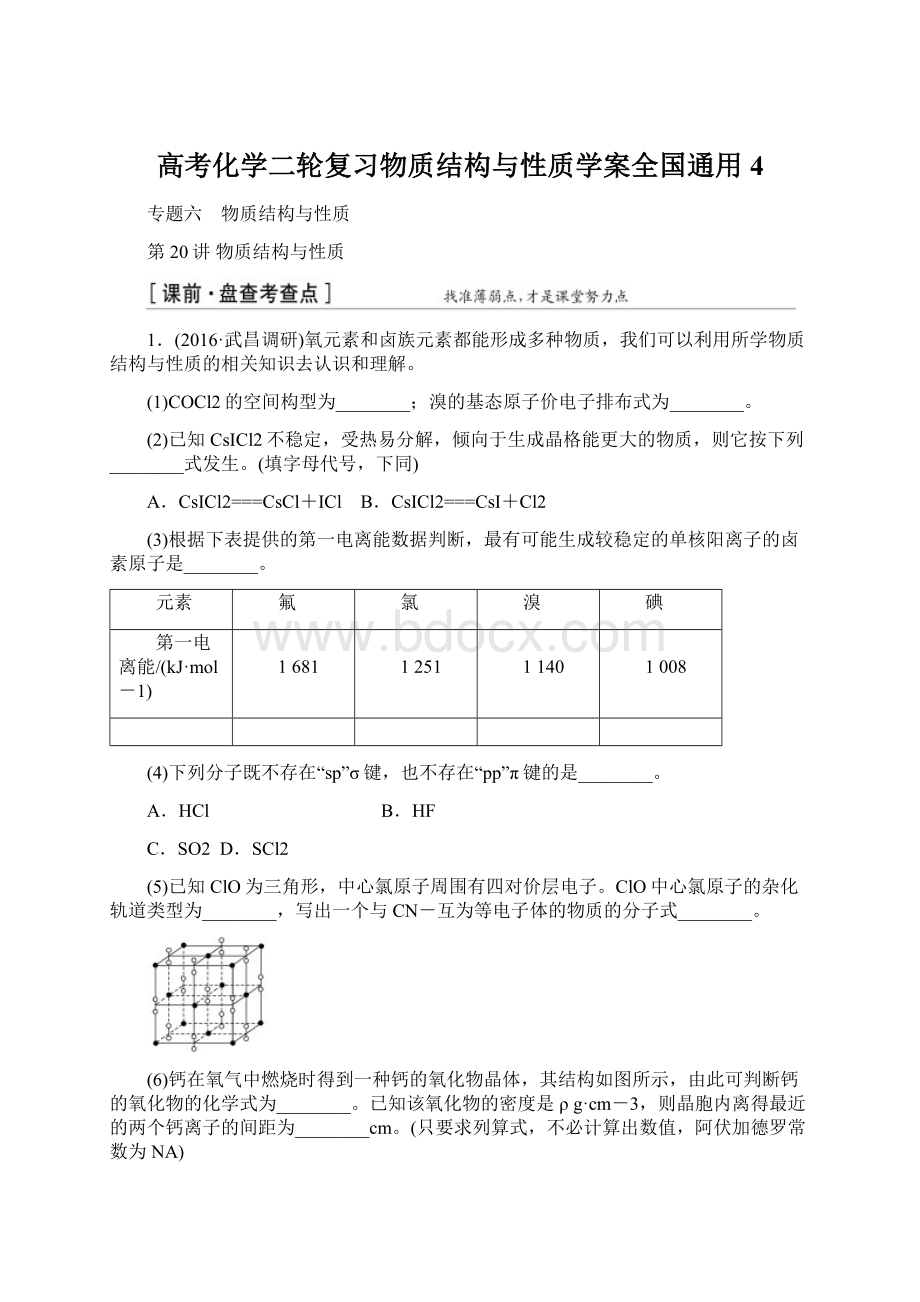
(3)第一电离能越小,越容易形成较稳定的单核阳离子,故最有可能生成较稳定的单核阳离子的卤素原子为碘(或I);
(4)HCl、HF分子中均存在“s�p”σ键,SO2中存在“p�p”π键,SCl2存在“p�p”σ键,故D项符合题意。
(6)由图可知晶胞中含有Ca2+个数为8×
+6×
=4个,O个数为12×
+1=4个,故钙的氧化物的化学式为CaO2;
设晶胞内离得最近的两个钙离子的间距为xcm,则晶胞的边长为xcm,
=,(x)3=,x=。
答案:
(1)平面三角形 4s24p5
(2)A (3)碘(或I) (4)D (5)sp3杂化 N2(或CO)
(6)CaO2 ×
2.第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。
基态Cr原子中,电子占据最高能层的符号为________,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?
________(填“是”或“否”),原因是______________________________________________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶胞结构如图所示(白色球代表As原子)。
在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
(4)与As同主族的短周期元素是N、P。
AsH3中心原子的杂化类型为________;
一定压强下将AsH3、NH3和PH3的混合气体降温时首先液化的是________,理由是______________________________________。
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;
设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为________g·
cm-3。
(用含a和NA的式子表示)
(1)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,则最高能层为N,该能层具有4s4p4d4f轨道,轨道数为16,电子数为1。
(5)由图可得晶胞中含有Fe的个数为8×
=4个,含有N的个数为1个,则氮化铁的化学式为Fe4N;
a3ρ==,故ρ=。
(1)N 16 1
(2)否 30Zn的4s能级有2个电子,处于全满状态,较稳定 (3)4 正四面体 (4)sp3 NH3 NH3分子之间有氢键,沸点较高 (5)Fe4N
3.(2016·
佛山模拟)有些食物中铁元素含量非常丰富,其中非血红素铁是其存在形式之一,主要是三价铁与蛋白质和羧酸结合成络合物。
(1)Fe3+的电子排布式为____________________。
(2)配合物Fe(CO)5的配位体是________;
常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂,熔点为251K,沸点为376K,据此,可判断Fe(CO)5晶体属于________晶体。
(填“离子”、“原子”、“分子”或“金属”)
(3)金属晶体可看成金属原子在三维空间中堆积而成,单质铁中铁原子采用钾型模式堆积,原子空间利用率为68%,铁原子的配位数为______________。
(4)乙醛能被氧化剂氧化为乙酸,乙醛中碳原子的轨道杂化类型是______________;
1mol乙醛分子中含有的σ键的数目为____________________。
(5)FeO晶体结构如图所示,FeO晶体中Fe2+的配位数为________。
若该晶胞边长为bcm,则该晶体的密度为________g·
(1)Fe的原子序数为26,核外电子排布式为1s22s22p63s23p63d64s2,故Fe3+的电子排布式为1s22s22p63s23p63d5或[Ar]3d5。
(2)Fe(CO)5的配位体为CO,Fe(CO)5的熔沸点低,易溶于非极性溶剂,故其为分子晶体。
(3)钾型堆积为体心立方堆积,故Fe的配位数为8。
(4)CH3CHO中甲基碳原子为sp3杂化,而醛基碳原子为sp2杂化。
CH3CHO的结构式为
单键为σ键,1个双键中含1个σ键、1个π键,故1molCH3CHO中含有6molσ键。
(5)该晶胞中Fe2+周围最近等距离的O2-有6个,则Fe2+的配位数为6。
该晶胞中含有4个Fe2+、4个O2-,则晶体密度为=g·
(1)1s22s22p63s23p63d5或[Ar]3d5
(2)CO 分子 (3)8 (4)sp2、sp3 6×
6.02×
1023或6NA (5)6
4.(2016·
太原模拟)前四周期元素A、B、C、D、E的原子序数依次增大,A的最简单气态氢化物分子中含5个原子和10个电子;
基态B原子有3个未成对电子,在短周期元素中C的第一电离能最小,D的最高价氧化物对应的水化物是二元强酸。
E+核外3个电子层均排满电子。
回答下列问题:
(1)基态E原子的外围电子排布图为____________。
(2)1mol(AB)2中含σ键数目为________________;
在A、B、D的含氧酸根离子中,呈平面三角形结构的是____________(填离子符号)。
(3)在A、B、D的气态氢化物中,属于极性分子的是____________;
CB3的晶体类型是________________,它的阴离子的等电子体分子有______________(填一种)。
(4)B、E两种元素形成某种化合物的晶胞结构如图(白色球代表B原子)。
已知B、E的原子半径分别为apm、bpm。
在该晶胞中,B原子的配位数为________。
该晶胞的空间利用率φ为____________________________。
含5个原子、10个电子的分子是CH4,则A为碳元素;
基态N原子有3个未成对电子,B为氮元素。
短周期元素中钠元素的第一电离能最小,C为钠元素。
硫酸是强酸,又是二元酸,D为硫元素,3个电子层排满电子,依次为2、8、18,所以E的原子序数为29,E为铜元素。
(1)基态铜原子的外围电子排布图为
(2)1个NCCN分子中含3个σ键,1mol(CN)2中含σ键数目为3NA;
C、N、S的含氧酸根离子分别为CO、NO、NO、SO、SO等,其中中心原子价层电子对数为3、成键电子对数为3的有CO、NO,二者均呈平面三角形。
(3)CH4、NH3、H2S分子中,极性分子有NH3、H2S。
NaN3是离子晶体,与N互为等电子体的分子有CO2、N2O。
(4)该晶胞由氮、铜原子构成,从图看出,N原子的配位数为6。
1个晶胞中,氮原子个数为8×
=1,铜原子个数:
12×
=3,它的化学式为Cu3N。
观察晶胞知,设晶胞边长为L,L=2(a+b)pm。
该晶胞的空间利用率φ=×
100%=×
100%。
(1)
(2)3NA CO、NO
(3)NH3、H2S 离子晶体 CO2(或N2O)
(4)6 ×
100%
5.(2016·
开封一模)T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
相关信息
T
T元素可形成自然界硬度最大的单质
W
W与T同周期,核外有一个未成对电子
X
X原子的第一电离能至第四电离能分别是:
I1=578kJ·
mol-1,I2=1817kJ·
mol-1,I3=2745kJ·
mol-1,I4=11575kJ·
mol-1
Y
常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质
Z
Z的一种同位素的质量数为63,中子数为34
(1)TY2是一种常用的溶剂,是________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
W的最简单氢化物容易液化,理由是______________________。
(2)在25℃、101kPa下,已知13.5g的X固体单质在O2中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为_____________________________________。
(3)基态Y原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______、电子数为________。
Y、氧、W元素的电负性由大到小的顺序为________(写元素符号)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g·
cm-3,则晶胞边长为________________(用含立方根的式子表示);
ZYO4常作电镀液,其中YO的空间构型是______________,其中Y原子的杂化轨道类型是______。
Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:
Z+HCl+O2===ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。
下列说法或表示正确的是________。
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1molZ参加反应有1mol电子发生转移
由题目提供的信息可推得T、W、X、Y和Z分别为C、F、Al、S和Cu。
(1)CS2的结构式为S===C===S左右对称,为非极性分子,分子中存在两个σ键,两个π键,因为H、F之间易形成氢键,故HF的熔、沸点高,易液化。
(2)n(Al)==0.5mol放出419kJ,则4Al(s)+3O2(g)===2Al2O3(s)ΔH=-419×
8=-3352kJ·
mol-1。
(3)硫原子的核外电子排布图为
故最高能层符号为M,该能层具有的原子轨道数为9,电子数为6;
因同周期从左到右,主族元素的电负性逐渐增强,同主族从上到下,电负性逐渐减弱,故S、O、F元素的电负性由大到小的顺序为F>
O>
S。
(4)由图可知Cu的晶胞为面心立方最密堆积,则每个晶胞含有4个Cu原子,设晶胞边长为x,则x3×
9.00g·
cm-3=,故x=×
10-8cm。
(1)非极性分子 2 分子间形成氢键
(2)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-3352kJ·
mol-1 (3)M 9 6 F>
S (4)×
10-8cm 正四面体形 sp3 AD
6.(2016·
重庆二模)某复合硅酸盐水泥的成分有CaO、MgO、Al2O3、SO3和SiO2等。
(1)Ca的电子排布式为________。
(2)MgO的熔点比CaO的熔点________,其原因是______________________________。
(3)Al2O3溶于NaOH溶液形成Na[Al(OH)4],[Al(OH)4]-的空间构型为________。
(4)S的氧化物的水化物中酸性最强的是________,从结构上分析其原因________________________________________________________________________。
(5)硅酸盐结构中的基本结构单元为[SiO]四面体,其中Si原子的杂化轨道类型为____________。
由两个结构单元通过共用一个原子形成的硅酸盐阴离子的化学式为________。
(6)CaO与NaCl的晶胞类型相同,CaO晶胞中Ca2+的配位数为________,若CaO晶胞参数为anm,CaO的密度为________g·
cm-3(用a和NA表示)。
(6)根据NaCl晶胞中Na+、Cl-的配位数为6,可以类推CaO晶胞中Ca2+、O2-的配位数为6。
该晶胞中含有4个Ca2+、4个O2-,CaO的密度为g÷
(a×
10-7cm)3=g·
(1)1s22s22p63s23p64s2
(2)高 Mg2+的半径小于Ca2+的半径,MgO晶格能大,故其熔点高 (3)正四面体形 (4)H2SO4 H2SO4中S的正电荷高于H2SO3中S的正电荷,导致H2SO4的S—O—H中O的电子向S偏移程度更大,更容易电离出H+,所以H2SO4的酸性强 (5)sp3 [Si2O7]6- (6)6
7.(2016·
福州五校联考)铁基超导、C60K3、YBCO、钙氢合金都是超导材料,回答下列问题。
(1)Fe3+中未成对电子数为________;
Fe2+基态时核外电子排布式为________________________________________________________________________。
(2)C60分子(结构如图)中碳原子杂化轨道类型为________;
1molC60分子中含σ键数目为________。
(3)已知C60晶体为面心立方,C60K3中C则为体心立方,K+填在空隙中,有关C60的说法正确的有______。
a.C60晶体易溶于CS2
b.C60晶体中,与每个C60分子紧邻的C60分子有12个
c.C60K3晶胞中,内部空隙中填有6个K+
d.C60K3晶体熔融时不导电
(4)YBCO是一种高温超导材料,最早是通过在1000~1300K加热BaCO3、Y2(CO3)3、CuCO3的混合物制备的。
若YBa2Cu3O7-x(0≤x≤0.5)的材料在Tc温度下有超导性,当x=0.2时,晶体中n(Cu3+)∶n(Cu2+)=________。
(5)目前已合成的Ca(大球)与H(小球)形成的超导材料其晶胞结构如图,它的化学式为____________。
假定晶胞边长为anm,则晶体的密度为________g·
(2)C60分子中每个碳原子与另3个碳原子形成共价键,其中含1个双键和2个单键;
1个C60分子中总键数为:
60×
3/2=90,故σ键数目也为90。
(3)由于C60是非极性分子,CS2也是非极性分子,a正确;
面心立方的配位数为12,b正确;
由于C60K3中C为体心立方,晶胞中C有2个,依据化学式晶胞中应有K+6个,c正确;
C60K3是离子化合物,熔融时可以导电,d错误。
(4)先确定Y、Ba、O的化合价分别为+3、+2、-2,设Cu3+为y,则Cu2+为3-y,由化合物中各元素化合价代数和等于零即得。
(5)晶胞中共含Ca原子数为8×
+1=2;
氢原子全部位于面上,共有4×
6×
=12个,故该超导材料的化学式为CaH6;
该晶胞的密度ρ=g·
cm-3=g·
(1)5 1s22s22p63s23p63d6或[Ar]3d6
(2)sp2 90NA (3)abc (4)1∶4 (5)CaH6
考点一 原子结构与性质
考点定位
重要保分考点
错因定位
1.书写基态原子或离子的电子排布式或排布图时,不会利用能量最低原理、泡利原理及洪特规则进行检验和正误判断,如[诊断卷T3
(1)、T4
(1)、T6
(1)]。
2.比较第一电离能和电负性的相对大小时,不会利用同周期、同主族元素性质的递变规律判断,特别注意当元素原子的核外电子排布在能量相等的轨道上形成全空、半满和全满结构时,原子的能量较低,该元素具有较大的第一电离能,如[诊断卷T2
(2)、T5(3)]。
1.练中回扣原子结构与性质的基本点
(1)原子序数为24的元素原子的基态原子
①核外电子排布式为________________,价电子排布式是____________。
②有________个电子层,________个能级;
有________个未成对电子。
③在周期表中的位置是第________周期第________族。
(2)试用“>
”“<
”或“=”表示元素C、N、O、Si的下列关系:
①第一电离能:
____________(用元素符号表示,下同)。
②电负性:
________________。
③非金属性:
(1)①1s22s22p63s23p63d54s1或[Ar]3d54s1 3d54s1 ②4 7 6 ③四 ⅥB
(2)①N>
C>
Si ②O>
N>
Si
③O>
2.归纳原子结构与性质的相关知识,记住特殊命题点
(1)基态原子核外电子排布的四种表示方法
表示方法
举例
电子排布式
Cr:
1s22s22p63s23p63d54s1
简化表示式
Cu:
[Ar]3d104s1
价电子排布式
Fe:
3d64s2
电子排布图
(或轨道表示式)
(2)常见错误防范
①电子排布式
a.3d、4s书写顺序混乱。
如
b.违背洪特规则特例。
②电子排布图
错误类型
错因剖析
违背能量最低原理
违背泡利原理
违背洪特规则
(3)特殊原子的核外电子排布式
①24Cr的核外电子排布
先按能量从低到高排列:
1s22s22p63s23p64s23d4,因3d5为半充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得1s22s22p63s23p64s13d5,再将同一能层的排到一起,得该原子的电子排布式:
1s22s22p63s23p63d54s1。
②29Cu的核外电子排布
1s22s22p63s23p64s23d9,因3d10为全充满状态,比较稳定,故需要将4s轨道的一个电子调整到3d轨道,得1s22s22p63s23p64s13d10,再将同一能层的排到一起,得该原子的电子排布式:
1s22s22p63s23p63d104s1。
(4)电离能与电负性变化规律与大小判断
①元素第一电离能的周期性变化规律
一般规律
同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势,稀有气体元素的第一电离能最大,碱金属元素的第一电离能最小。
同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。
特殊情况
第一电离能的变化与元素原子的核外电子排布有关。
通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。
②电离能、电负性大小判断
规律
在周期表中,电离能、电负性从左到右逐渐增大,从上往下逐渐减小
特性
同周期主族元素,第ⅡA族(ns2)全充满、ⅤA族(np3)半充满,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素
方法
我们常常应用化合价及物质类别判断电负性的大小,如O与Cl的电负性比较:
a.HClO中Cl为+1价、O为-2价,可知O的电负性大于Cl:
b.Al2O3是离子化合物、AlCl3是共价化合物,可知O的电负性大于Cl
(5)元素电离能的两大应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;
反之越弱。
②判断元素的化合价
如果某元素的In+1≫In,则该元素的常见化合价为+n,如钠元素I2≫I1,所以钠元素的化合价为+1。
(6)电负性的三大应用
考向一 原子核外电子的排布
1.填写下列空白:
(1)(2016·
全国丙卷)写出基态As原子的核外电子排布式________。
(2)(2016·
全国甲卷)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________。
(3)(2015·
全国卷Ⅰ)碳及其化合物广泛存在于自然界中。
处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。
在基态14C原子中,核外存在________对自旋相反的电子。
(4)(2015·
江苏高考)Cr3+基态核外电子排布式为____________。
(5)(2015·
浙江高考)Cu2+的电子排布式是________。
(6)(2015·
四川高考)Si元素基态原子的电子排布式是________。
(7)(2015·
安徽高考)N的基态原子核外电子排布式为________,Cu的基态原子最外层有________个电子。
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
(2)1s22s22p63s23p63d84s2或[Ar]3d84s2 2
(3)电子云 2
(4)1s22s22p63s23p63d3或[Ar]3d3
(5)1s22s22p63s23p63d9或[Ar]3d9
(6)1s22s22p63s23p2或[Ne]3s23p2
(7)1s22s22p3 1
考向二 元素的性质
2.填写下列空白:
全国丙卷)根据元素周期律,原子半径Ga____As,第一电离能Ga____As。
(填“>
”或“<
”)
全国乙卷)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。
Zn、Ge、O电负性由大至小的顺序是________。
全国卷Ⅱ)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;
C、D为同周期元素,C核外电子总数是最外层电子数的3倍;
D元素最外层有一个未成对电子。
则四种元素中电负性最大的是________(填元素符号)。
福建高考)CH4和CO2所含的三种元素电负性从小到大的顺序为________。
安徽高考)原子半径Al____Si,电负性:
N____O。
(用“>
(6)(2014·
安徽高考)第一电离能Si____S。
(7)(2013·
新课标卷Ⅱ)F、K、Fe、Ni四种元素中第一电离能最小的是________,电负性最大的是________。
(填