电化学测量技术实验报告Word下载.docx
《电化学测量技术实验报告Word下载.docx》由会员分享,可在线阅读,更多相关《电化学测量技术实验报告Word下载.docx(18页珍藏版)》请在冰豆网上搜索。
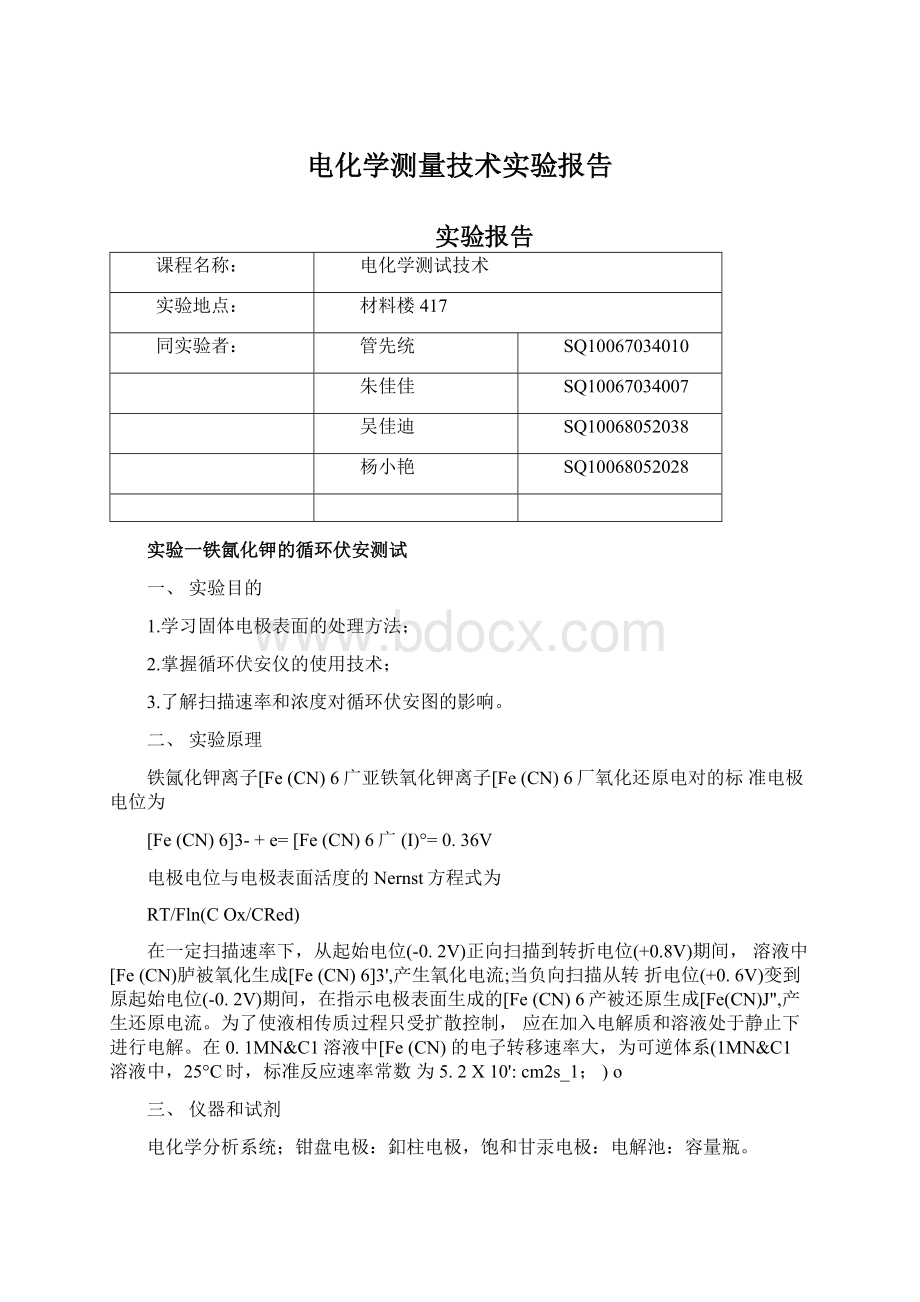
C时,标准反应速率常数为5.2X10'
:
cm2s_1;
)o
三、仪器和试剂
电化学分析系统;
钳盘电极:
釦柱电极,饱和甘汞电极:
电解池:
容量瓶。
0.50mol・L_1K3[Fe(CN)J;
0.oOmol・I?
K;
[Fe(CN)6];
1mol・I?
NaCl
四、实验步骤
1.指示电极的预处理
钳电极用A1O粉末(粒径0.05Mm)将电极表面抛光,然后用蒸镭水清洗。
2.支持电解质的循环伏安图
在电解池中放入0.1mol・I?
NaCl溶液,插入电极,以新处理的钮电极为指示电极,钳丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定;
起始电位为-0.2V:
终止电位为+0.6V。
开始循环伏安扫描,记录循环伏安图。
3.不同扫描速率&
[Fe(CN)6]溶液的循环伏安图
在0.50mol•L_1K,[Fe(CN)6]溶液中,以10mV/s、25mV/s、50mV/s>
100mV/s>
200mV/s、500mV/s,在-0.15至+0.7V电位范围内扫描,分别记录循环伏安图。
五、注意事项
1.实验前电极表面要处理干净。
2.扫描过程保持溶液静止。
六、数据处理
分别以订、认对v作图,说明峰电流与扫描速率间的关系。
VEUOJUnu
Potential/V(vs.SCE)图1玻碳电极在0.50mol-L-'
K4[Fe(CN)6]溶液中在10mVs'
1下的循环伏安曲线
由图1可知,K4[Fe(CN)6]在玻碳电极上发生氧化还原反应,氧化峰电位是Epa=295mV,峰电流是ipa=58.8mAo还原峰电位为166mV,还原峰峰电流为54.6mA。
峰电流的比值为:
ipa/ipc=1.07ul,峰电位差为129mV。
由此可知,铁亂化钾体系[Fe(CN)63-/4-]在中性水溶液中的电化学反应是一个较可逆过程
<
E^SL30
图2玻碳电极在0.50moIL-1K4[Fe(CN)6]溶液中不同扫速下的循环伏安曲线
v1/2/(mvs-1)v2
七实验图3玻碳电极在0.50molL'
1K4[Fe(CN)(>
]溶液中峰电流与扫速根
方的线性拟合
结论
对于表面吸附控制的电极反应过程,峰电流ip与扫描速度呈正比关系,即ip〜V为一直线。
(此关系也可利用标准曲线法的线性拟合功能,以峰电流为横坐标,扫描速度的二分之一次方或扫描速度为纵坐标,考察线性关系)v将不同扫描速率的循环伏安曲线进行叠加。
随着扫描速度的增加,峰电流也增加。
且分别测量他们的峰数据可以得到峰电流与扫描速度的关系。
根据电化学理论,对于扩散控制的电极过程,峰电流ip与扫描速度的二分之一次方呈正比关系。
用标准曲线法中的线性拟合处理,得出峰电流ip与仮呈线性关系,R为扫描速度。
在误差的范用内K3[Fe(CN)6]在KC1溶液中电极过程的具有可逆性。
对于可逆体系,氧化峰电流订与还原峰电流认绝对值的比值:
从图中可以
看出来随着扫描速率的增大氧化还原峰的距离越来越大,即是可逆性降低。
实验二银电极特性吸附
一、实验目的:
1.了解银电极特性吸附现象
二、实验原理:
当对电极体系进行线性电位扫描时,电极电流为双电层充电电流及电极反应电流之和。
在没有电化学反应及吸(脱)附现象发生时,电流全部为双电层充电电流且保持定值。
当发生电化学反应时,电极电流增大,且在某电位下出现电流峰。
山峰值电位可判断是何种电极反应,山峰值电流可估量该条件下电极的最大反应速度或反应物浓度。
线性电位扫描法还可用于判断电极反应的可逆性,电极过程的控制步骤及反应机理。
在表面覆盖层的研究上也有广泛的应用。
三、试验装置:
CHI750C电化学工作站,钳电极,参比电极,银电极,氢氧化钾。
配制lmol/L的KOH溶液作为电解液,采用三电极体系(银电极为工作电极)进行循环伏安扫描,然后加入一定量的cr,再进行循环伏安扫描。
每次扫描询银电极都需进行抛光处理。
五、结果与讨论:
0.04
0.02
000
-0.02
-0.04
E/V
上图为在没有C「的情况下,银电极在lmol/L的KOH溶液中循环伏安图,从图中可以看出,随着电位向正方向移动,出现了阳极电流,说明表面的Ag开始被氧化成A/0,随后阳极电流逐渐增加,在大约0.38V出现一个电流峰,然后电流乂逐渐下降,这是由于电极表面Ag:
O的覆盖度不断增加,阻碍了Ag到Ag:
O的反应。
在大约0.5V后电流降至很小值,说明电极表面全部被A/0覆盖。
当扫描电位增至0.59V左右乂出现一个新的电流峰,这是由于辰0进一步氧化成AgO。
此后电位扫描至0.8V,电流乂开始上升,在电极表面可看到有气泡溢出,显然这电流是用于产生氧气。
当扫描至1.0V后开始换向密集型负向扫描。
随着电位下降,电流开始下跌。
至0.3V左右乂开始出现电流峰,但此时为阴极电流。
这是由于膽0的阴极还原成民0,这个逆向反应的极化很小,可能是因为AgO的电阻率较小的关系。
下一个阴极电流峰在-0.020^0.5V之间,是由于A&
0阴极还原为Ag,其极化较此反应的逆反应要大些,可能是因为Ag’O的电阻率较高所致。
同理推测加入Cl-之后的循环伏安曲线,如上图所示,加入C1-之后,Ag电极的三角波扫面曲线,可以看到AgO还原为Ag20的波峰明显减弱了,这是因为C1-在银电极表面特性吸附的缘故。
实验三铁氤化钾交流阻抗
一、实验目的:
1.了解交流阻抗的测试原理和方法
2.学会解读交流阻抗图谱
2.
实验原理:
Z=
(l+b、‘&
CJ+a)2
—=(1+c7\coCdy+coCd(—=+RpY
_yjCOJ3
C;
(學+心)2
在低频区,lim(」+b佑c丿=1,简化后可得:
Zt=R1ZM=-^=.(1+a^Cd)+<
r2Crf=-^+2a2Cd
y/O)yJCOy/CO
在高频区,当3—5时,可以求得:
Z'
=Rl+―,Z—•怕乞,两式消去"
得:
1+6TC;
叫1+/C氷;
(Z」&
-¥
)2+Z“2=(¥
)2
厶厶
CHI750C电化学工作站,铁氤化钾,亚铁辄化钾,钳电极,参比电极。
1.溶液的配制
在250mL容量瓶中,依次加入KFe(CN)6溶液和K3Fe(CX)6iWift,使稀释至接近刻度处,静置,用蒸镭水定容。
配制K3[Fe(CN)6〕和K.[Fe(CN)6】浓度均为0.005mol/L的溶液。
2.K;
Fe(C\)6溶液和K3Fe(CN)6洛液的交流阻抗曲线
初始电平0.IV,从低频0.01Hz到高频lOOKHz,振幅0.005V。
五、结果与讨论
加入KNOs作为支持电解质,采用三电极体系(工作电极为钳电极)进行交流阻抗测试。
■(V)(Hz)
02004006008001000120014001600
z7ohm
图15mMK3[Fe(CN)6]+5mMK4[Fe(CN)6]电解液Pt电极表面电化学
反应的交流阻抗图
图25mM图2Ks[Fe(CN)6]+5mMK4[Fe(CN)6]+lMKC1电解液Pt电极表面电化学反应的交流阻抗图
从图中可以看到,在低频区,当。
=龙/4时,电极的Nyquist图是一条斜率
为I的直线,受扩散控制,直线在Z'
'
轴上的截距为Rl+Rp-2Cdo图上出现实分量和虚分量的线性相关,这是电极过程扩散控制的最鲜明的阻抗特征。
复平面上相应于高频区的阻抗曲线是一个半圆,受电化学控制,圆心在Z'
轴上Rl+Rp/2处,半径等于Rp/2o
实验四苯胺单体的电聚合
1、熟悉电化学工作站测试方法的应用
2、了解苯胺单体电聚合的机理
聚苯胺作为一种优良的防腐材料逐渐引起重视,并且成为导电聚苯胺最有希望的研究领域。
因导电聚合物(如聚苯胺)通常不溶于水和一般有机溶剂,且无热塑性,故加工困难,涂料生产成本很高,涂料的生产和涂装过程涉及大量的挥发性有机溶剂,易造成生产和周围环境的空气污染,危害工人健康。
因此,釆用电化学法制备导电聚苯胺在防腐蚀应用上应具有更大的优势。
苯胺的电聚合反应可以概括为以下过程:
一般认为,反应的第一步是电极从芳香族单体上夺取一个电子,使其氧化成为阳离子自111基;
生成的两个阳离子自山基之间发生加成性偶合反应,再脱去两个质子,成为比单体更易于氧化的二聚物。
留在阳极附近的二聚物继续被电极氧化成阳离子,继续其链式偶合反应。
三、实验试剂基仪器试剂:
苯胺单体、0.5M硫酸仪器:
化学工作站、三电极体系
首先、打磨釦片电极,尽量打磨发亮,将较亮的一极作为工作极。
其次、连接测量电路。
将三个电极分别插入注入0.5molI?
硫酸和苯胺单体的电解溶液的中。
最后、将电解池中的三电极分别与电化学工作站三根相应的导线相连。
然后测量并保存数据。
五、实验数据及分析
0.008
下图是扫速为20mv/s卜测得得CV图。
-0.008
•0.20.00.20.40.60.81.0
Potential/V
上图为扫描速度为5OmV・si时的苯胺电聚合循环伏安曲线,扫描10圈。
从图中可观察到聚苯胺三对典型的氧化还原峰(即苯胺的氧化掺杂),这不同于典型的双电层电容器的循环伏安曲线,显示出法拉笫准电容的存在,且随循环次数的增加,反应电流随之增大,表明聚苯胺在钳电极上的顺利聚合。
0.006
0.004
0.002
0.000
-0.002
・0.004
・0.006
-0.20.00.20.40.60.81.0
Potential^
上图为此电极在H2S04溶液中测试的曲线,其电流大小基本与图一相仿。
但电化学容量分布较窄,仅在-0.1〜0.7V之间。
因此前者的电化学窗口远大于后者,因此有机体系中聚苯胺会有更大的能量密度。
实验五旋转圆盘电极
1.实验目的:
1.掌握旋转圆盘电极的实验技术。
2.学会运用旋转圆盘电极实验方法测定电化学动力学参数。
3.学会运用旋转圆盘电极建立电化学分析方法。
2.实验原理:
电化学反应过程通常山反应物和产物的传质步骤或电荷转移步骤所控制。
为了测定电化学反应的动力学参数,必须通过测量技术和数学处理,突出某一控制步骤,忽略另一个控制步骤。
例如,为了测量传质过程的动力学参数、扩散系数(D),必须使电化学反应过程由传质步骤控制。
反之,为了测量电极反应过程的动力学参数,如交换电流密度i°
、电子转移系数a和标准反应动力学常数K,必须使整个电化学反应过程山电荷转移步骤控制。
旋转圆盘电极山于其电极转速可以准确控制,可以通过测量不同转速下的伏安曲线,做必要的数学处理,突出某一步骤,求得动力学参数。
此外,在一定转速下,旋转圆盘电极反应的极限电流和反应浓度存在线性关系。
因此,旋转圆盘电极也是一种常用的、稳定的电化学分析方法。
3.主要仪器和试剂:
仪器:
CHI660A电化学工作站,电解槽系统以旋转圆盘电极为工作电极,饱和甘汞电极为参比电极,钳片为辅助电极。
试剂:
K;
Fe(CX)6和K3Fe(CN)6溶液。
4.实验步骤:
1电解液配制:
0.01mol/L的K,Fe(CN)6+0.01mol/L的K3Fe(CN)6的lmol/L的KC1溶液lOOmL置于电解槽中。
2设置测试参数:
选定6个不同的转速,扫描速率为10mV/s,扫描范围为-0.35"
+0.35V(vs.SCE)。
测定一组不同转速先旋转圆盘电极在0.01mol/L的K;
Fe(CN)6+0.01mol/L的KsFe(CN)6的线性扫描伏安曲线。
扫描速率和扫描范围如上述。
3由测试结果进行分析:
求得K3Fe(CN)6的扩散系数D。
和K.Fe(CN)6的扩散系数DR.电子转移系数a.电极反应交换电流i°
和标准反应速率常数Ko
5.结果与讨论:
选择不同的转速,根据电化学工作站扫描出如下曲线:
0.0006
0.0004
0.0002
0.0000
-0.0002
-0.0004
-0.0006
-0.0008
由上图我们可以看出,在电极转动时,消除了扩散影响,循环伏安曲线呈现为S型。
并且随着转速的增大,极限电流也随之增大。
山电化学理论极限电流密度与转速之间的关系为:
Id=nFyoCDV2c^
即极限电流Id与“总成正比。
我们将实验得到的数据进行了线性拟合,发现实验结果与理论吻合。
并且可以根据该直线的斜率可以得到其他相关的电化学动力学参数。
实验六银片钝化曲线
1.熟悉CHI电化学工作站的使用。
2.学会用阳极钝化曲线进行样品分析的实验技术。
3.了解银片在不同电势区间表现出的钝化和破钝现象
山阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化。
金属表面状态发生变化,使它具有贵金属的低腐蚀速率和正电极电势增高等特征的过程。
金属与周围介质自发地进行化学作用而产生的金属钝化称为化学钝化或自钝化作用。
通常强氧化剂(浓HN03.KMnOi、K:
Cr:
07.HC1O3等)可使金属钝化。
钝化后的金属失去原有的某些特性。
若金属通过电化学阳极极化引起钝化称为阳极钝化。
一些可以钝化的金属,当从外部通入电流,电位随电流上升,达到致钝电位后,腐蚀电流急速下降,后随电位上升,腐蚀电流不变,直到过钝区为止利用这个原理,以要保护的设备为阳极导入电流,使电位保持在钝化区的中段,腐蚀率可保持很低值。
在保持钝性的电位区间,决定金属的阳极溶解电流密度大小的是钝化膜的溶解速度,所以,金属的钝态不是热力学稳定状态,而是一种远离平衡的耗散结构状态。
阳极保护法需要一台恒电位仪以控制设备的电位(以免波动时进入活化区或过钝化区)。
山于只适用于可钝化金属,所以这种方法的应用受到限制。
CHI750C电化学工作站,線片,釦电极,参比电极。
1傑电极前处理:
研究电极是髙纯门电极,经1.5U研磨膏抛光,洗涤剂和蒸憎水冲洗即可待用。
2电解液配制:
电解质溶液是0.INH’SO怡液。
3试验装置搭配:
辅助电钮是Pt电极。
参电极是饱和甘汞电极。
4设置参数测试:
初始电极电位为-0.2VISCE,终止电位为1.8V„SCEo控制扫描速度测定单程阳极钝化曲线。
五、结果与讨论
实验测试阳极钝化曲线结果见图:
0.12
每次实验结束,观察电极表面都可发现均匀灰白色氧化物。
若在0.1NH:
SO”加不同浓度的KC1,它们的单程电位扫描伏安曲线,用放大境观察电极表面,可发现典型的PittingCorresion凹坑。
山图可观察到:
-0.21v到0.18v区间为活性溶解区,是傑片的正常溶解区间
0.18到0.75v区间为钝化过渡区,此时線片表面形成钝化膜,所以电流密度随着阳极电极电势增大而减小
0.75v到1.2v为钝化稳定区,金属处于钝化状态,此时银片表面生成一层致密的钝化膜,在此区间电流密度稳定在很小值,而且与阳极电势变化无关
1.2v以后为超钝化区,电流密度乂随阳极电极电势的增大而迅速增大,在此区间钝化了的银片乂重新溶解,与活性溶解区类似,在1.56v处也有一小峰,分析应属于二次钝化.
实验七镰片在硫酸体系tafel研究
1.学会运用tafel实验方法测定电化学动力学参数。
2.学会运用tafel建立电化学分析方法。
塔菲尔(Tafel)线外推法。
一种测定腐蚀速率的方法。
做法是将金属样品制成电极浸入腐蚀介质中,测量稳态的伏安(E〜I)数据,作logI~E图,将阴、阳极极化曲线的直线部分延长,所得交点对应的即为山腐蚀电流Is除以事先精确测量的样品面积S。
,即得腐蚀速率。
此法快速省时,适用于金属均匀腐蚀的测量。
首先关系是:
E=a+b*|lgi|,所以a值的求法,就直接延长阳极支与E轴的交点,而b的值其实就是阳极支曲线的斜率,在图上就能求出。
电极的极化引发的电极反应中电流、电压的关系变化繁多,统称为极化曲线,或称伏安图。
它的测量和研究是电极反应动力学的重要内容,其结果也是电化学生产过程控制的重要依据。
极化曲线的测量方法可以是“稳态”的,也可是“暂态”的。
前者是先控制恒定的电流(或电压),待响应电压(或电流)恒定后测量之,可获得稳态极化曲线。
后者则控制电流恒定或按一定的程序变化,测量响应电势的变化;
或控制相应的电势,测量响应电流的变化获得暂态极化曲线。
三、实验器材
CHI660A电化学工作站,饱和甘汞电极,钳片。
试剂:
浓硫酸。
1电解液配制:
配制lmol/LH’SOj溶液。
选定3个不同的扫描速率,分别为2、5和10mV/s,扫描范围为-0.20>
0.20V(vs.SCE)。
3山测试结果进行分析:
求得测试得到tdfel曲线,并依据此曲线的结果进行电化学动力学分析。
选择不同的扫描速度的三条tafel曲线如下图所示:
随扫速增加,腐蚀电位略有正移,扫速为2mV/s时,为初次测试,傑片表面
活性较大,迅速反应,腐蚀程度较大。
随着腐蚀过程中的延伸,扫速增加,硫酸浓度有所降低,使得線片表面结构发生一些改变,促使腐蚀电流密度有所降低。
图1Ni片在不同的扫速下的tafel曲线
如果为不同扫速下的tafel曲线,可以利用CHI自带的计算功能对Ni的腐蚀速
度进行计算。
:
2mv/s:
5mv/s
lOmv/s: