版5年高考3年模拟人教新课标版高考化学专题二十一 物质的检验分离和提纯Word文件下载.docx
《版5年高考3年模拟人教新课标版高考化学专题二十一 物质的检验分离和提纯Word文件下载.docx》由会员分享,可在线阅读,更多相关《版5年高考3年模拟人教新课标版高考化学专题二十一 物质的检验分离和提纯Word文件下载.docx(29页珍藏版)》请在冰豆网上搜索。
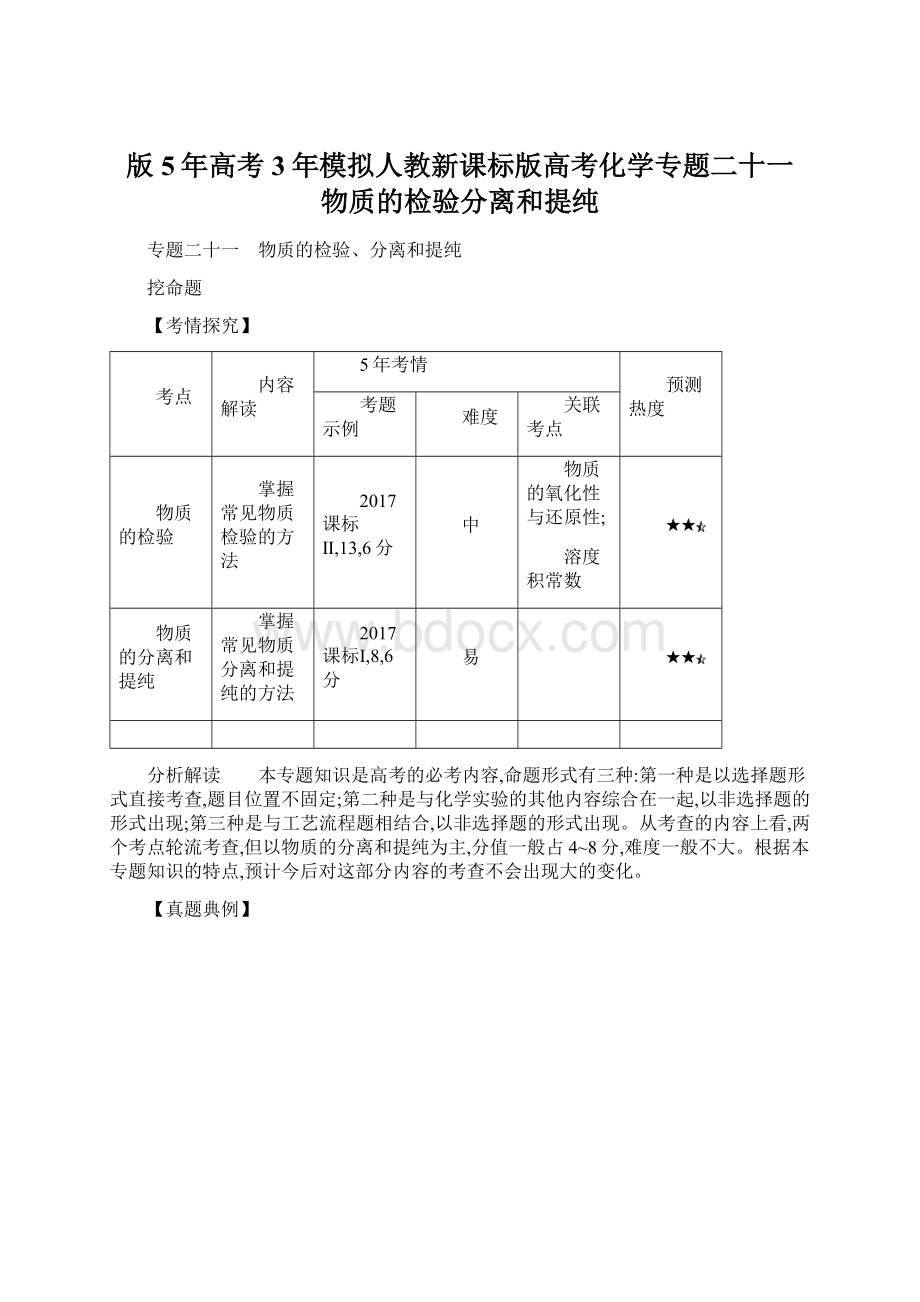
向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液
生成白色沉淀
试样已氧化变质
B
向Co2O3中滴入浓盐酸
产生黄绿色气体
氧化性:
Co2O3>
Cl2
C
向待测液中依次滴入氯水和KSCN溶液
溶液变为红色
待测溶液中含有Fe2+
D
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
Al
与HC
发生了相互促进的水解反应
答案 B
4.(2018浙江“七彩阳光”联盟期初联考,10)下列关于某些物质的检验方法或结论正确的是( )
A.某固体焰色反应呈黄色,则一定存在钠盐
B.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含C
5.(2018吉林四盟校期中联考,14)只用一种试剂可区分Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.NaOHB.H2SO4
C.BaCl2D.AgNO3
答案 A
6.(2017吉林通化一检,15)欲在有Y存在的情况下,用一种试剂Z来检验盐溶液中的离子X,下表中对应的试剂Z合理的是( )
试剂Z
氨水
硝酸银溶液
硫酸钠溶液
硝酸钡溶液
X
Mg2+
Cl-
Ba2+
S
Y
Al3+
7.(2017四川成都五校联考,17)下列气体的制备和性质实验中,由现象得出的结论错误的是( )
试剂
试纸或试液
浓氨水、生石灰
湿润红色石蕊试纸
变蓝
NH3为碱性气体
浓盐酸、浓硫酸
湿润pH试纸
变红
HCl为酸性气体
浓盐酸、二氧化锰
淀粉碘化钾试液
Cl2具有氧化性
亚硫酸钠、硫酸
品红溶液
褪色
SO2具有还原性
8.(2017河南洛阳统考,15)在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:
、C
、Si
、I-、N
、S
。
在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。
关于此溶液,下列说法中正确的是( )
A.原溶液中可能含有Si
B.生成的气体中一定有NO,可能含有CO2
C.溶液中减少的离子是S
D.原溶液中一定含有S
考点二 物质的分离和提纯
1.(2019届河南、河北重点高中一联,4)实验室欲从含MgBr2的卤水中提取Br2,下列操作未涉及的是( )
2.(2019届山西顶级名校月考,5)下列说法正确的是( )
A.用干燥的pH试纸测定氯水的pH
B.四氯化碳和水混合后,可以用分液的方法分离
C.碘在乙醇中的溶解度较大,可用乙醇萃取溶于水中的碘
D.将13.9gFeSO4·
7H2O完全溶解于36.1g蒸馏水中,配制27.8%的FeSO4溶液
3.(2018陕西西安中学摸底,5)为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
被提纯的物质
除杂试剂
分离方法
NaBr溶液(NaI)
氯水、CCl4
萃取、分液
NH4Cl溶液(FeCl3)
NaOH溶液
过滤
CO2(CO)
CuO粉末
通过灼热的CuO粉末
SiO2(Al2O3)
4.(2017辽宁铁岭协作体一联,1)下列分离物质的方法中,根据微粒大小进行分离的是( )
①分液 ②过滤 ③分馏 ④重结晶 ⑤渗析
A.②⑤B.②④C.①②D.①③⑤
5.(2017江西红色七校一联,15)除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
序号
物质
除杂方法
C2H4(SO2)
洗气
C6H6(Br2)
Fe粉
蒸馏
C6H5NO2(HNO3)
分液
C2H2(H2S)
CuSO4
6.(2018湖北荆州质量检查,16)关于下列各装置的叙述中,正确的是( )
A.装置①可用于分离I2与NH4Cl的混合物
B.装置②用于收集并测量Cu与浓硫酸反应产生的气体的体积
C.装置③用于制取氯气
D.装置④用于制取无水MgCl2
过专题
【五年高考】
A组 统一命题·
课标卷题组
1.(2016课标Ⅱ,12,6分)某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;
再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A.NaHCO3、Al(OH)3B.AgCl、NaHCO3
C.Na2SO3、BaCO3D.Na2CO3、CuSO4
2.(2015课标Ⅰ,26,14分)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×
10-2,K2=5.4×
10-5。
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。
草酸晶体(H2C2O4·
2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是
,由此可知草酸晶体分解的产物中有 。
装置B的主要作用是
。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 。
装置H反应管中盛有的物质是 。
②能证明草酸晶体分解产物中有CO的现象是
。
(3)设计实验证明:
①草酸的酸性比碳酸的强
。
②草酸为二元酸
。
答案 (14分)
(1)有气泡逸出、澄清石灰水变浑浊 CO2 冷凝(水蒸气、草酸等),防止草酸进入装置C反应生成沉淀,干扰CO2的检验(1分,1分,2分,共4分)
(2)①F、D、G、H、D、I CuO(3分,1分,共4分)
②H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊(2分)
(3)①向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生(2分)
②用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍(2分)
3.(2017课标Ⅰ,8,6分)《本草衍义》中对精制砒霜过程有如下叙述:
“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是( )
A.蒸馏B.升华C.干馏D.萃取
4.(2014课标Ⅰ,26,13分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。
实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量
密度/(g·
cm-3)
沸点/℃
水中溶解性
异戊醇
88
0.8123
131
微溶
乙酸
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。
开始缓慢加热A,回流50min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
(1)仪器B的名称是 。
(2)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是
。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是 。
(5)实验中加入少量无水MgSO4的目的是 。
(6)在蒸馏操作中,仪器选择及安装都正确的是 (填标号)。
(7)本实验的产率是 (填标号)。
a.30%b.40%c.60%d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是 。
答案
(1)球形冷凝管
(2)洗掉大部分硫酸和醋酸 洗掉碳酸氢钠
(3)d (4)提高醇的转化率 (5)干燥 (6)b (7)c
(8)高 会收集少量未反应的异戊醇
B组 自主命题·
省(区、市)卷题组
1.(2015天津理综,2,6分)下列关于物质或离子检验的叙述正确的是( )
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
2.(2015浙江理综,8,6分)下列说法正确的是( )
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。
如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C.在未知液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在S
或S
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
3.(2014广东理综,9,4分)下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
叙述Ⅰ
叙述Ⅱ
KNO3的溶解度大
用重结晶法除去KNO3中混有的NaCl
BaSO4难溶于酸
用盐酸和BaCl2溶液检验S
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
Ca(OH)2能制成澄清石灰水
可配制2.0mol·
L-1的Ca(OH)2溶液
4.(2014上海单科,18,4分)某未知溶液可能含Cl-、C
、Na+、S
、Al3+。
将溶液滴在蓝色石蕊试纸上,试纸变红。
取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;
在上层清液中滴加硝酸银溶液,产生白色沉淀。
下列判断合理的是(双选)( )
A.一定有Cl-B.一定有S
C.一定没有Al3+D.一定没有C
答案 BD
5.(2016北京理综,7,6分)下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存
6.(2016上海单科,16,3分)实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。
下列分析正确的是( )
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
C组 教师专用题组
1.(2014浙江理综,13,6分)雾霾严重影响人们的生活与健康。
某地区的雾霾中可能含有如下可溶性无机离子:
Na+、N
、Mg2+、Al3+、S
、N
、Cl-。
某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
已知:
3N
+8Al+5OH-+2H2O
3NH3↑+8Al
根据以上的实验操作与现象,该同学得出的结论
的是 ( )
A.试样中肯定存在N
、Mg2+、S
和N
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
2.(2013大纲全国,10,6分)下列操作
达到目的的是( )
目的
操作
A.
配制100mL1.0mol·
L-1CuSO4溶液
将25gCuSO4·
5H2O溶于100mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将Mn
完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
3.(2013福建理综,10,6分)下列有关实验的做法
的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.1000mol·
L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验N
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
4.(2013浙江理综,13,6分)现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
5.(2012课标全国,7,6分)下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
6.(2014北京理综,28,15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。
某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。
记录如下(a、b、c代表电压值):
电压/V
阳极现象
检验阳极产物
Ⅰ
x≥a
电极附近出现黄色,有气泡产生
有Fe3+、有Cl2
Ⅱ
a>
x≥b
电极附近出现黄色,无气泡产生
有Fe3+、无Cl2
Ⅲ
b>
x>
无明显变化
无Fe3+、无Cl2
(1)用KSCN溶液检验出Fe3+的现象是 。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。
写出有关反应:
。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。
电解pH=1的NaCl溶液做对照实验,记录如下:
Ⅳ
x≥c
有Cl2
Ⅴ
c>
无Cl2
①NaCl溶液的浓度是 mol/L。
②Ⅳ中检验Cl2的实验方法:
。
③与Ⅱ对比,得出的结论(写出两点):
。
答案
(1)溶液变红
(2)2Cl--2e-
Cl2、Cl2+2Fe2+
2Cl-+2Fe3+
(3)还原
(4)①0.2
②取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝
③通过控制电压,证实了产生Fe3+的两种原因都成立;
通过控制电压,验证了Fe2+先于Cl-放电
7.(2014浙江理综,26,15分)某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。
请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图 ,写出气体甲的电子式 。
(2)X的化学式是 ,在惰性气流中加热X至完全分解的化学反应方程式为
。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是 (用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式 ,并设计实验方案验证该反应的产物
答案
(1)
(2)CaFe(CO3)2 CaFe(CO3)2
CaO+FeO+2CO2↑
(3)4Fe(OH)2+2H2O+O2
4Fe(OH)3
(4)2FeO+CO2
Fe2O3+CO
检测Fe2O3:
将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);
检测CO:
将气体通过灼热CuO,黑色固体变为红色
8.(2014大纲全国,10,6分)下列除杂方案
杂质
CO(g)
CO2(g)
NaOH溶液、浓H2SO4
NH4Cl(aq)
Fe3+(aq)
Cl2(g)
HCl(g)
饱和食盐水、浓H2SO4
Na2CO3(s)
NaHCO3(s)
——
灼烧
9.(2013课标Ⅰ,13,6分)下列实验中,所采取的分离方法与对应原理都正确的是( )
原理
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
分离乙酸乙酯和乙醇
乙酸乙酯和乙醇的密度不同
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
除去丁醇中的乙醚
丁醇与乙醚的沸点相差较大
10.(2013安徽理综,12,6分)我省盛产矿盐(主要成分是NaCl,还含有S
等其他可溶性杂质的离子)。
下列有关说法正确的是( )
A.由矿盐生产食盐,除去S
最合适的试剂是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
11.(2015浙江理综,29,15分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验
(一) 碘含量的测定
取0.0100mol·
L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。
测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL
15.00
19.00
19.80
19.98
20.00
20.02
21.00
23.00
25.00
E/mV
-225
-200
-150
-100
50.0
175
275
300
325
实验
(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
3I2+6NaOH
5NaI+NaIO3+3H2O。
请回答:
(1)实验
(一)中的仪器名称:
仪器A ,仪器B 。
(2)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为
。
②步骤X中,萃取后分液漏斗内观察到的现象是
。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验
(二)中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
答案 (共15分)
(1)坩埚 500mL容量瓶
(2)①
②20.00 0.635