高考化学压轴题推断题强化训练有答案Word下载.docx
《高考化学压轴题推断题强化训练有答案Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学压轴题推断题强化训练有答案Word下载.docx(17页珍藏版)》请在冰豆网上搜索。
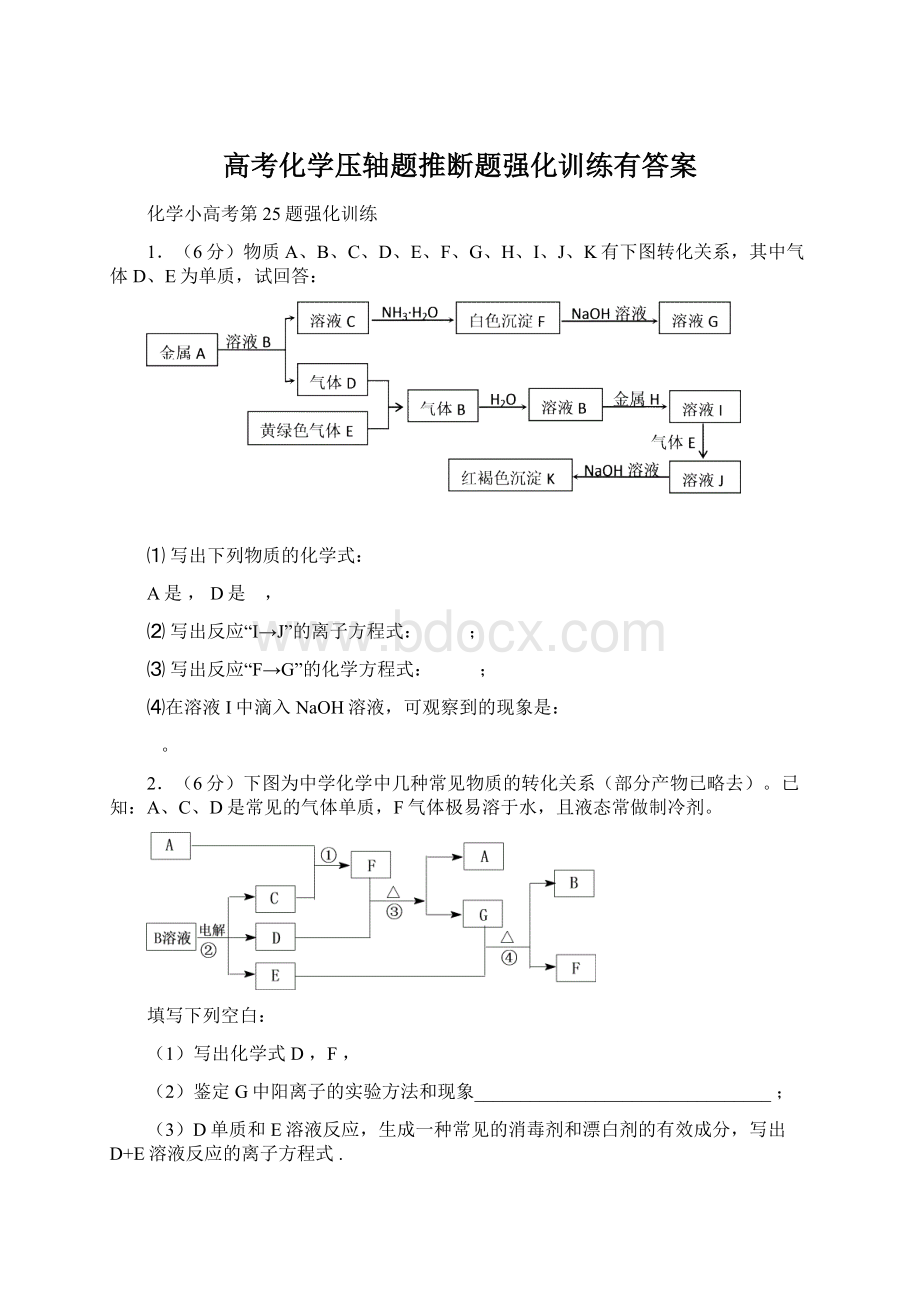
⑴甲的化学式是,C的电子式为;
⑵写出A溶液和丁反应生成D的离子方程式:
;
⑶写出A和E反应的化学方程式:
6.(6分)下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;
E在常温下是黄绿色气体;
在适当的条件下,它们之间可以发生如下图所示的转化。
⑴A的化学式是;
⑵反应F→D的化学方程式是。
⑶检验F中金属阳离子的常用方法是。
⑷工业上冶炼金属A的化学方程式是。
7.(6分)A、B、C等八种物质有如下框图所示转化关系。
又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
⑴B的化学式是,F的化学式是,H的电子式为;
⑵写出A和B溶液反应的离子方程式:
⑶写出D和E反应的化学方程式:
⑷如何检验I中的阳离子。
8.(6分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,工业上电解熔融的甲可制取金属A。
请回答:
(1)写出下列物质的化学式:
A、甲。
(2)写出乙物质的溶液中通入过量CO2的现象:
(3)写出丁与过量氨水反应的离子方程式:
9.(6分)下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。
A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;
物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应呈黄色。
反应④是化肥工业的重要反应。
⑴A的元素在元素周期表中的位置是,物质B的电子式为。
⑵上述反应①~⑥中,属于化合反应的是,反应⑤的离子方程式为。
⑶在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为:
10.(6分)下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。
(反应中生成的水已略去)请回答以下问题:
(1)E是,F是(填化学式)。
(2)C物质在日常生活中可作剂。
(3)写出反应①的化学方程式:
参考答案
1.
(1)Al、H2
(2)2Fe2++Cl2===2Cl-+2Fe3+(3)生成白色沉淀,沉淀立即变成灰绿色,最后变成红褐色
2.
(1)Cl2、NH3、
(2)取少量D的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色
(3)2OH-+Cl2=ClO-+Cl-+H2O
(4)
3.
(1)Na NaHCO3
(2)2Na+2H2O=2Na++2OH-+H2↑
(3)2Na2O2+2CO2=2Na2CO3+O2
4.⑴三、ⅢA
⑵3Fe+4H2O(g)===Fe3O4+4H2
⑶2Al+2OH—+2H2O=2AlO2—+3H2↑
⑷4H2+Fe3O4
3Fe+4H2O
5.
(1)Fe
(2)2OH-+Cl2===Cl-+ClO-+H2O
(3)NH4Cl+NaOH==NH3+NaCl+H2O
6.
⑴Al
⑵2FeCl3+Fe=3FeCl3
⑶加入KSCN溶液,显血红色则含Fe3+
⑷Fe2O3+3CO
2Fe+3CO2
7.⑴NaOHNH3
⑵2Al+2H2O+2OH_=2AlO2_+3H2↑
⑶H2+Cl2=(点燃)2HCl⑷取样,加入碱,加热,在试管口以湿润红色石蕊试纸检验,变蓝色,说明存在铵根离子
8.
(1)Al、Al2O3
(2)产生白色胶状沉淀(3)Al3++3NH3·
H2O=Al(OH)3↓+3NH4+
9.⑴第三周期、ⅠA族
⑵④Al3++3NH3·
⑶有白色沉淀产生,后渐渐溶解至消失
10.
(1)CaCO3、HCl
(2)消毒(或漂白)(3)2C12+2Ca(OH)2=CaCl2+Ca(C1O)2+2H2O
化学小高考第26题强化训练
1、“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水。
某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。
由此得出的结论为上述“脱氧剂”中的铁已部分被;
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤⑶取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。
将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0
g。
8.0
g滤渣中活性炭的质量为g;
步骤⑷将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。
为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于mL;
步骤⑸向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:
该“脱氧剂”中的Fe粉和活性炭质量之比为。
2、二氧化硫(SO2)是形成酸雨的因素之一,它的含量是空气质量监测的一个重要指标。
某兴趣小组同学刚取到热电厂(燃煤电厂)附近的雨水进行实验。
①测得该雨水样品的pH为4.73;
②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
③每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h
1
2
3
4
雨水样品的pH
4.73
4.62
4.56
4.55
根据以上信息,回答下列问题:
⑴分析上述数据变化,你认为形成这一变化的原因是_________________________(用化学方程式表示)
⑵常温下,取该雨水与一定量的蒸馏水相混合,则pH将____________(填“变大”、“变小”或“不变”)
⑶兴趣小组同学取3小时后这种雨水VL,加入1.00mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗20.0mLBa(OH)2溶液。
请你计算:
①生成沉淀物的质量是多少?
②该VL雨水中溶解SO2的体积(标准状况)。
3、已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:
将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。
实验前
实验后
甲的质量/g
101.1
103.8
乙的质量/g
82.0
86.4
根据实验数据填空:
(1)该燃料完全燃烧生成水的质量为 g,生成CO2的质量为 g。
(2)该燃料分子中碳、氢原子的数目比为 。
(3)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为
,结构简式为 。
4、铝镁合金现已成为轮船制造、化工生产等行业的重要原料。
现有一块铝镁合金,欲测定其中镁的质量分数,几位同学分别称取3.9克样品,并设计了不同的实验方案:
甲:
铝镁合金测得生成气体的体积Vml(已折算成标准状况);
乙:
铝镁合金测得剩余固体的质量a克;
过量NaOH
溶液
丙:
铝镁合金溶液测得沉淀的质量b克。
⑴写出实验设计甲有关反应的离子方程式:
该方案能否测定出镁的质量分数?
(填“能”或“不能”)
⑵实验设计乙所加入的试剂是 ,测得的镁的质量分数为
⑶实验设计丙测得沉淀的质量为2.9克,加过量的NaOH溶液充分反应后,_________________(填一种分离方法),洗涤烘干沉淀,测得镁的质量分数为(保留小数点后一位小数) ,如果未洗涤沉淀,测得镁的质量分数将 (填“偏大”、“偏小”或“无影响”)。
5、某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的]
分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
8Fe+30HNO3(更稀)=8Fe(NO3)3+3NH4NO3+9H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号
实验操作
实验现象
①
取少量黑色粉末X放入试管1中,注入浓盐酸,微热
黑色粉末逐渐溶解,溶液呈黄绿色;
有气泡产生
②
向试管1中滴加几滴KSCN溶液,振荡
溶液出现血红色
③
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置
有极少量红色物质析出,仍有较多黑色固体未溶解
⑴实验③发生的反应的离子方程式为。
⑵上述实验说明黑色粉末X中含有。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
⑴操作Z的名称是。
⑵通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为。
[交流讨论]
在实验过程中,发现在溶液Y中滴加过量NaOH溶液时有刺激性气味气体生成。
为了确定溶液Y中各离子浓度,甲同学重复上述实验。
在步骤①中共收集到标准状况下896mL的气体,经分析其中只含有NO;
测得溶液Y中c(H+)=0.5mol/L。
通过计算可知,溶液Y中c(Fe3+)=mol/L,c(NH4+)=mol/L,c(NO3-)=mol/L。
请画出在200mL溶液Y中加入NaOH物质的量与生成的Fe(OH)3沉淀物质的量的关系曲线。
6、为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:
铜铝混合物测定生成气体的体积
方案Ⅱ:
铜铝混合物测定剩余固体的质量
回答下列问题:
⑴小组成员一致认为两个方案都可行,你认为在实验室中选择方案更便于实施。
⑵小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是。
(填编号)
A.稀盐酸B.氢氧化钠溶液C.硫酸铜溶液
(3)铜铝混合物的质量为Ag,
方案Ⅰ:
常温下,测定生成气体的体积体积为VL,此同学经过计算得出铜的质量分数为(1-45V/56A),你认为此计算结果是否有问题(是或否),理由.
方案Ⅱ:
测定剩余固体的质量为Bg,铜铝混合物中铜的质量分数为.
若选用溶液的浓度均为Cmol/L,为了充分反应,溶质均过量了原溶质质量的1/5,则选用的溶液体积至少为L或L。
7、化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4·
7H2O)。
【实验步骤】取本品10片,在适当的条件下配成100mL溶液,分别准确量取20mL溶液,
用下列两种方法进行实验:
方法一、用一定物质的量浓度的酸性高锰酸钾溶液滴定。
方法二、加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量。
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有。
(2)方法二中,加过量H2O2溶液的目的是。
有的同学认为使用氯气也能达到此目的,和使用氯气相比,用H2O2溶液的好处是。
(3)在方法一中,若每消耗1mL酸性高锰酸钾溶液相当于0.152gFeSO4,则该溶液中高锰酸钾的物质的量浓度是。
在方法二中,若称得红棕色固体的质量为ag,则每片补血剂含FeSO4g。
8、某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。
(1)仪器中装入的试剂:
B_________D___________;
(2)连接好装置后应首先_________________________
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是
____________________。
在这两步之间还应进行的操作是____________________________;
(4)反应过程中G管逸出的气体的处理方法是___________________
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:
Ar(W)=____________;
计算式2:
Ar(W)=____________。
9、食盐是日常生活的必需品,也是重要的化工原料。
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:
饱和Na2CO3溶液饱和K2CO3溶液NaOH溶液BaCl2溶液Ba(NO3)2溶液75%乙醇四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为。
⑵用提纯的NaCl配制500mL4.00mol·
L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有(填仪器名称)。
需称取NaClg
⑶电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2(填“>”、“=”或“<”)2L,原因是。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置(填代号)和制备并收集干燥、纯净Cl2的装置(填代号)。
可选用制备气体的装置:
10、酸雨是指pH<5.6的雨、雪等各种形式的大气降水。
二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。
酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。
某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ不同时间酸雨的pH
测定时间/小时钟
pH
(1)一段时间后,观察到红色变浅,可能的原因是
(2)生成白色浑浊的离子方程式
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示)
(4)如果取该雨水和蒸馏水混合,再测pH,结果将(填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:
(5)该组同学查资料得到的反应原理为:
SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是,SO2在该反应中显(填“氧化”或“还原”)性。
发生了反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是;
KMnO4溶液中导管末端做成球状多孔结构的作用是
(7)该实验中已经知道的数据有气体流速aL/min、酸性KMnO4溶液的体积bL,其浓度为cmol/L。
若从气体通入到紫色恰好褪去,用时5分钟。
则此次取样处的空气中二氧化硫含量为g/L
11、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。
某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有溶液的烧杯中,充分搅拌后经(填操作方法)洗涤后可得纯净的Mg(OH)2。
(3)写出过程④中发生反应的化学方程式。
(4)
在以上提取镁的过程中,没有涉及的化学反应类型是(
)
A.
分解反应
B.化合反应
C.复分解反应
D.置换反应
(5)
已知海水中镁的含量为1.10mg/L,若该工厂每天生产1.00吨镁,则每天至少需要多少体积的海水?
1、氧化2.452.52︰1
2、⑴2H2SO3+O2=2H2SO4
⑵变大
⑶①4.66g②0.448L
3、2.74.41:
3C2H6OCH3CH2OH或CH3OCH3
4、
(1)2Al+6H+===2Al3++3H2↑(1分)Mg+2H+===Mg2++H2↑(1分)
能(1分)
(2)NaOH溶液(1分)(a/3.9)×
100%(2分)
(3)过滤(1分)30.8%(2分)偏大(1分)
5、[实验探究]
I.⑴Fe+Cu2+=Fe2++Cu⑵Fe和Fe3O4
II.⑴过滤⑵Fe0.11mol、Fe3O40.03mol
10.153.65
6、
(1)Ⅱ
(2)AB
(3)是VL气体是在常温下测定的
(4)B/A2(A-B)/15C2(A-B)/45C或
7、
(1)容量瓶
(2)使Fe2+完全氧化成Fe3+无污染
(3)0.2mol·
L-10.95a(2分)
8、
(1)锌粒浓硫酸
(2)检查气密性
(3)先从A瓶逐滴滴加液体
检验H2的纯度
(4)在G管出口处点燃
(5)
9、
(1)①BaCl2、NaOH、Na2CO3。
②75%乙醇。
(2)天平、烧杯、500mL容量瓶、胶头滴管。
11.7g
(3)<
;
电解生成的氯气与电解生成的NaOH发生了反应;
中和滴定。
(4)e;
d。
10、⑴SO2有漂白作用,SO2浓度变小⑵Ba2++SO42-=BaSO4↓
⑶2H2SO3+O2=2H2SO4,(4)变大
(5)紫色褪去还原氧化(6)检查装置气密性增大接触面积,有利于SO2的充分吸收(7)32bc/a
11、
(1)石灰乳原料丰富,成本低
(2)MgCl2(或氯化镁)过滤
(3)MgCl2(熔融)Mg+Cl2↑
(4)BD(5)9.1×
105m3