高考工艺流程题解题技巧答案Word文档格式.docx
《高考工艺流程题解题技巧答案Word文档格式.docx》由会员分享,可在线阅读,更多相关《高考工艺流程题解题技巧答案Word文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
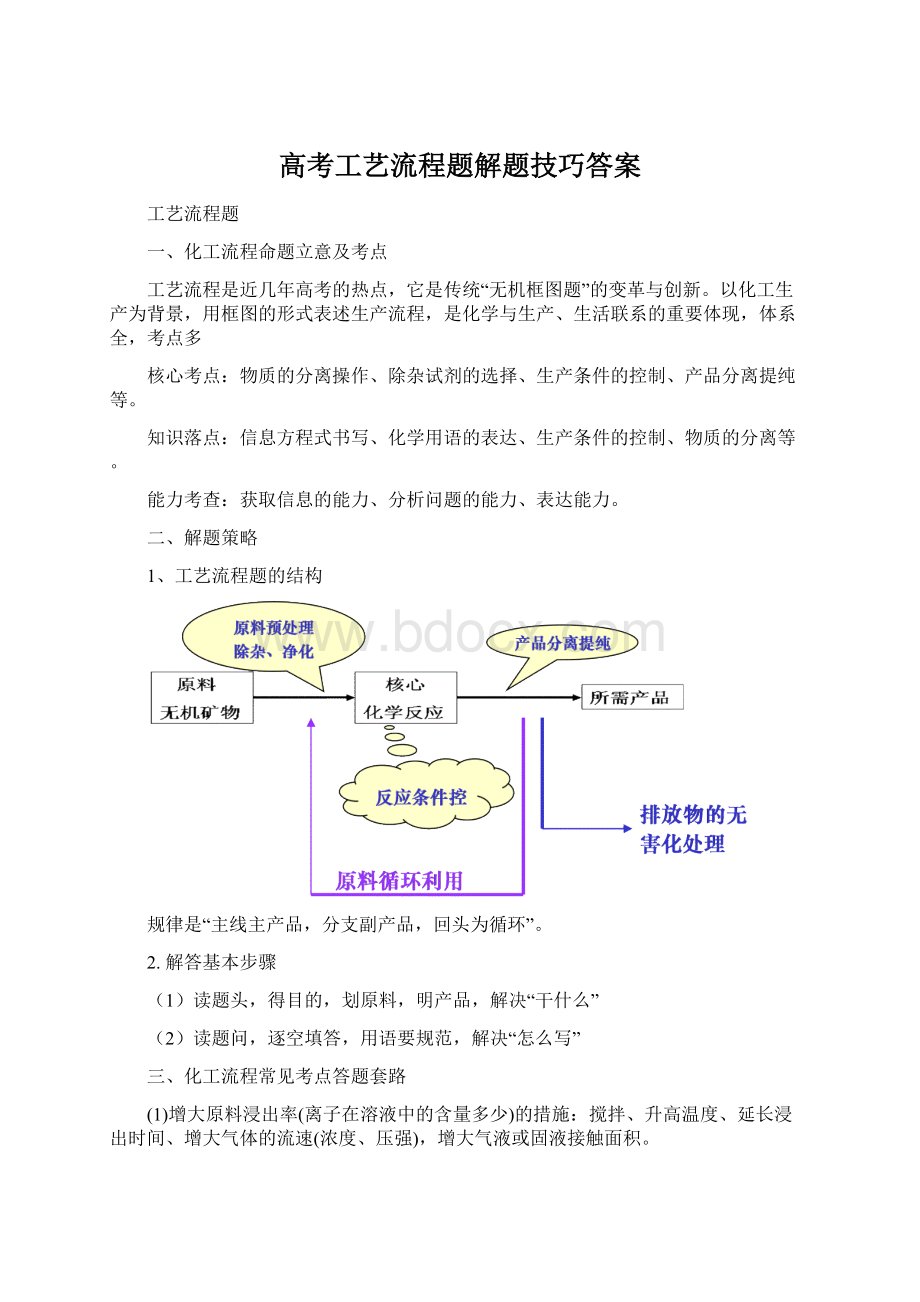
搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强),增大气液或固液接触面积。
(2)加热的目的:
加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动。
(3)温度不高于×
×
℃的原因:
适当加快反应速率,但温度过高会造成(如浓硝酸)挥发、(如H2O2、NH4HCO3)分解、(如Na2SO3)氧化或促进(如AlCl3)水解等,影响产品的生成。
(4)从滤液中提取一般晶体(溶解度随温度升高而增大的晶体)的方法:
蒸发浓缩(至有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥。
(5)从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法:
蒸发浓缩、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。
(6)溶液配制、灼烧、蒸发、过滤用到的仪器。
(7)控制某反应的pH值使某些金属离子以氢氧化物的形式沉淀:
调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质;
pH分离时的范围确定、范围过小的后果(导致某离子沉淀不完全)或过大的后果(导致主要离子开始沉淀)。
(8)减压蒸馏(减压蒸发)的原因:
减小压强,使液体沸点降低,防止(如H2O2、浓硝酸、NH4HCO3)受热分解、挥发。
(9)证明沉淀完全的操作:
[答题模板]
静置,取上层清液少许于一支试管中,再加入×
试剂,若没有沉淀生成,说明沉淀完全。
(10)洗涤沉淀的操作:
将沉淀放入过滤装置中,沿玻璃棒加蒸馏水至浸没沉淀,静置,待水流尽后,重复操作2~3次(若滤渣易溶于水,可用无水乙醇进行洗涤。
可减少沉淀损失,无水乙醇易挥发,不引入杂质。
)
(11)判断沉淀洗净的方法:
取最后一次洗涤液少许于一支试管中,滴加×
试剂(可与杂质的某些离子发生沉淀反应),若没有沉淀生成,说明沉淀洗涤干净。
(12)洗涤的目的:
除掉附着在沉淀表面的可溶性杂质。
②提高可溶性物质的产率
(13冰水洗涤的目的:
洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗。
(14)乙醇洗涤的目的:
降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物。
(15)蒸发、反应时的气体氛围:
抑制某离子的水解,如加热蒸发AlCl3溶液时为获得AlCl3需在HCl气流中进行。
(16)事先煮沸溶液的原因:
除去溶解在溶液中的气体(如氧气)防止某物质被氧化。
四、训练题
1.用碱式溴化镁废渣[主要成分为Mg(OH)Br,还含有少量有机溶剂及高分子化合物]生产C2H5Br(不溶于水,密度为1.46g•cm﹣3)和MgCl2•6H2O,既可减少污染又可得化工原料,有关工艺流程如图所示.
回答下列问题:
(1)碱式溴化镁溶于盐酸时,1molMg(OH)Br消耗0.5mol•L﹣1的盐酸的体积为 L.
(2)分离Ⅰ操作包括过滤和分液,其目的是 ;
分离Ⅱ操作时所需的玻璃仪器为 和 .
(3)提溴时,溶液预热至60℃时开始通入氯气,一段时间后,溶液的温度会自然升高到100℃,说明提溴反应为 (填“放热”或“吸热”)反应;
提溴废液需减压、蒸发、浓缩的目的是 .
(4)在浓硫酸催化下,合成溴乙烷粗品的化学方程式为 ;
合成时,反应温度不能过高,其主要原因是 .
(5)精制溴乙烷的步骤为水洗、Na2SO3溶液洗涤.水洗及干燥,其中Na2SO3溶液洗涤的目的是 .
(6)用惰性电极在一定条件下电解MgCl2溶液可制取催熟剂氯酸镁,该电解反应的化学方程式为 .
1.
(1)2;
(2)除去其中的有机物和高分子化合物;
分液漏斗;
烧杯;
(3)放热;
镁离子易水解,抑制镁离子的水解;
(4)6CH3CH2OH+3Br2+S
6CH3CH2Br+H2SO4+2H2O;
减少乙醇的挥发而损失;
(5)溴乙烷中溶解的溴;
(6)MgCl2+6H2O
Mg(ClO3)2+6H2↑.
2.工业上以锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂.其部分工业流程如图:
已知:
①Li2O•Al2O3•4SiO2+H2SO4(浓)
Li2SO4+Al2O3•4SiO2•H2O
②某些物质的溶解度(S)如表所示.
T/℃
20
40
60
80
S(Li2CO3)/g
1.33
1.17
1.01
0.85
S(Li2SO4)/g
34.2
32.8
31.9
30.7
(1)从滤渣1中分离出Al2O3部分的流程如图2所示,括号表示加入的试剂,方框表示所得的物质.则步骤Ⅱ中反应的离子方程式是
请写出Al2O3和Na2CO3固体在高温下反应的化学方程式 .
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) .
(3)最后一个步骤中,用“热水洗涤”的原因是 .
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是 .
②b中,生成Li2CO3反应的化学方程式是 .
2.
(1)Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
Al2O3+Na2CO3
2NaAlO2+CO2↑;
(2)Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq),Mg2+与OH﹣结合生成Ksp很小的
Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀
(3)减少Li2CO3的损失;
(4)①2C1﹣﹣2e﹣=Cl2↑;
②2LiOH+NH4HCO3
Li2CO3+NH3+2H2O.
3.硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·
7H2O,工艺流程如图27-l:
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。
(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是。
(6)取28.70gZnSO4·
7H2O加热至不同温度,剩余固体的质量变化如图27-2所示。
650℃时所得固体的化学式为_______(填字母序号)。
a.ZnOb.Zn3O(SO4)2c.ZnSO4d.ZnSO4·
H2O
3.
(1)过滤(1分)H2SiO3
(2)生高温度,加快反应速率
(3)3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+
(4)Zn2+、K+
(5)防止ZnSO4·
7H2O分解,并减少ZnSO4水解
(6)b
4.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。
CuCl难溶于醇和水,在潮湿空气中易水解氧化,且在氯离子浓度较大的体系中存在CuCl+Cl-
CuCl2-。
工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
回答下面问题:
(1)反应I中被氧化的元素有_________。
(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。
在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比的关系如下图所示。
CuCl+Cl-
CuCl2-的平衡常数K=6.5×
10-2,则该条件下Cu2+的最大沉淀率为_________。
(保留两位小数)。
4.
(1)S、Cu、Fe
(2)Mn2++HCO3-+NH3·
H2O===MnCO3↓+NH4++H2O
(3)SO2+2Cu2++2Cl-+2H2O==2CuCl↓+SO42-+4H+
(4)将CuCl2完全转化为CuCl并防止CuCl的氧化。
(5)醇洗有利于加快除去CuCl表面水分,并防止其水解和氧化
(6)增大氯离子浓度,CuCl+Cl-
CuCl2-平衡向右移动,使生成的氯化亚铜又部分转化为CuCl2-
(7)99.39%
5.镍及其化合物用途广泛。
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:
取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________。
(4)“浸出液”中c(Ca2+)=1.0×
10-3mol·
L-1,当除钙率达到99%时,溶液中c(F-)=_
_______mol·
L-1。
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
5.
(1)增大接触面积,加快反应速率,使反应更充分;
(2)Fe3++2H2O
FeO(OH)↓+3H+,SiO2、CaSO4;
(3)0.5,Cr2O72-+6Fe2++14H+
2Cr3++6Fe3++7H2O;
(4)2.0×
10-3;
(5)0.25。
6.