学年上海各区高三化学一模综合题汇编化学实验学生版Word文档下载推荐.docx
《学年上海各区高三化学一模综合题汇编化学实验学生版Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《学年上海各区高三化学一模综合题汇编化学实验学生版Word文档下载推荐.docx(16页珍藏版)》请在冰豆网上搜索。
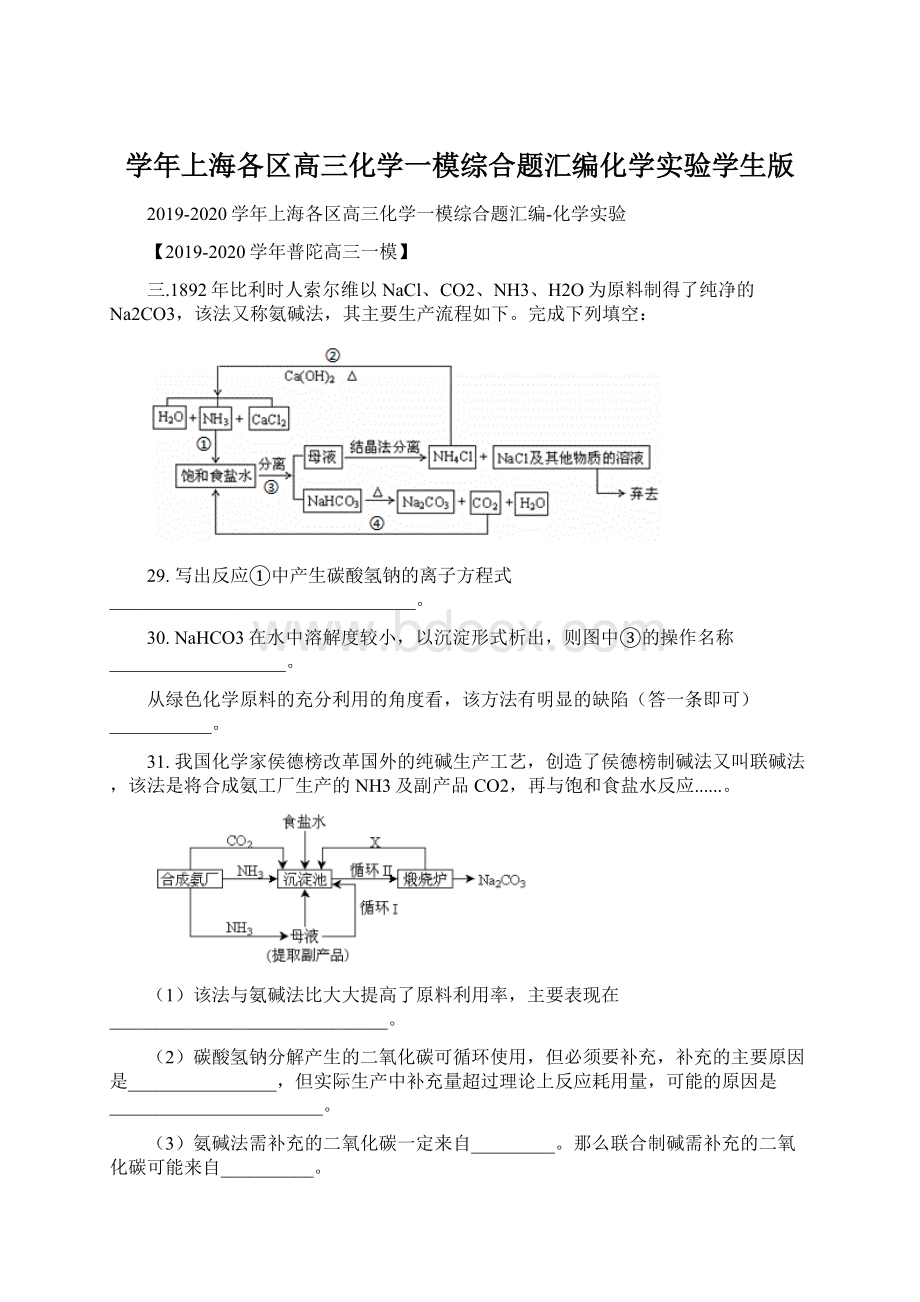
【2019-2020学年崇明高三一模】
氯碱厂以食盐等为原料,生产烧碱、盐酸等化工产品。
工艺流程可简单表示如下:
25.粗盐水中含有MgCl2、CaCl2、Na2SO4等可溶性杂质,①步骤必须先后加入稍过量的NaOH、BaCl2、Na2CO3溶液后过滤除杂。
试写出加入Na2CO3溶液时发生反应的离子方程式:
。
写出②步骤发生反应的化学方程式:
26.③步骤之后获得干燥的烧碱产品的有关操作有。
进行④步骤的生产设备A、B之间传递的是(选填编号)。
A.只有物料B.既有物料又有能量
C.只有能量D.既无物料也无能量
27.如果用下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)。
HCl→HCl→
H2O
H2O
H2OCCl4
苯
ABCD
28.若检验烧碱产品中是否含有少量NaCl杂质的实验方案是。
为测定烧碱产品的纯度,准确称取5.000g样品(杂质不含碱性物质)置于烧杯中,加水搅拌,冷却至室温后,将溶液全部转移入1000ml的容量瓶之后的一步操作是。
从所配得的溶液中每次都取出20.00ml,用0.12mol/l的盐酸滴定(选用常用指示剂),两次分别用去盐酸溶液19.81ml和19.79ml。
判断滴定终点的依据是,根据实验数据计算此烧碱产品的纯度为(保留两位小数)。
【2019-2020学年奉贤高三一模】
四.硫酸铁铵[NH4Fe(SO4)2·
xH2O]是一种重要铁盐。
为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
36、步骤①的目的是去除废铁屑表面的油污,方法是_________________。
37、步骤②需要加热的目的是_________________,温度保持80~95℃,采用的合适加热方式是_________________。
铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
38、步骤③中选用足量的H2O2,理由是_________________。
分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
【2019-2020学年虹口高三一模】
五.海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。
下图是某工厂对海水综合利用的示意图:
38.写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
39.液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品b.爆炸品c.有毒品d.易燃品
40.Mg(OH)2加入盐酸充分反应后,操作
是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为。
41.操作
是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因。
42.操作
是向溶液中鼓入,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有性。
43.粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br¯
,再通Cl2,最后蒸馏得到高纯溴。
用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
【2019-2020学年黄浦高三一模】
三.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:
部分阳离子以氢氧化物形式沉淀时溶液的pH
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
开始沉淀
2.3
7.5
3.4
完全沉淀
3.2
9.7
4.4
32.反应
后的溶液中存在的阳离子有。
33.加入少量NaHCO3的目的是将溶液的pH调节在范围内,从而使溶液中的。
该工艺中“搅拌”的作用是。
34.反应
加入NaNO2的目的是氧化Fe2+,反应的离子方程式为。
在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约了NaNO2克。
35.碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子可部分水解生成[Fe2(OH)4]2+聚合离子,该水解反应的离子方程式为。
36.在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。
根据我国质量标准,产品中不得含有Fe2+及NO3–。
为检验所得产品中是否含有Fe2+,应使用的试剂为。
(选填序号)
a.氯水b.KSCN溶液c.NaOH溶液d.酸性KMnO4溶液
【2019-2020学年嘉定高三一模】
二.乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
26.a装置中玻璃仪器除导管和试管外还有___________________________________仪器。
27.实验时,通常加入过量的乙醇,原因是:
___________________________________________________________________________。
加入数滴浓硫酸即能起催化作用,但实际用量多于此量,
原因是:
___________________________________________________________
浓硫酸用量又不能过多,原因是__________________________________________________。
28.饱和Na2CO3溶液的作用是_____________________________________________________。
29.反应结束后,将试管中收集到的产品倒入分液漏斗中,_______________、_________________,然后分液。
这样得到的乙酸乙酯是粗产品,要进一步提纯精制,通常先用饱和食盐水洗涤除去少量Na2CO3溶液,再用饱和CaCl2溶液除去少量________________
30.若用b装置制备乙酸乙酯,其缺点有______________________________________、_____________________________________。
【2019-2020学年金山(长宁)高三一模】
爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。
完成下列问题:
29.写出通入CO2和NH3的化学反应方程式____________________________。
在饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_______________________。
30.母液中除H+和OH-外,还含有的离子是_____________。
向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
31.上述流程中X物质的分子式 。
使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
从沉淀池中取出沉淀的操作是 。
32.写出检验产品碳酸钠中是否含有氯化钠的简要方案:
33.工业生产的纯碱常会含少量NaCl杂质。
现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。
样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
【2019-2020学年静安高三一模】
三.甲乙两组学生用不同的方法制备氯气并验证其性质。
甲组用漂白粉与硫酸溶液反应制取氯气:
Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O,如图1所示;
乙组用高锰酸钾与浓盐酸反应制取氯气:
2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,如图2所示(省略夹持装置)。
图1图2
32.实验中A选用装置____,E选用装置______(填写序号)。
IIIIII
33.装置F的作用,请描述装置G中的实验现象。
34.B中反应的离子方程式是;
C中氯气氧化了亚硫酸钠:
Cl2+SO32-+H2O→SO42-+2Cl-+2H+,请你帮甲组设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
_____。
35.乙组中H的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是_。
36.甲组实验存在的明显缺陷是___________________。
【2019-2020学年闵行高三一模】
将一定量的Cu和浓硫酸反应(装置中的夹持、加热仪器省略),反应后,圆底烧瓶内的混合液倒入水中,得到蓝色溶液与少量黑色不溶物。
36.反应后蓝色溶液呈酸性的原因有①________________,②____________________。
37.为检验反应产生气体的还原性,试剂a是___________________。
38.已知酸性:
H2SO3>H2CO3>H2S。
反应后测得Na2S和Na2CO3混合溶液中有新气体生成。
该气体中______(填“含或不含”)H2S,理由是_______________________;
39.少量黑色不溶物不可能是CuO的理由是______________________