第4章第2节第1课时 氯气文档格式.docx
《第4章第2节第1课时 氯气文档格式.docx》由会员分享,可在线阅读,更多相关《第4章第2节第1课时 氯气文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
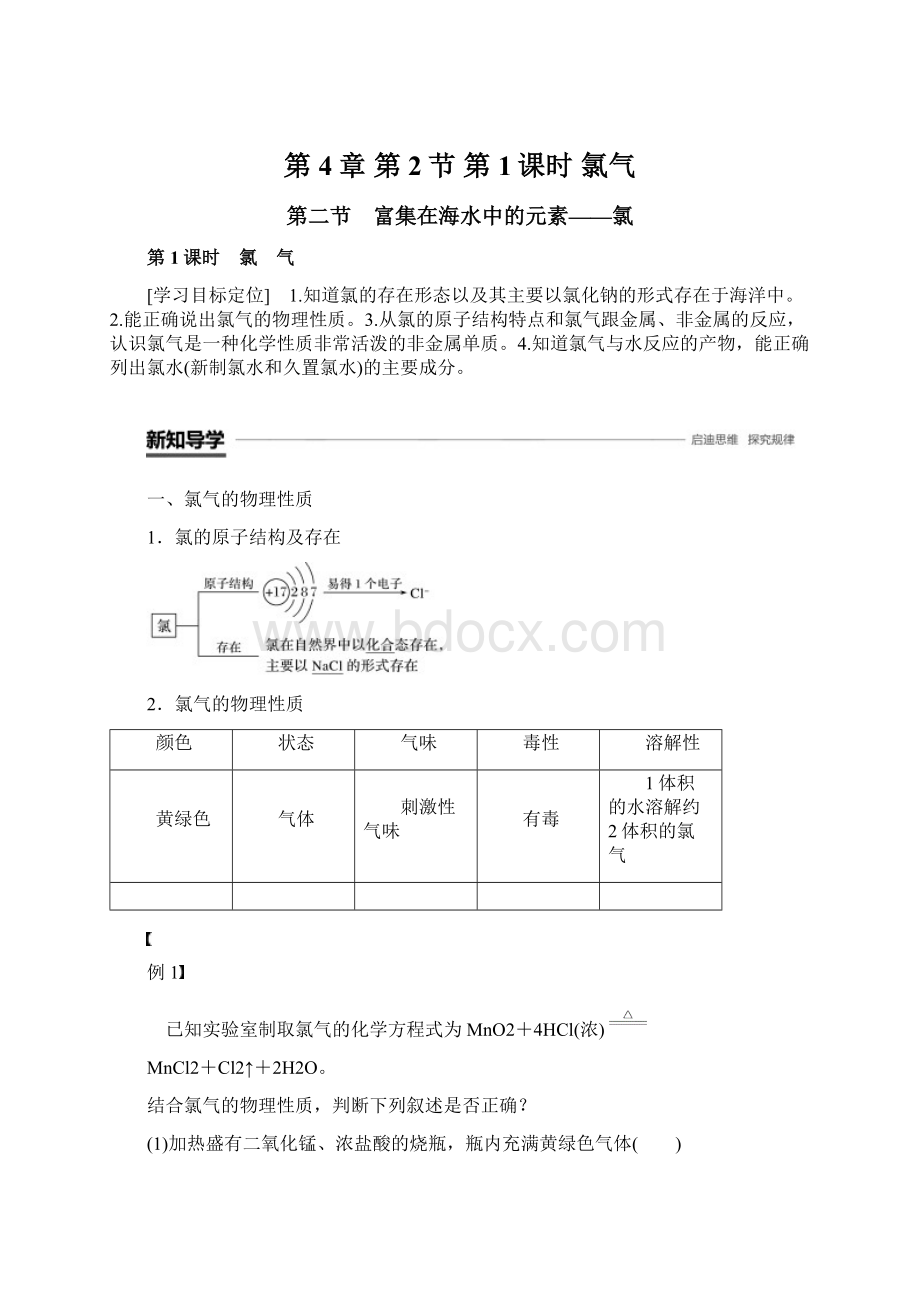
1体积的水溶解约2体积的氯气
例1
已知实验室制取氯气的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。
结合氯气的物理性质,判断下列叙述是否正确?
(1)加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体( )
(2)氯气的密度比空气大,常用向上排空气法收集氯气( )
(3)闻氯气气味时,用手轻轻在集气瓶瓶口扇动,使极少量氯气飘进鼻孔( )
(4)在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色( )
(5)氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态( )
答案
(1)√
(2)√ (3)√ (4)√ (5)√
解析 氯气是黄绿色有强烈刺激性气味的有毒气体;
氯气不仅可溶于水,而且还能与水反应,不能用排水法收集,常用向上排空气法收集。
例2
氯气可用于消灭田鼠,为此,可将氯气用软管通入到田鼠洞中,这是利用了氯气下列性质______(填序号)。
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤可溶于水
答案 ②③
解析 将氯气通入到田鼠洞中起灭鼠作用,一方面是利用其密度比空气大得多,可沉在洞底,另一方面是氯气有毒。
二、氯气与金属、非金属的反应
1.氯气与金属单质的反应
写出下列反应的化学方程式,并指明主要反应现象:
(1)与钠反应2Na+Cl2
2NaCl,产生大量白烟;
(2)与铁反应2Fe+3Cl2
2FeCl3,产生大量棕褐色烟;
(3)与铜反应Cu+Cl2
CuCl2,产生大量棕黄色烟。
2.氯气与非金属单质氢气的反应:
(1)在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中。
①观察到的现象是氢气在氯气中安静地燃烧,发出苍白色火焰。
②燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,观察到的现象是集气瓶口上方出现白雾。
③反应的化学方程式是H2+Cl2
2HCl。
(2)氯气和氢气的混合气体在强光照射时爆炸,产生此现象的原因是H2和Cl2混合后光照,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸。
(1)氯气是很活泼的非金属单质,具有很强的氧化性。
①氯气能与绝大多数金属反应,把变价金属(如Fe、Cu)一般氧化到最高价。
②氯气能与许多还原性化合物反应,如FeCl2溶液、KI溶液、SO2水溶液等。
(2)燃烧是指发热发光的剧烈的化学反应。
它强调的是①发光时也要发热;
②反应剧烈;
③实质是剧烈的氧化还原反应;
④不一定要有氧的参加。
例3
下列化合物中,不能通过两种单质间化合直接制取的是( )
A.FeCl3B.CuCl2C.HClD.FeCl2
答案 D
解析 Cl2与金属反应生成高价态的氯化物,所以FeCl2不能由两种单质直接化合制取。
例4
下列现象不属于H2在Cl2中燃烧现象的是( )
A.苍白色火焰B.瓶口有白雾
C.集气瓶内气体颜色变浅D.爆炸
解析 H2在Cl2中燃烧,发出苍白色火焰,瓶口因生成的HCl吸收空气中的H2O形成盐酸小液滴而形成白雾,瓶内气体颜色因Cl2的消耗而变浅,但不发生爆炸。
三、氯气与水的反应
1.氯水的性质
(1)氯气能溶于水,其水溶液俗称氯水。
按照表中要求完成氯水的性质实验,将实验现象及有关结论填入表中:
实验操作
实验现象
实验结论
有色布条不褪色
干燥氯气不具有漂白性
有色布条褪色
新制氯水具有漂白性
(2)新制氯水具有漂白性是因为氯气与H2O反应生成了HClO,反应的化学方程式是Cl2+H2O===HCl+HClO,该反应的氧化剂是Cl2,还原剂是Cl2。
2.次氯酸(HClO)的性质
(1)次氯酸是易溶于水的弱酸,比碳酸酸性弱,写离子方程式时不能拆成离子形式。
氯气和水反应的离子方程式:
Cl2+H2O===H++Cl-+HClO。
(2)次氯酸不稳定,见光易分解,反应的方程式:
2HClO
2HCl+O2↑。
(3)次氯酸具有强氧化性,其氧化性比Cl2强,可用于自来水的杀菌消毒,还可以用作漂白剂。
(1)光照氯水时,溶液中的次氯酸不断分解生成盐酸和氧气,溶液的浅黄绿色逐渐褪去,pH逐渐减小。
(2)实验室中氯水需现用现配。
保存氯水时,应避免光照、受热,实验室通常将氯水置于棕色试剂瓶中密封保存。
例5
下列关于氯水的叙述中正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
答案 B
解析 新制氯水成分的多样性决定了新制氯水性质上的多重性。
新制氯水中主要含有三种分子H2O、Cl2、HClO和四种离子H+、Cl-、ClO-、OH-;
新制氯水含有H+和HClO,蓝色石蕊试纸遇H+变红,变红后的试纸被HClO氧化褪色;
光照新制氯水,发生反应2HClO
2HCl+O2↑,逸出的是O2而不是Cl2;
该反应进行后,弱酸HClO转化为强酸HCl,密封在密闭无色玻璃瓶中不考虑HCl挥发,溶液的酸性增强。
例6
在新制氯水参加的反应中,有如下几种情况:
(1)向氯化亚铁溶液中加入氯水,氯水中起作用的主要微粒是________,反应的离子方程式为______________。
(2)向硝酸银溶液中加入氯水,氯水中起作用的主要微粒是________,反应的离子方程式为________________________________________________________________________。
(3)向氯水中滴加石蕊溶液,溶液变红,氯水中起作用的微粒是________,然后又褪色,起作用的微粒是______。
答案
(1)Cl2 Cl2+2Fe2+===2Fe3++2Cl-
(2)Cl- Ag++Cl-===AgCl↓ (3)H+ HClO
解析 考查新制氯水成分的多样性,要从新制氯水所含的微粒种类(Cl2、HClO、H+、Cl-等)来考虑。
特别提示——新制氯水的成分
1.判断正误(正确的打“√”,错误的打“×
”)
(1)氯元素在自然界中既可以以化合态存在,也可以以游离态存在( )
(2)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物( )
(3)氯气有毒,氯的化合物也都具有一定的毒性( )
(4)氯气可以使湿润的有色布条褪色( )
(5)氯气可以贮存在钢瓶中,说明Cl2与Fe不反应( )
(6)Cl2具有很强的氧化性,在化学反应中只能作氧化剂( )
(7)在NaClO溶液中通入CO2生成HClO,可证明碳酸酸性强于HClO( )
(8)工业上制盐酸需要的HCl是通过H2和Cl2光照条件下生成的( )
(9)任何物质的燃烧都必须有O2参与( )
(10)物质有发热发光的变化一定是燃烧( )
答案
(1)×
(2)×
(3)×
(4)√ (5)×
(6)×
(7)√ (8)×
(9)×
(10)×
2.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
答案 C
解析 闻气体的方法是用手轻轻的在瓶口扇动,仅使少量的气体飘入鼻孔,不能直接用鼻子闻,A不正确;
氯气密度比空气大,可用向上排空气法收集氯气,B不正确;
氯气是一种有毒的气体,氯气会顺着风向扩散,疏散时应该逆着风向转移,C正确;
氯气密度比空气大,泄漏时离地面越近氯气浓度越大,应尽量向高处逃生,D不正确。
3.下列关于氯气的叙述中正确的是( )
A.钠在氯气中燃烧产生白烟
B.红热的铜丝在氯气中燃烧生成CuCl
C.纯净的氢气可以在氯气中安静地燃烧,发出黄色火焰
D.氯气的水溶液可以导电,说明氯气是电解质
答案 A
解析 钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,A项正确;
红热的铜丝在氯气中燃烧生成CuCl2,B项错误;
氢气在氯气中燃烧发出苍白色火焰,C项错误;
Cl2是单质,既不是电解质,也不是非电解质,D项错误。
4.下列有关次氯酸的叙述不正确的是( )
A.次氯酸不稳定,易分解
B.次氯酸是一种强氧化剂
C.次氯酸是弱酸,但酸性比碳酸强
D.次氯酸能使染料和有机色质褪色
解析 HClO是一元弱酸,酸性比碳酸弱。
5.(2018·
西安83中期末)下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.使红色布条褪色(HCl)
B.将NaHCO3固体加入新制氯水,有无色气泡(H+)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
解析 A项,次氯酸具有强氧化性,能氧化有色布条而使其褪色,与氯化氢无关,错误;
B项,氯水显酸性,能与碳酸氢钠反应生成CO2气体,正确;
C项,氯气氧化了亚铁离子生成三价铁离子,再滴加KSCN溶液,发现呈红色,正确;
D项,氯离子和硝酸银反应生成氯化银白色沉淀,正确。
6.在第一次世界大战期间,有一次德军与英、法军在比利时对峙,黎明时,英、法军前线战壕的士兵突然看到一股黄绿色气体逐渐袭来,很快数百名英、法军战士窒息而死。
后来人们在打扫战场时发现跑到山坡上的士兵竟幸免于难。
(1)由上述事例可归纳出氯气的性质有_______________________________________
________________________________________________________________________。
(2)写出下列反应的化学方程式:
①铁丝在氯气中燃烧:
_________________________________________________。
②铁粉溶于盐酸中:
___________________________________________________。
③少量的铁粉溶于氯水中:
________________________________________________。
(3)将新鲜的花瓣放入干燥的氯气中可观察到的现象是______,原因是____________。
(4)氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸____________,反应的化学方程式为___________________________________。
答案
(1)黄绿色气体,有毒,密度比空气大
(2)①2Fe+3Cl2
2FeCl3
②Fe+2HCl===FeCl2+H2↑
③Fe+2HCl===FeCl2+H2↑,
2FeCl2+Cl2===2FeCl3
(3)花瓣褪色 新鲜的花瓣中含有水分,遇Cl2会产生HClO,HClO具有漂白性
(4)不稳定 2HClO
2HCl+O2↑
[对点训练]
题组一 氯的结构与单质的物理性质
1.(2018·
大连高一月考)生活中难免会遇到一些突发事件,我们要