高三一轮复习课件-盐类的水解优质PPT.ppt
《高三一轮复习课件-盐类的水解优质PPT.ppt》由会员分享,可在线阅读,更多相关《高三一轮复习课件-盐类的水解优质PPT.ppt(28页珍藏版)》请在冰豆网上搜索。
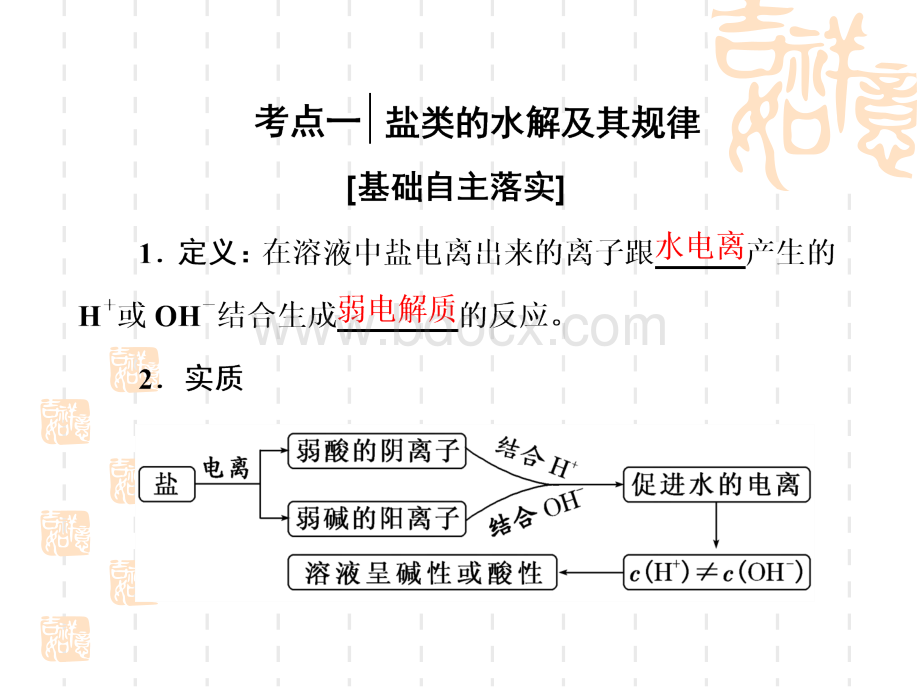
是指溶液中所有阳离子所带的正电荷数正电荷数等于溶液中等于溶液中所有阴离子所带的所有阴离子所带的负电荷数负电荷数。
整个溶液呈。
整个溶液呈电中性电中性。
Na+H+=CH3COO-+OH-(3)质子守恒:
水电离的特征是水电离的质子守恒:
水电离的特征是水电离的c(Hc(H+)=c(OH)=c(OH-)在纯水中在纯水中H+OH-OH-=H+CH3COOHNa2S溶液溶液Na+=S2-+HS-+H2S12Na+H+=OH-+2S2-+HS-OH-=H+HS-+2H2SH+守恒守恒练习:
写出溶液中的微粒浓度关系及三个守恒式练习:
写出溶液中的微粒浓度关系及三个守恒式溶液中离子浓度大小的比较溶液中离子浓度大小的比较一、单一盐一、单一盐(AB型)型)溶液中离子浓度大小的比溶液中离子浓度大小的比(考虑水解和电离)(考虑水解和电离)例例1:
在在NH4Cl溶液中各离子浓度的大小关系溶液中各离子浓度的大小关系是是c(Cl-)c(NH4+)c(H+)c(OH-)一般规律:
一般规律:
c(不水解离子)(不水解离子)c(水解离子)(水解离子)c(显性离子)(显性离子)c(不显性离子)(不显性离子)二、两溶液混合时离子浓度的大小比较二、两溶液混合时离子浓度的大小比较c(Cl-)c(NH4+)c(H+)c(OH-)1、两种物质恰好完全反应生成盐、两种物质恰好完全反应生成盐例例2:
等体积等浓度的氨水和盐酸反应,反应等体积等浓度的氨水和盐酸反应,反应后溶液中的离子浓度大小关系是:
后溶液中的离子浓度大小关系是:
_。
解析:
该反应的化学方程式为:
NH3H2O+HCl=NH4Cl+H2O因为是等体积等浓度反应,即反应后因为是等体积等浓度反应,即反应后只得到只得到NH4Cl溶液溶液(与例与例1同同),所以有:
,所以有:
(单一盐溶液单一盐溶液)故有:
故有:
c(NH4+)=c(CI-)c(OH-)=c(H+)2、两种物质反应,其中一种有剩余:
根据过、两种物质反应,其中一种有剩余:
根据过量程度考虑电离或水解量程度考虑电离或水解
(1)混合后溶液呈中性的离子浓度大小比较)混合后溶液呈中性的离子浓度大小比较例例3:
氨水和稀盐酸反应后的溶液呈氨水和稀盐酸反应后的溶液呈中性中性,反,反应后所得溶液中的离子浓度大小关系是应后所得溶液中的离子浓度大小关系是_。
由电荷守恒可得:
c(NH4+)+c(H+)=c(OH-)+c(CI-)又因为溶液呈中性,所以有:
又因为溶液呈中性,所以有:
c(OH-)=c(H+)c(NH4+)=c(CI-)
(2)混合后呈酸性或碱性的离子浓度大混合后呈酸性或碱性的离子浓度大小比较小比较c(NH4+)c(Cl-)c(OH-)c(H+)例例4:
c(H+)=110-4mol/L的盐酸与的盐酸与c(OH-)=110-4mol/L的氨水等体积反应后,溶的氨水等体积反应后,溶液中的离子浓度大小的关系是液中的离子浓度大小的关系是_。
NH4Cl=NH4+Cl-NH3H20OH-+NH4+解析:
由题目可知氨水过量,故溶液中存在由题目可知氨水过量,故溶液中存在有有NH4Cl和过量的和过量的NH3H2O,则由,则由NH3H2O的电离决定溶液呈碱性:
的电离决定溶液呈碱性:
若反应后所生成溶液中若反应后所生成溶液中,除盐外还有弱除盐外还有弱酸或弱碱过量,由这两种情况导致溶液的酸或弱碱过量,由这两种情况导致溶液的酸碱性不同。
若题中不给出具体的信息,酸碱性不同。
若题中不给出具体的信息,一般是弱电解质的电离程度大于水解程度,一般是弱电解质的电离程度大于水解程度,从而由弱酸或弱碱的电离确定溶液的酸碱从而由弱酸或弱碱的电离确定溶液的酸碱性。
性。
解析解析:
NaCN的水解趋势大于的水解趋势大于HCN的电离趋势的电离趋势,则有则有c(OH-)c(H+),根据电荷守恒根据电荷守恒:
c(CN-)c(OH-)c(Na+)c(H+)可以得出可以得出c(CN-)c(Na+),则有:
,则有:
例例5:
浓度都为浓度都为0.2mol/L的的NaCN和和HCN组成组成的溶液呈的溶液呈碱性碱性,则该,则该溶液中离子浓度大小的关系是溶液中离子浓度大小的关系是_。
或或c(Na+)c(CN-)c(Na+)c(CN-)c(OH-)c(H+)0.05mol/LCH3COOHCH3COONa1.1.0.2mol/L0.2mol/L的的CHCH33COOHCOOH溶液和溶液和0.1mol/LNaOH0.1mol/LNaOH溶液溶液等体积混合等体积混合0.05mol/LNHNH33HH22OONHNH44ClCl2.2.0.3mol/L0.3mol/L的的NHNH33HH22OO溶液和溶液和0.1mol/LHCl0.1mol/LHCl溶液溶液等体积混合等体积混合0.1mol/L知识拓展:
知识拓展:
1.0.5molSO2通入通入100ml5mol/LNaOH溶液溶液(离子浓度离子浓度)2.0.5molSO2通入通入200ml5mol/LNaOH溶液溶液(离子浓度离子浓度)3.将将SO2气体通入气体通入NaOH溶液中至中性溶液中至中性(离子浓度离子浓度)(已知已知SO32-:
HSO3-=1:
1时,时,pH=7.2)4.0.1molL1Na2CO3溶液与溶液与0.1molL1NaHCO3溶液溶液等体积混合等体积混合(判断)(判断)2/3c(Na)c(CO32-)c(HCO3-)c(H2CO3)5.常温下,常温下,PH7的氯化铵和氨水的混合液的氯化铵和氨水的混合液c(NH4)c(NH3H2O)c(Cl)NaHSO3Na+HSO3-H+SO32-OH-Na+HSO3-SO32-OH-=H+Na2SO3Na+SO32-OH-HSO3-H+33、向向0.2mol/LNaHCO0.2mol/LNaHCO33溶液中加入等体溶液中加入等体积0.1mol/L0.1mol/LNaOHNaOH溶液溶液0.05mol/LNaHCO3Na2CO344、常温下,将常温下,将0.2mol/L0.2mol/L弱酸弱酸HAHA与与0.1mol/LNaOH0.1mol/LNaOH溶液溶液等体积混合,溶液等体积混合,溶液PH=9PH=9微粒浓度大小比较微粒浓度大小比较电荷守恒:
电荷守恒:
。
物料守恒:
【NaNa+】-【AA-】=。
【HAHA】-【NaNa+】=。
11、离子浓度大小比较、离子浓度大小比较22、电荷守恒、电荷守恒33、物料守恒、物料守恒55、室温下,在、室温下,在25mL0.1mol/LNaOH25mL0.1mol/LNaOH溶液中逐滴溶液中逐滴加入加入0.2mol/LCH0.2mol/LCH33COOHCOOH溶液,溶液,pHpH与滴加与滴加CHCH33COOHCOOH溶溶液体积的关系曲线如图,下列说法错误的是液体积的关系曲线如图,下列说法错误的是AA在在AA、BB间任一点,溶液中一定都有间任一点,溶液中一定都有cc(Na(Na)cc(H(H)cc(CH(CH33COOCOO)cc(OH(OH)BB在在BB点:
点:
aa12.512.5,且,且:
cc(Na(Na)cc(CH(CH33COOCOO)cc(OH(OH)cc(H(H)CCCC点:
cc(CH(CH33COOCOO)cc(Na(Na)cc(H(H)cc(OH(OH)DDDD点:
cc(CH(CH33COOCOO)cc(CH(CH33COOH)COOH)0.2mol/L0.2mol/L66、等浓度的等浓度的NaANaA溶液溶液NaBNaB溶液,已知溶液,已知PHPH,则酸性,则酸性HAHAHBHB,【HAHA】【HBHB】,【AA-】【BB-】;
等浓度等体积的等浓度等体积的NaANaA溶液和溶液和NaBNaB溶液混合后,微粒浓溶液混合后,微粒浓度大小关系度大小关系。
77、0.2mol/L0.2mol/L的的CHCH33COONaCOONa溶液和溶液和0.1mol/L0.1mol/L的盐酸等体积的盐酸等体积混合后混合后PH7PHCHCH33COOCOO-ClCl-HH+OHOH-ClCl-+OHOH-HH+CHCH33COOHCOOH(填填“”、“”或或“”)
【变式变式11、】现向现向100mL0.1mol100mL0.1molLL11NHNH44HSOHSO44溶液中滴加溶液中滴加0.1mol0.1molLL11NaOHNaOH溶液,如下图溶液,如下图试分析图中试分析图中aa、bb、cc、dd、ee五个点,五个点,水的电离程度最大的是水的电离程度最大的是_;
在在cc点,溶液中各离子浓度由大到小的排列顺点,溶液中各离子浓度由大到小的排列顺序是序是_。
bNaSO42-NH4+OHH【变式变式33】常温下,常温下,0.1mol/L0.1mol/L的的HCOONaHCOONa溶液的溶液的PHPH为为1010,则,则HCOOHHCOOH的电离常数的电离常数KKaa=。
【变式变式22】已知已知酸性酸性HFHFHHClOClO,则则等体积等物质的等体积等物质的量浓度的量浓度的KKFF与与KKClOClO溶液中溶液中:
(填填“”“”“”或或“=”)cc(KK+)-)-cc(FF-)cc(KK+)-)-cc(ClOClO-)离子总数:
离子总数:
NN前前NN后后【变式变式44】常温下,将常温下,将amolamolLL11HCOOHHCOOH和和0.1mol0.1molLL11NaOHNaOH溶液等体积混合,所得溶液的溶液等体积混合,所得溶液的pH=5pH=5,则,则HCOOHHCOOH的电离常数的电离常数K=_(K=_(用含用含aa的代数式表示的代数式表示)。
(用精确值)。
(用精确值)