中考化学专题复习实验探究题Word文件下载.docx
《中考化学专题复习实验探究题Word文件下载.docx》由会员分享,可在线阅读,更多相关《中考化学专题复习实验探究题Word文件下载.docx(10页珍藏版)》请在冰豆网上搜索。
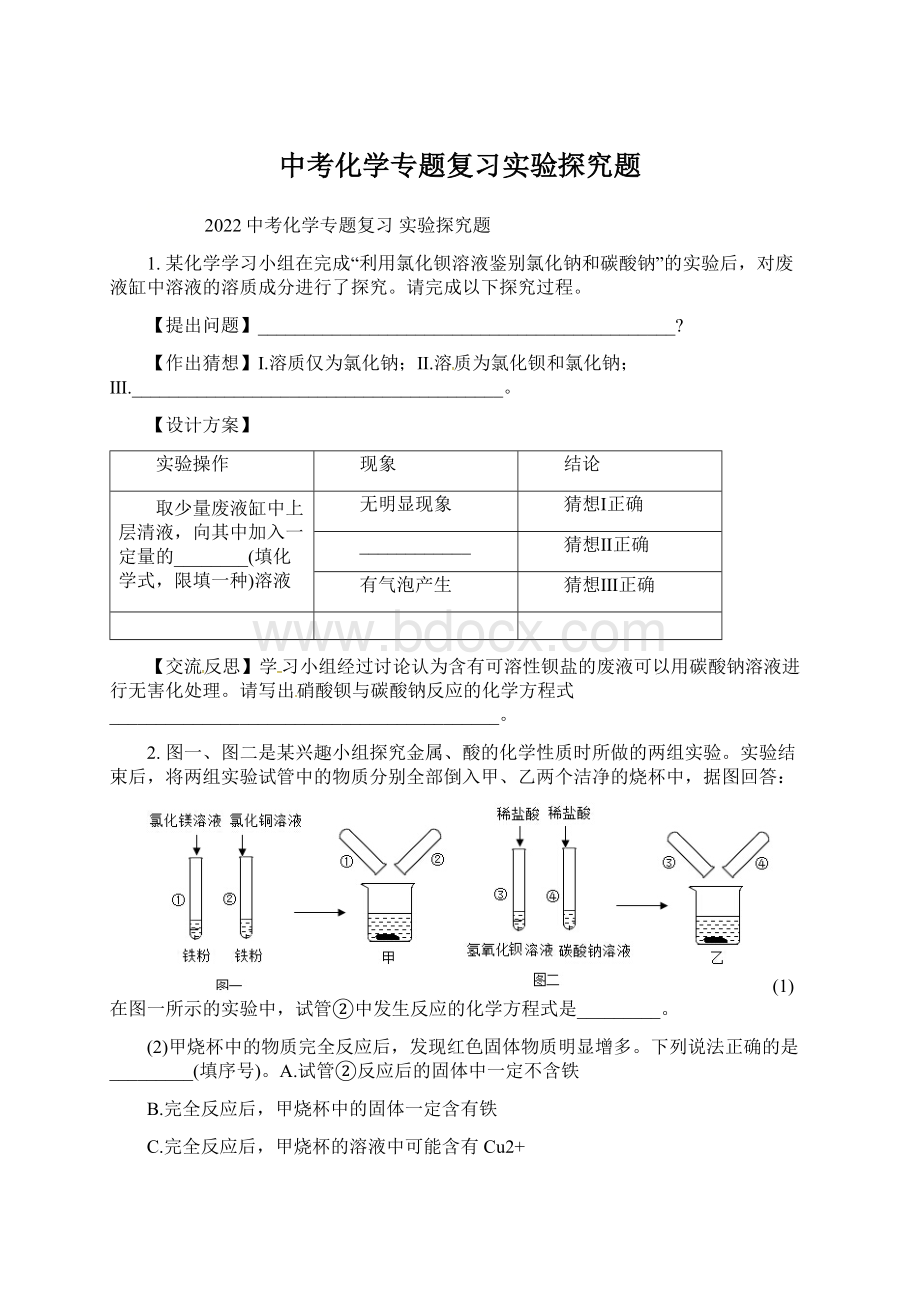
猜想Ⅲ正确
【交流反思】学习小组经过讨论认为含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。
请写出硝酸钡与碳酸钠反应的化学方程式__________________________________________。
2.图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。
实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
(1)在图一所示的实验中,试管②中发生反应的化学方程式是_________。
(2)甲烧杯中的物质完全反应后,发现红色固体物质明显增多。
下列说法正确的是_________(填序号)。
A.试管②反应后的固体中一定不含铁
B.完全反应后,甲烧杯中的固体一定含有铁
C.完全反应后,甲烧杯的溶液中可能含有Cu2+
D.完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+
(3)乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。
则试管④反应后的溶液中的溶质共有哪些_________(写化学式)。
(4)将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
实验现象
实验结论
步骤1:
取少量滤液于试管中,向其中滴加足量硝酸钡溶液
有白色沉淀生成
①生成的白色沉淀是_________(写化学式,下同)
②滤液中的溶质共有哪些_________
步骤2:
静置,向上层清液中滴加无色酚酞试液
溶液变红
(5)在上述(4)的实验探究中,步骤1中加入足量硝酸钡溶液的目的是_________。
3.
(1)现在很多家庭自备干粉灭火器,其中一种灭火器是利用压缩的二氧化碳吹干粉(干粉的主要成分是磷酸二氢铵)灭火。
①灭火器中的二氧化碳可利用空气中含量最多的气体来代替,该气体是________(填化学式)。
②钢是铁的合金,属于________(填“金属材料”或“合成材料”)。
③磷酸二氢铵(NH4H2PO4)受热分解生成磷酸(H3PO4)和氨气,并吸收大量的热,并能在可燃物表面形成一层玻璃状的覆盖层,该反应的化学方程式是______________。
(2)利用下图装置完成两个实验。
(白磷的着火点为40℃,红磷的着火点为240℃)
若挤压左侧滴管1,一段时间后,加热燃烧管至240℃以上。
①双球管中发生反应的化学方程式为__________________。
②燃烧管中白磷和红磷均不燃烧,其原因是_________________。
若挤压右侧滴管2,一段时间后,微热燃烧管至80℃。
③双球管中发生反应的化学方程式为_______________。
④得出可燃物燃烧需要温度达到着火点的结论,对应的现象是__________________。
4.连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一。
它的产品除了纯碱外,还有氯化钙和碳酸氢钠。
该厂生产纯碱的工艺流程可简单表示如图1:
2其生产过程中涉及的主要化学反应有:
NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3
②2NaHCO3Na2CO3+CO2↑+H2O
请回答:
(1)①“碳化”过程中需要的CO2,可由石灰石高温煅烧得到,该反应的化学方程式为.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是;
干燥CO2气体,可用的干燥剂是(填字母).
A.浓硫酸
B.固体氢氧化钠
C.生石灰
(2)①该厂“过滤”所得的NH4Cl可作化肥中的___肥,它也可与Ca(OH)2在加热时发生反应生成产品CaCl2,同时还有NH3和H2O生成,写出该反应的化学方程式:
__.该厂的另一种产品碳酸氢钠俗称___,它的重要用途有(只写一种).
②实验室进行“过滤”操作时,下列说法正确的有___(填字母)
A.使用的漏斗叫长颈漏斗
B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌
D.漏斗下端的管口要紧靠烧杯内壁
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:
优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:
称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70g.通过计算判断该厂的产品是否属于优等品___.(杂质可溶于水且不与氯化钡反应)
方案二:
用图2所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。
该装置中仪器A的名称是,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是.(装置的气密性良好)5.
碳酸钙可用于预防和治疗钙缺乏症。
某实验小组要测定一种钙片中碳酸钙的含量。
【查阅资料】
①补钙剂中常加入糖类、维生素D等,这些物质不与稀盐酸反应产生气体。
②氢氧化钠溶液能与二氧化碳发生反应。
【方案设计】根据资料和已学知识,该小组同学设计如下方案进行测定。
(装置见图)将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量(不考虑盐酸的挥发)。
(1)写出图中B装置中发生反应的化学方程式:
______。
记录数据如下(锥形瓶质量为100g,加入钙片质量为25g);
实验编号
①
②
③
④
加入稀盐酸的质量
100g
200g
300g
400g
充分反应后锥形瓶及杯内物质总质量
222.8g
320.6g
418.4g
518.4g
【分析和评价】
(2)要使测定结果更准确,反应前、后都要通入空气,目的是______。
(3)经过计算,该钙片中碳酸钙的质量分数是______。
【交流反思】碳酸钙除了可以补钙外,还有很多用途,请你再写出一种它的用途______。
6.小明同学用木炭测定空气中氧气体积分数,并对反应后的溶液成分进行探究。
他设计实验如图,当燃烧停止,冷却后振荡集气瓶,再将导管插入石灰水中,打开止水夹,看到瓶中溶液产生白色沉淀。
过滤出沉淀,滤液中溶质的成分有几种可能(不考虑生成NaHCO3),请你参与探究:
[猜想与假设]①NaOH和Na2CO3
②Na2CO3
③NaOH
④NaOH和Ca(OH)2
小霞认为猜想②错误,理由是
(1)_________________________________
[设计实验]为了证明①和③是那种可能,设计的方案是:
向滤液中滴加过量的
(2)_______________看到现象是(3)_______________,再向其中滴加(4)_______________看到明显现象,说明是①的可能而不是③的可能。
在设计方案证明④时,晓霞认为向滤液中通入适量的二氧化碳至沉淀最多,再证明氢氧化钠,根本无法观察现象,于是她认为若④中氢氧化钠有足够量,就将滤液蒸干得到固体,再证明,方法是(5)_______。
[反思交流]若生成的二氧化碳全部被氢氧化钠溶液吸收,装置气密性良好,导管中也灌满了石灰水,震荡后冷却室温打开止水夹,为什么进入瓶中的液体不到瓶中空气体积的1∕5。
原因是瓶中发生反应(写化学方程式)(6)__________________造成的。
7.请你和同学们一起完成下列实验.
(1)用浓盐酸(溶质质量分数为37%,密度为1.18g/mL)配制200g10%的稀盐酸.
①配制的主要步骤为:
计算、________、溶解.
②设需浓盐酸的体积为V,请列出V的计算式________
(不必算出结果).
③现提供甲图仪器,仪器a的名称为________;
配制过程中还需要的仪器有________.
(2)现提供乙图装置.
①实验室制取CO2,发生和收集装置应选用 ________(填序号),发生反应的化学方程式为 ________
.实验结束,从反应残留物中提取固体溶质时,按如丙图流程操作.此流程中,操作Ⅰ的名称是________,操作Ⅱ的名称是________.
②如选用另一发生装置制取某种气体,发生反应的化学方程式为 ________
.
8.学校化学探究小组为研究影响石灰石与稀盐酸反应速率的因素,于是进行了以下探究:
(1)小胡设计的实验方案:
取颗粒大小不同的等质量石灰石放入足量稀盐酸中,观察反应的现象。
写出石灰石与稀盐酸反应的化学方程式______,班级同学通过讨论对小胡设计的实验方案提出质疑,请你指出小胡设计方案的不科学之处是______。
【提出猜想】猜想1:
可能温度有关;
猜想2:
可能与石灰石颗粒大小有关。
【设计并实验】
小明按照如图实验装置进行实验,并比较收集50mL二氧化碳的时间:
温度(℃)
石灰石颗粒大小
稀盐酸浓度(%)
收集50mL二氧化碳的时间(S)
20
块状
10%
85
粉状
42
30
67
31
(2)实验装置还要增加一个量筒,其作用是______;
(3)实验中为了减少二氧化碳溶解在水中导致误差较大,我们可以采取的措施是______。
【得出结论】
(4)通过实验中①③对比,得出的结论是______;
若比较石灰石颗粒大小对该反应的影响,可以通过实验______(写实验编号)对比。
【交流与反思】
(5)除了上述比较反应快慢的方法外,还有比较反应快慢的方法是______。
(6)影响石灰石与稀盐酸反应速率的因素还可能有______,请设计实验验证(简要写出操作步骤)______。
9.我校化学兴趣小组同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究。
【知识回放】通过判断上述四种溶液两两之问能否发生反应,我能写出其中一个中和反应的化学方程式:
【实验探究】
图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl和NaOH在水中会解离出相应离子,以此类推硝酸钡在水中会解离出和______填离子符号。
图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为______,溶液中和浓度减小,我用同样的方式表示碳酸钾与稀硫酸反应的实质是:
,溶液中和浓度减小。
通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和溶液能发生复分解反应,因为溶液中的和不能大量共存;
溶液和溶液也可以发生复分解反应,因为和在溶液中______填“能”或“不能”大量共存;
NaOH和溶液不能发生复分解反应,因为______填微粒符号和、能大量共存。
【实验结论】通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是:
复分解反应的实质是离子交换的反应。
只要反应物中某些离子以沉淀、气体或水分子的形式使其浓度减小了。
复分解反应就可以发生。
【实验拓展】同学们利用图3装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器测量反应过程中相关物理量的变化情况,得到图3和图4。
根据曲线分析,实验前烧杯中装有______