高一化学复习精品讲义必修1氯及其化合物新人教版Word格式文档下载.docx
《高一化学复习精品讲义必修1氯及其化合物新人教版Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《高一化学复习精品讲义必修1氯及其化合物新人教版Word格式文档下载.docx(16页珍藏版)》请在冰豆网上搜索。
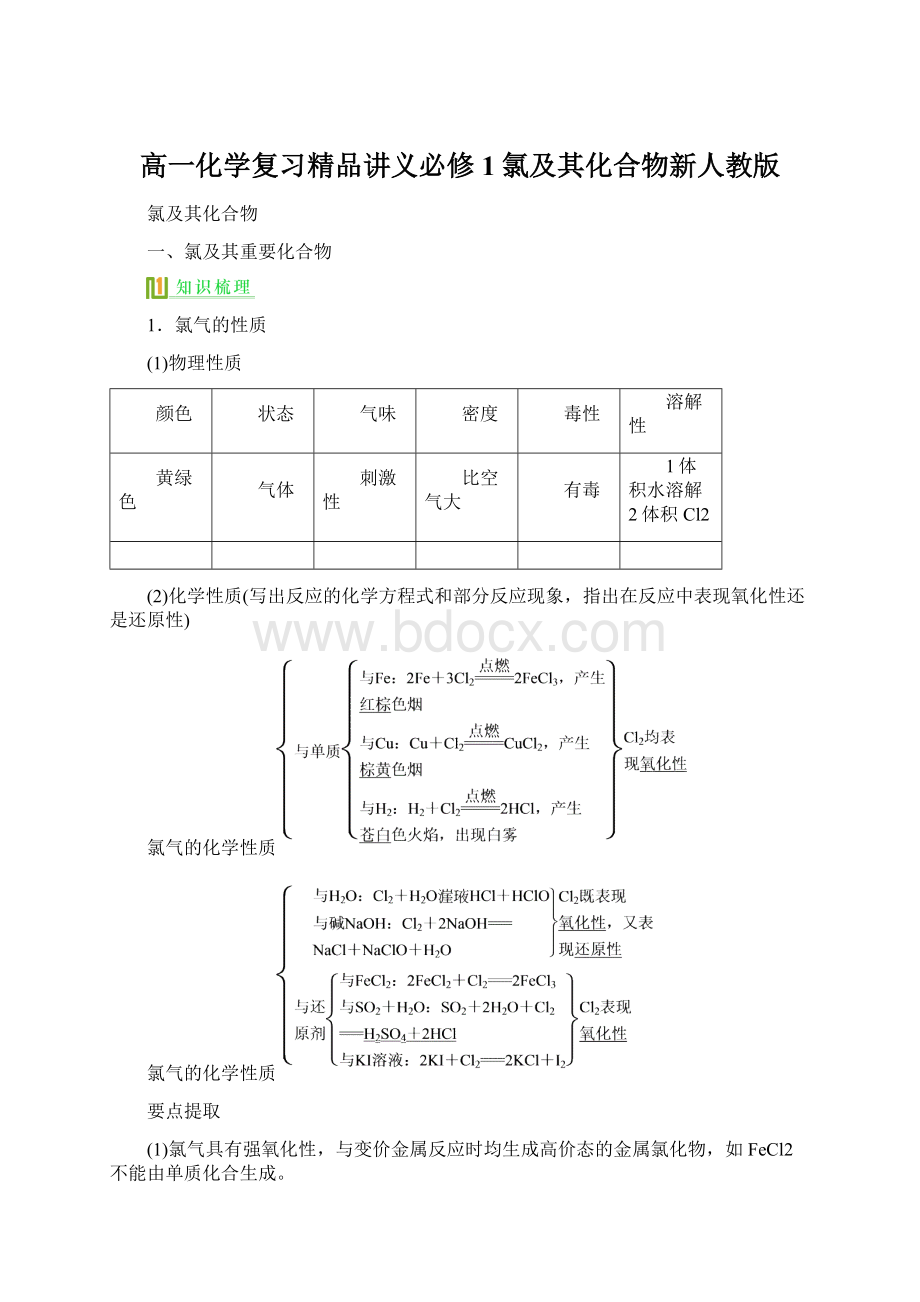
氯气的化学性质
要点提取
(1)氯气具有强氧化性,与变价金属反应时均生成高价态的金属氯化物,如FeCl2不能由单质化合生成。
(2)氯气没有漂白性,不能使干燥的有色布条褪色,但可使湿润的有色布条褪色,实际起漂白作用的是HClO。
2.氯的重要化合物
(1)次氯酸
(2)漂白粉
(1)HClO不稳定,不能单独存在,只存在于氯水、次氯酸盐溶液或次氯酸盐与酸反应的混合物中。
(2)不能用pH试纸测量氯水的pH,原因是氯水中的HClO具有漂白性。
(3)工业上制取漂白粉是用氯气与石灰乳反应制得,而不是用氯气与石灰水反应。
【互动思考】
1.将Cl2通入石蕊试液中的现象是什么?
能用pH试纸测定氯水的pH吗?
答案将Cl2通入石蕊试液中的现象是先变红后褪色。
不能用pH试纸测定氯水的pH,因为氯水中的HClO能将pH试纸漂白。
2.氯水中的平衡体系有哪些?
答案氯水中存在三个平衡体系。
一是Cl2+H2OHCl+HClO的化学平衡;
二是HClOH++ClO-的电离平衡;
三是H2OH++OH-的电离平衡。
3.我们日常生活中常见的漂白粉的有效成分是________,“84”消毒液的有效成分是________,均是次氯酸盐,在空气中与H2O、CO2反应生成________,而具有杀菌消毒作用。
答案Ca(ClO)2NaClOHClO
题组一氯气和氯水的性质
1.下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是()
A.FeCl2B.AlCl3C.FeCl3D.CuCl2
答案B
解析因为Cl2具有较强的氧化性,当Cl2与金属反应时,都可把金属氧化成最高价态的金属氯化物,而盐酸中H+的氧化能力较弱,只能把Fe氧化成Fe2+,而不能把Cu氧化。
2.(2019·
江苏,13)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
解析A项,氯水因含氯分子而呈浅黄绿色,正确;
B项,Ag+与Cl-生成AgCl白色沉淀,正确;
C项,碳酸氢钠与酸发生反应:
H++HCO===H2O+CO2↑,正确;
D项,氯水中含有氯单质,也可与Fe2+发生反应:
2Fe2++Cl2===2Fe3++2Cl-,无法说明氯水中含有HClO,错误。
答案D
3.氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。
下列结论正确的是()
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
解析A项,氯水能使有色布条褪色是因为氯水中含有的HClO具有强氧化性;
C项,由于加入盐酸酸化的过程中引入了Cl-,所以根据生成白色沉淀无法说明氯水中是否存在Cl-;
D项,因Cl2、HCl和HClO均能与NaOH溶液反应,所以加入NaOH溶液时氯水颜色消失不能说明其中有HClO存在。
氯水的多重性质
氯水的各种成分决定了它具有多重性质:
1.Cl2的氧化性——与还原性物质反应。
如:
2FeCl2+Cl2===2FeCl3(除去FeCl3溶液中的FeCl2)
SO2+Cl2+2H2O===2HCl+H2SO4(SO2和Cl21∶1混合物通入水中不再具有漂白性)
Na2SO3+Cl2+H2O===2HCl+Na2SO4(除去水中的余氯)
2.HCl酸性和Cl-的性质
向NaHCO3溶液中加入氯水,有气泡产生就是利用了盐酸的酸性。
加入AgNO3溶液可以检验出氯水中的Cl-,现象是有白色沉淀生成。
3.HClO的氧化性
在解释漂白性、杀菌消毒时,使用的是HClO的氧化性。
向氯水中滴加紫色石蕊溶液,先变红(H+作用的结果),后褪色(HClO作用的结果)。
题组二从平衡移动的角度分析氯水中的变化
4.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是()
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
答案C
解析饱和氯水不能再溶解氯气,各成分的浓度不变,A项错;
SO2+Cl2+2H2O===2HCl+H2SO4,Cl2+H2OH++Cl-+HClO的平衡左移,HClO的浓度减小,漂白性减弱,B项错;
加入少量的碳酸钠粉末,消耗H+,使上述平衡正向移动,HClO的浓度增大,C项正确;
光照过程中,HClO分解,生成O2和HCl,溶液中的离子浓度增大,导电性增强,D项错误。
5.饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。
某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因:
________________________________________________________________________
________________________________________________________________________。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份________________________________________________________________________;
第二份________________________________________________________________________。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)__________________________________________。
答案
(1)由于饱和氯水中存在Cl2+H2OH++Cl-+HClO,加入CaCO3后,2HCl+CaCO3===CaCl2+CO2↑+H2O,使平衡右移,HClO的浓度增大
(2)Ca2++HCO+OH-===CaCO3↓+H2O
HCO+H+===CO2↑+H2O
(3)CaCl2、Ca(HCO3)2、HClO
解析饱和氯水中存在Cl2+H2OHCl+HClO的平衡体系,加入过量CaCO3后,2CaCO3+2HCl===Ca(HCO3)2+CaCl2,CaCO3+2HCl===CaCl2+CO2↑+H2O,使HCl浓度减小,平衡右移,Cl2浓度减小,溶液黄绿色褪去;
HClO浓度增大,溶液漂白性增强。
由于滤液中含有HClO、CaCl2、Ca(HCO3)2等成分,Ca(HCO3)2与Ca(OH)2反应生成CaCO3沉淀;
与HCl反应产生CO2气体;
Ca(HCO3)2受热分解生成CaCO3沉淀和CO2气体。
1.氯水成分寻找方法
氯水中存在三个平衡关系:
(1)Cl2+H2OHCl+HClO
(2)HClOH++ClO-
(3)H2OH++OH-
根据可逆反应的特点,即可得出氯水中存在的各种微粒。
2.Cl2+H2OHCl+HClO平衡移动的应用
向氯水中加入的物质
浓度变化
平衡移动的方向
应用
可溶性氯化物
c(Cl-)增大
左移
①用饱和食盐水除Cl2中的HCl
②用排饱和食盐水法收集Cl2
盐酸
c(H+)和c(Cl-)增大
次氯酸盐与浓盐酸反应制Cl2
NaOH
c(H+)减小
右移
用NaOH溶液吸收多余Cl2
Ca(OH)2
制漂白粉
CaCO3
制高浓度的HClO溶液
光照
c(HClO)减小
氯水避光保存或现用现配
二、氯气的实验室制法和性质探究
1.实验装置
2.制取过程
―→用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸制取Cl2:
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
―→
(1)必须用浓盐酸,MnO2与稀盐酸不反应。
(2)为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,减少HCl的挥发。
(3)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
(4)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
1.实验室用MnO2和浓盐酸来制取氯气,主要操作有:
①将蒸馏烧瓶固定在铁架台上;
②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定好铁圈,放好石棉网;
③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中;
④检查气密性;
⑤在蒸馏烧瓶上装好分液漏斗,连接好导管。
最好的实验操作顺序是________。
答案 ②①⑤④③
题组一 氯气制备原理、装置的考查
1.实验室制备氯气的装置如下图。
图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①B.②C.③D.④
答案 C
解析 装置③的导气管长短错误,应长进短出。
2.实验室用下列两种方法制氯气:
①用含HCl146g的浓盐酸与足量的MnO2反应;
②用87gMnO2与足量浓盐酸反应。
所得的氯气( )
A.①比②多B.②比①多
C.一样多D.无法比较
答案 B
解析 146gHCl的物质的量为4mol,87gMnO2的物质的量为1mol,由方程式:
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O知,1molMnO2可以与4molHCl反应,但是,应注意稀盐酸与MnO2不反应,也就是说1molMnO2与足量浓盐酸反应生成的Cl2多。
实验室用MnO2和浓盐酸制取Cl2时应注意以下四点
1.为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl的挥发。
2.必须用浓盐酸加热才可反应,稀盐酸不反应。
3.实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
4.尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
题组二 氯气制备与性质实验的综合考查
3.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持及加热仪器已略)。
(1)制备氯气选用的药品