全国化学高考新课标1试题及答案Word文档下载推荐.docx
《全国化学高考新课标1试题及答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《全国化学高考新课标1试题及答案Word文档下载推荐.docx(14页珍藏版)》请在冰豆网上搜索。
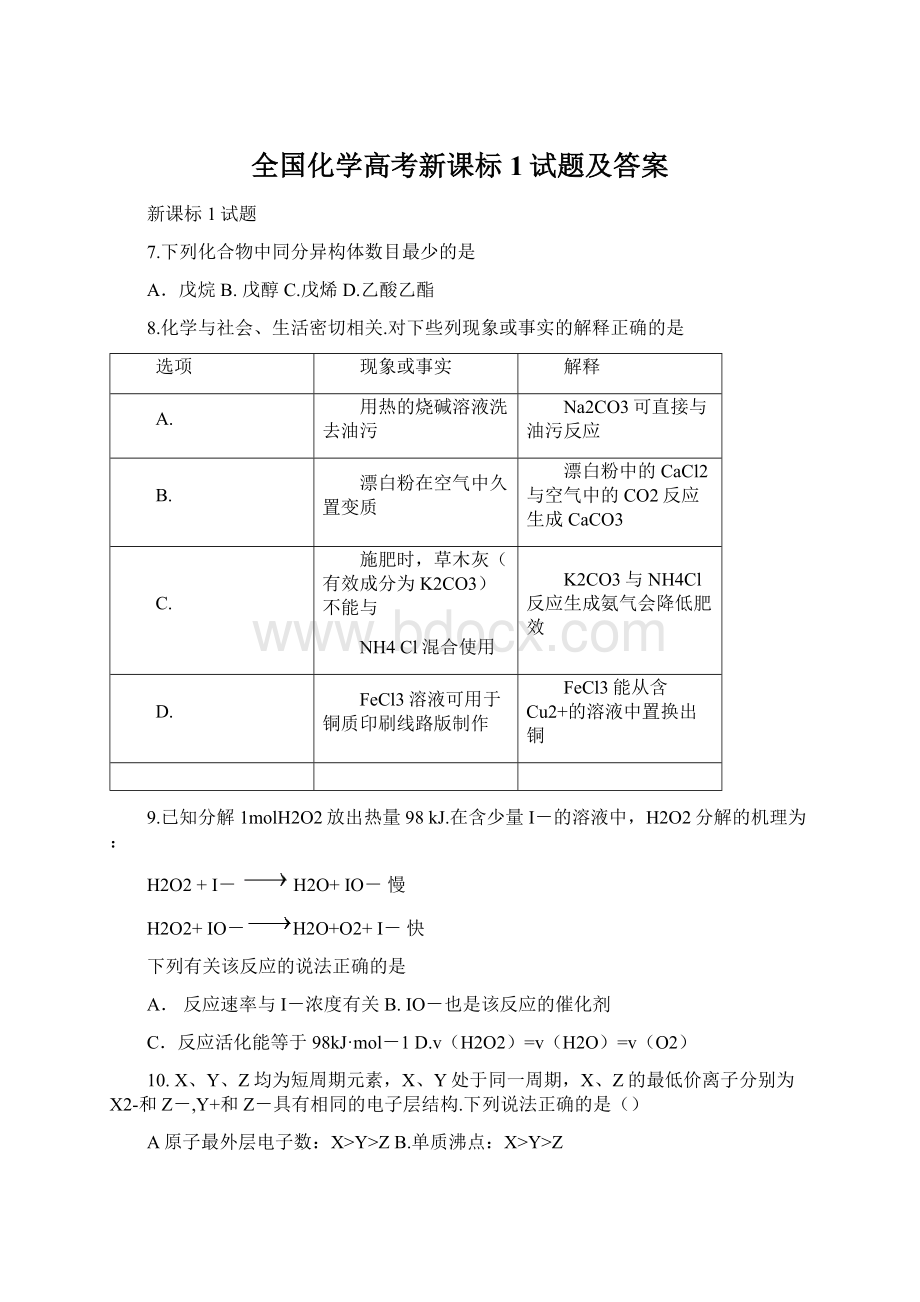
9.已知分解1molH2O2放出热量98kJ.在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-H2O+IO-慢
H2O2+IO-H2O+O2+I-快
下列有关该反应的说法正确的是
A.反应速率与I-浓度有关B.IO-也是该反应的催化剂
C.反应活化能等于98kJ·
mol-1D.v(H2O2)=v(H2O)=v(O2)
10.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是()
A原子最外层电子数:
X>
Y>
ZB.单质沸点:
Z
C.离子半径:
X2->
Y+>
Z-D.原子序数:
11.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是()
A.溴酸银的溶液是放热过程
B.温度升高时溴酸银溶解速度加快
C.60℃时溴酸银的Ksp约等于610
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
12.下列有关仪器使用方法或实验操作正确的是()
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
13.利用右图所示装置进行下列实验,能得出相应实验结论的是()
①
②
③
实验结论
A
稀硫酸
Na2S
AgNO3与AgCl的浊溶液
Ksp(AgCl)>
Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:
硝酸>
碳酸>
硅酸
26.(13分)
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、
装置示意图和有关数据如下:
相对分子质量
密度/(g·
cm-3)
沸点/C
水中溶解性
异戊醇
88
0.8123
131
微溶
乙酸
60
1.0492
118
溶
乙酸异戊酯
130
0.8670
142
难溶
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是
(2)在洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是.
在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号).
a直接将乙酸异戊酯从分液漏斗的上口倒出
b直接将乙酸异戊酯从分液漏斗的下口放出
c先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
⑷本实验中加入过量乙酸的目的是.
⑸实验中加入少量无水MgSO4的目的是.
⑹在蒸馏操作中,仪器选择及安装都正确的是(填标号).
⑺本实验的产率是.
a、30℅b、40℅c、60℅d、90℅
⑻在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏(填“高”或“低”),其原因是
27、(15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一种中元强酸,写出其电离方程式:
⑵H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为(填化学式).
2NaH2PO2为(填“正盐”或“酸式盐”),其溶液显性(填“弱酸性”、“中性”、或“弱碱性”).
2H3PO2的工业制法是:
将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式.
⑷H3PO2也可以通过电解的方法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
1写出阳极的电极反应式.
2分析产品室可得到H3PO2的原因.
3早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有_______杂质,该杂质产生的原因是:
28.(15分)
乙醇是重要的有机化工原料,可由乙烯气相直接水合成法或间接水合法生产.回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇.写出相应反应的化学方程式________________.
(2)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9kJ·
mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4(g)+2H2O(g)△H2=-29.1kJ·
乙醇异构化反应C2H5OH(g)=CH3OCH3(g)△H3=-93.7kJ·
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=______kJ·
mol-1.与间接水合法相比,气相直接水合法的优点是__________.
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中nH2O:
nC2H4=1:
1).
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=______(用平衡分压代替平衡浓度计算,分压=总压×
物质的量分数).
②图中压强(p1、p2、p3、p4)的大小顺序为______,理由是______.
③气相直接水合法常采用的工艺条件为:
磷酸/硅藻土为催化剂,反应温度290℃、压强6.9MPa,nH2O:
nC2H4=0.6:
1.乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______、______.
36.【化学------选修2:
化学与技术】
(15分)
磷矿石主要以磷酸钙[Ca3(PO4)2·
H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程.
部分物质的相关性质如下:
熔点/℃
沸点/℃
备注
白磷
44
280.5
PH3
-133.8
-87.5
难溶于水,有还原性
SiF4
-90
-86
易水解
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的______%.
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为___________.
现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸______t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2,过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是______(填化学式).冷凝塔1的主要沉积物是______,冷凝塔2的主要沉积物是______.
(4)尾气中主要含有______,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去______;
再通入次氯酸钠溶液,可除去______.(均填化学式)
(5)相比于湿法磷酸、热法磷酸工艺复杂,能耗高,但优点是______.
37.【化学------选修3:
物质结构与性质】
早期发现的一种天然准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______方法区分晶体、准晶体和非晶体.
(2)基态Fe原子有______个未成对电子,Fe3+的电子排布式为______,可用硫氰化钾检验Fe3+,形成的配合物的颜色为______.
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O,乙醛中碳原子的杂化轨道类型为______,1mol乙醛分子中含有的σ键的数目为______.乙酸的沸点明显高于乙醛,其主要原因是______.Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子.
(4)Al单质为面心立方晶体,其晶胞参数α=0.405nm,晶胞中铝原子的配位数为______.列式表示Al单质的密度______g·
cm-1(不必计算出结果).
38.【化学—选修5:
有机化学基础】
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下:
已知以下信息:
1
21molB经上述反应可生成2molC,且C不能发生银镜反应
3D属于单取代芳烃,其相对分子质量为106
4核磁共振氢谱显示F苯环上有两种化学环境的氢
5
(1)由A生成B的化学方程式为,反应类型是.
(2)D的化学名称是,由D生成E的化学方程式为.
(3)G的结构简式是.
(4)F的同分异构体中含有苯环的还有种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:
2:
1的是(写出其中一种的结构简式).
(5)由苯及化合物C经如下步骤可合成N-异丙基苯胺:
反应条件1所选用的试剂为,反应条件2所选用的试剂为,I的结构简式为.
新课标1答案解析
7【答案】A
【解析】A.选项戊烷有正异新三种同分异构体
B.选项戊醇可形成醇和醚两种类别同分异构体,数量远多于3种
C.选项戊烯存在环戊烷和顺反异构,多于3种
D.选项存在酸、酯、醇醛等多种类别,多于3种
8【答案】C
【解析】A.烧碱为NaOH.纯碱为Na2CO3.前后不符.热的纯碱Na2CO3溶液可去油污,Na2CO3水解溶液为碱性,越热越水解,碱性增强,促进油脂水解,可去油污.
B.选项漂白粉变质是其有效成分Ca(ClO)2与空气中的CO2反应生成CaCO3和HClO,CaCl2与空气中的CO2不会反应.
C.选项草木灰K2CO3与NH4Cl双水解,生成氨气,氮元素损失,会降低肥效.
D.选项制作印刷线路板的原理是2FeCl3+Cu=CuCl2+FeCl2.氯化铁和铜离子并不会反应.
9【答案】A
【解析】此反应为双氧水的分解反应.2H2O2=2H2O+O2I-为催化剂.
A.选项总