届高考化学难点剖析专题40化学平衡常数计算练习Word文档格式.docx
《届高考化学难点剖析专题40化学平衡常数计算练习Word文档格式.docx》由会员分享,可在线阅读,更多相关《届高考化学难点剖析专题40化学平衡常数计算练习Word文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
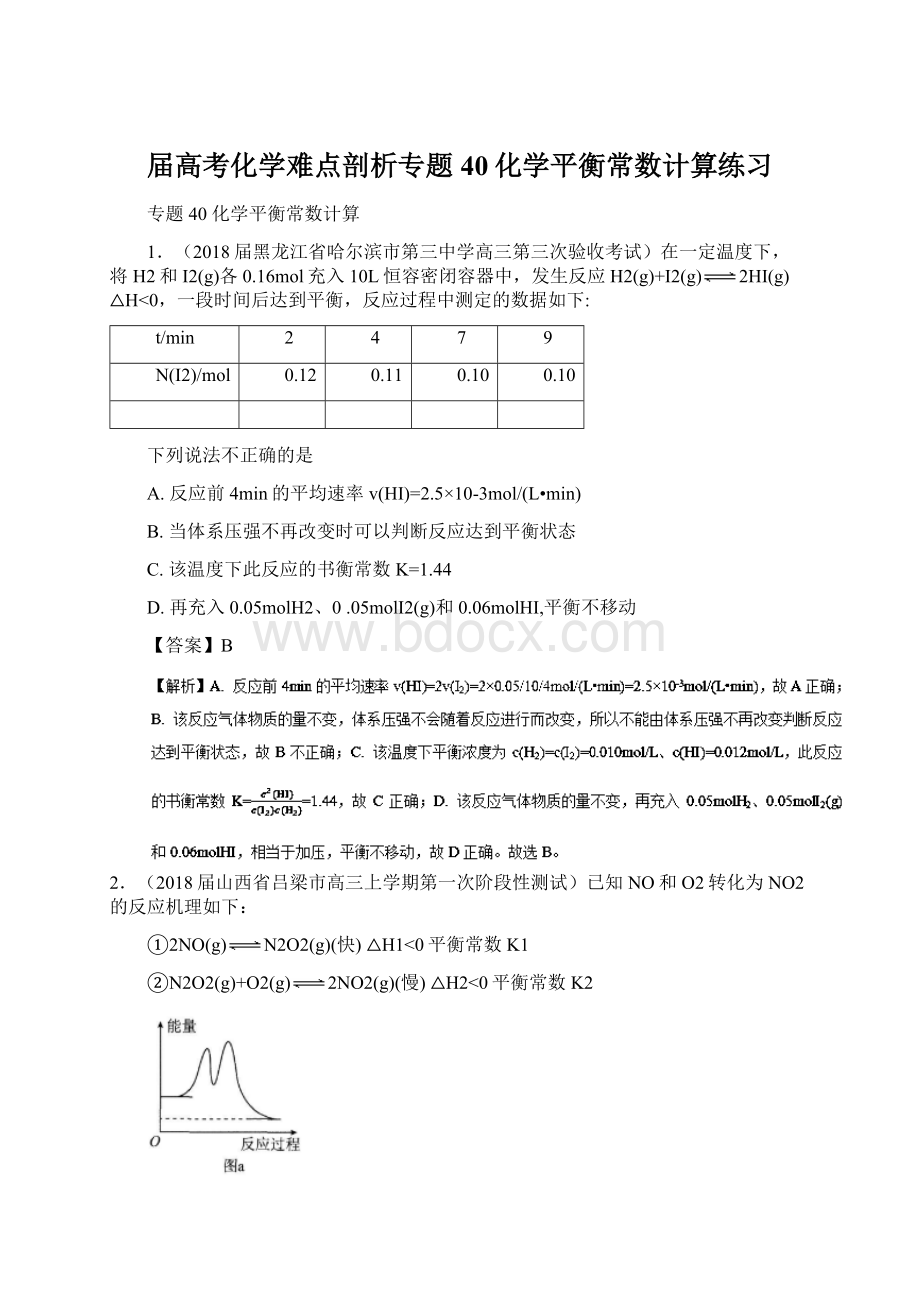
2.(2018届山西省吕梁市高三上学期第一次阶段性测试)已知NO和O2转化为NO2的反应机理如下:
①2NO(g)N2O2(g)(快)△H1<
0平衡常数K1
②N2O2(g)+O2(g)2NO2(g)(慢)△H2<
0平衡常数K2
下列说法正确的是()
A.2NO(g)+O2(g)2NO2(g)的△H=-(△H1+△H2)
B.2NO(g)+O2(g)2NO2(g)的平衡常数K=K1/K2
C.反应②的速率大小决定2NO(g)+O2(g)2NO2(g)的反应速率
D.反应过程中的能量变化可用图a表示
【答案】C
3.(2018届黑龙江省牡丹江市第一高级中学高三上学期期中考试)某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:
H2(g)+I2(g)2HI(g)。
反应体系中各物质浓度的有关数据如下。
容器
起始浓度
平衡浓度
c(H2)/mol·
L-1
c(I2)/mol·
c(HI)/mol·
甲
0.01
0.004
乙
0.02
a
丙
b
丁
——
下列判断正确的是
A.平衡时,H2的转化率:
丁>
B.平衡时,乙中H2的转化率等于20%
C.HI的平衡浓度:
a=b>
D.丙中条件下,该反应的平衡常数K=4
【解析】A、恒温恒容,丁与甲相比,各物质浓度增大一倍,为等效平衡,转化率相同,选项A错误;
B、甲容器中氢气的转化率为:
×
100%=20%,乙中增大碘的浓度,氢气的转化率增大,大于20%,选项B错误;
C、对比甲容器,乙容器中增大碘的浓度,平衡正向移动,碘化氢的浓度增大,丙容器中氢气的浓度增大,平衡正向移动,碘化氢的浓度增大,且两者转化率相同,故:
HI的平衡浓度:
0.004,选项C正确;
D、平衡常数只与温度有关,温度不变,平衡常数不变,故可以根据甲容器计算丙中条件下的平衡常数。
H2(g)+I2(g)2HI(g)
起始浓度(mol/L)0.010.010
改变浓度(mol/L)0.0020.0020.004
平衡浓度(mol/L)0.0080.0080.004
K==0.25,选项D错误。
答案选C。
4.(2018届北京市朝阳区第一学期高三年级期末)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
CO
H2O
CO2
1
650
1.6
5
900
0.4
3
A.该反应的正反应为放热反应
B.实验1中,前5min用CO表示的速率为0.16mol/(L·
min)
C.实验2中,平衡常数K=1/6
D.实验3跟实验2相比,改变的条件可能是温度
【答案】D
【解析】A.由表中数据可知,实验1中CO的转化率为40%,而实验2中CO的转化率为20%,压强不能使该化学平衡发生移动,由于温度升高使得CO的转化率减小,所以该反应的正反应为放热反应,A正确;
min),B正确;
C.实验2中,平衡混合物中各组分CO、H2O、CO2、H2的浓度分别为0.8mol/L、0.3mol/L、0.2mol/L、0.2mol/L,所以平衡常数K=1/6,C正确;
D.实验3跟实验2相比,各组分的平衡量没有改变,所以改变的条件不可能是温度,可能是加入了合适的催化剂,D不正确。
本题选D。
5.(2018届北京市西城区高三上学期期末)在10L密闭容器中充入气体X和Y,发生反应X(g)+Y(g)M(g)+N(g)ΔH,所得实验数据如下表:
实验
编号
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.090
②
800
0.080
③
0.20
0.05
下列说法正确的是
A.①中,若5min末测得n(M)=0.050mol,则0至5min内,用N表示的平均反应速率υ(N)=1.0×
10−2mol/(L·
B.800℃,该反应的平衡常数K=2.0
C.③中,达到平衡时,Y的转化率为80%
D.ΔH>0
6.(2018届甘肃省民乐县第一中学高三上学期期中考试)铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:
①Fe3O4(s)+4C(s)3Fe(s)+4CO(g)△H=+646.0kJ·
mol﹣1
②C(s)+CO2(g)2CO(g)△H=+172.5kJ·
则Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)△H=________________.
(2)反应Fe(s)+CO2(g)FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
温度/K
973
1173
1373
1573
K
1.47
2.15
3.36
8.92
①从表中数据可推断,该反应是___________(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是_____________(填字母).
A.c(CO2)=c(CO)B.v正(CO2)=v逆(CO)
C.体系压强不变D.混合气体中c(CO)不变
(3)如图图1、2表示反应:
H2(g)+CO2(g)CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
①图2中,若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=____mol·
L﹣1·
min﹣1。
②图1中t2时刻改变的条件是________________________________(任写两种,下同);
图2中t2时刻改变的条件是_________________________________.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为_______________________;
若使用该电池电解熔融Al2O3制取10.8gAl,则理论上需要氧气的体积为__________L.(标准状况下)。
【答案】﹣44.0kJ/mol吸热BD0.06mol·
min﹣1加入催化剂或增大压强降低温度或增大水蒸气浓度或减小氢气浓度CO+CO32﹣﹣2e﹣=2CO26.72
(3)①图2中若t1=0.5min,则0~t1时间段内,v(CO)=,同一化学反应中各物质的速率之比等于其计量数之比,所以v(H2O)=v(CO)=0.06mol·
min﹣1,
故答案为:
0.06mol·
min﹣1;
②图1中t2时刻,改变条件时正逆反应速率都增大且正逆反应速率相等,所以改变的条件是催化剂或压强;
图2中t2时刻改变条件,CO2逐渐浓度增大、CO浓度逐渐降低,平衡逆向移动,所以改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度。
加入催化剂或增大压强;
降低温度或增大水蒸气浓度或减小氢气浓度;
(4)以CO为燃料制作燃料电池,负极上CO失去电子,负极反应式为CO+CO32﹣﹣2e﹣=2CO2;
电解熔融Al2O3,由电子守恒可知,4Al~12e﹣~3O2,理论上需要氧气的体积为。
CO+CO32﹣﹣2e﹣=2CO2;
6.72。
7.(2018届黑龙江省牡丹江市第一高级中学高三上学期期中考试)运用化学反应原理研究化学反应有重要意义。
(1)将1molSO2和0.5molO2充入一密闭容器,发生如下反应:
2SO2(g)+O2(g)2SO3(g),混合体系中SO3的平衡百分含量和温度的关系如图1所示。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_____(填“向左”、“向右”或“不”)移动。
②若在恒温、体积不变的容器中向上述平衡体系中通入SO3气体,平衡_______填“向左”、“向右”或“不”)移动,再次平衡后SO3的百分含量_______(填“增大”、“不变”或“减小”)
③若反应进行到状态D时,v正________(填“>
”“<
”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:
N2(g)+3H2(g)2NH3(g) ΔH<
0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。
用H2表示0~10min内该反应的平均速率v(H2)=________。
从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为________(填编号)。
③该反应化学平衡常数的表达式为_______
【答案】向左向左增大>
D0.06mol·
L-1·
min-1dK=
【解析】
(1)①若在恒温、恒压条件下向上述平衡体系中通入氦气,该反应体系的压强减小,平衡向气体体积增大的方向移动,所以平衡向左移动;
②若在恒温、体积不变的容器中向上述平衡体系中通入SO3气体,生成物浓度增大,平衡向左移动,加入SO3的量远大于平衡移动减少的量,故再次平衡后SO3的百分含量增大;
③D状态相对于A状态,三氧化硫的含量较小,要使该反应达到平衡状态,该反应必须向正反应方向移动,所以v正>
v逆;
(2)①A.使用更高效的催化剂能使反应速率增大,但不能使平衡移动,选项A错误;
B.升高温度反应速率增大,该反应正反应为放热反应,升高温度平衡向逆反应方向移动,选项B错误;
C.及时分离出氨气,生成物的浓度降低,反应速率减小,平衡向正反应方向移动,选项C错误;
D.充入氮气,增大氮气的浓度(保持容器体积不变),反应物的浓度增大,反应速率增大,平衡向正反应方向移动,选项D正确。
答案选D;
②0~10min时N2从0.6mol减少到0.2mol,变化量为0.4mol,则H2的变化量为1.2mol,v(H2)==0.0