钒化合物性质Word文件下载.docx
《钒化合物性质Word文件下载.docx》由会员分享,可在线阅读,更多相关《钒化合物性质Word文件下载.docx(13页珍藏版)》请在冰豆网上搜索。
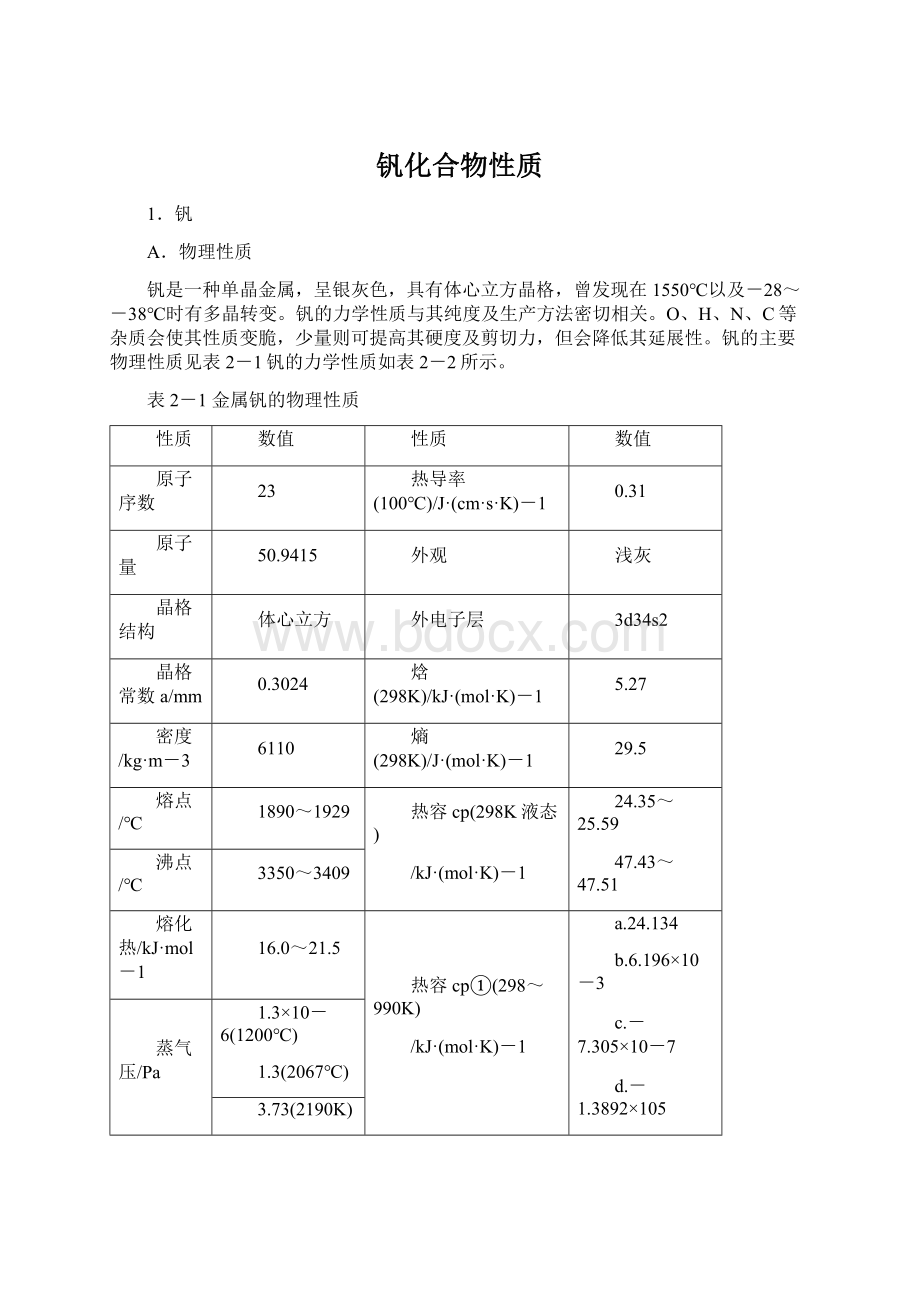
熵(298K)/J·
29.5
熔点/℃
1890~1929
热容cp(298K液态)
/kJ·
24.35~25.59
47.43~47.51
沸点/℃
3350~3409
熔化热/kJ·
mol-1
16.0~21.5
热容cp①(298~990K)
a.24.134
b.6.196×
10-3
c.-7.305×
10-7
d.-1.3892×
105
蒸气压/Pa
1.3×
10-6(1200℃)
1.3(2067℃)
3.73(2190K)
207.6(2600K)
蒸发热/kJ·
444~502
热容cp②(900~2200K)
a.25.9
b.-1.25×
10-4
c.4.08×
10-6
线膨胀系数
(20~200℃)/K-1
(7.88~9.7)×
比电阻(20℃)
/μΩ·
cm
24.8
温度系数(100℃)/cm·
K-1
0.0034
钒同位素
46V
47V
48V
49V
50V
51V
52V
53V
54V
半衰期
0.426s
33min
16.0d
330d
6×
1015a
稳定
3.75min
2.0min
55s
丰度/%
0.25
99.75
①cp=a+bT+cT2+dT-2;
②cp=a+bT+cT2,式中,T为温度,K。
表2-2金属钒的力学性质
工业纯品
高纯品
抗拉强度σb/MPa
245~450
210~250
180
延展性/%
10~15
40~60
40
维氏硬度HV/MPa
80~150
60
60~70
弹性模量/GPa
137~147
120~130
泊松比
0.35
0.36
屈服强度/MPa
125~180
B.钒的化学性质
由图2-1可见,钒在周期表中位于第4周期、VB族,属于过渡金属元素中的高熔点元素,包括Ti、Zr、Hf、V、Nb、Ta、Cr、Mo、W、Re等10个元素。
它们的特点是:
具有很高的熔点,例如钨的熔点是3180℃,钼的熔点是2610℃,它们主要是用作合金的添加剂,有些也可以单独使用,其中某些金属在高温下具有抗氧化性、高硬度、高耐磨性。
但这些金属的力学性质与其纯度和制备方法密切相关,少量的晶间杂质,会使其硬度和强度明显提高,但却使其延展性下降。
在原子结构方面,这些元素的外电子层具有相同的电子数,一般有两个电子(少数是一个电子),而在次外电子层的电子数目则依次递增,其化学性质介于典型金属与弱典型金属之间,处于过渡状态,具有彼此相互接近的性质,其共同的特点是:
图2-1高熔点元素在周期表中的位置
(1)这些元素外电子层的电子比较稳定,但较易失去次外电子层的电子,而形成不同价态的离子,例如钒可以形成-1、+2、+3、+4、+5的价态,而Ti则可以形成+2、+3、+4的价态。
图2-2所示为钒原子核的结构图;
图2-2钒原子核的结构图(质子数P=23,中子数N=28)
(2)这些元素按其顺序,次外电子层的电子数目依次增加,由于电子的静电引力作用,遂使原子的半径也渐趋缩小;
(3)这些元素的水溶液,由于电子的转移作用形成的光谱,都会使其离子呈现颜色,只有少数例外;
(4)这些元素会形成硼化物、碳化物、氮化物、氢化物,它们多数都具有金属性质,只有少数例外。
钒在空气中250℃以下是稳定的,呈浅银灰色,有良好的可塑性和可锻性。
长期保存表面会呈现蓝灰、黑橙色,超过300℃会有明显的氧化。
超过500℃,钒吸附氢于晶格间隙,使其变得易脆,易成粉末。
真空下600~700℃加热,氢可逸出。
低温下存在氢化物VH。
钒在400℃开始吸收氮气,800℃以上钒与氮反应生成氮化钒,在高真空、1700~2000℃下,发生氮化钒的分解,但是氮不可能完全从金属中释出。
钒对碳有较高亲和力,800~1000℃下可形成碳化物。
钒对稀硫酸、稀盐酸、稀磷酸保持相对稳定。
但在硝酸、氟氢酸中溶解。
金属钒对自来水抗蚀性良好,对海水抗蚀性中等,但未出现点腐蚀。
钒能抗10%NaOH溶液腐蚀,但不能抗热KOH溶液的腐蚀。
钒及其合金对低熔点金属或合金的熔融体有良好的抗蚀性,特别是碱金属(它们在核反应堆中用作冷却剂或热交换介质)。
表2-3为钒的抗腐蚀性能。
表2-3钒对某些介质的抗腐蚀性能
溶液
腐蚀速度/mg·
(cm2·
h)-1
腐蚀速度/nm·
h-1
材料
10%H2SO4(沸)
0.055
20.5(70℃)
钒板
30%H2SO4(沸)
0.251
10%HCl(沸)
0.318
25.4(70℃)
17%HCl(沸)
1.974
腐蚀速度(35℃)/μm·
a-1
腐蚀速度(60℃)/μm·
4.8%H2SO4
15.2
53.3
3.6%HCl
48.3
20.2%HCl
132
899
3.1%HNO3
25.4
1100
11.8%HNO3
68.6
88390
10%H3PO4
10.2
45.7
85%H3PO4
160
月)-1
液体Na(500℃)
0.2
钒的化合物从广义上来说,可以包括化学化合物、晶间化合物、金属间物、取代基合金等。
这种区分主要是基于化学键的性质和晶体结构。
通常,化学化合物指的是一类化合价态比较明确的化台物,对钒而言,就是价态在+2~+5之间的化合物。
钒的价态或氧化态决定该化合物的性质,即使其物理性质也与它的价态密切相差。
例如+5价钒是抗磁性的,形成的化合物常为无色或淡黄色;
而低价钒则为顺磁性的,有颜色,存钒原子的第三能级(M电子层)中,有一个或多个电子处于游离状态,这些未配合的电子,在游离过程中产生的光谱,即呈现为不同的颜色。
许多具有实际应用的钒化合物,是一类晶隙间化台物,如钒的碳化物、氮化物、硅化物等,这类含钒的化合物,作为添加剂在合金中可以起到细化晶粒的作用,以获取优异的性质。
但它们并无确切的价态,而不是真正意义上的化合物。
这一章里我们侧重介绍的是有确切价态的化台物。
C.钒氧化物,氢氧化物的性质
常见的钒氧化物为+2、+3、+4、+5价的氧化物:
VO、V2O3、VO2、V2O5,钒的氧化物从低价(二价)到高价(五价),系强还原荆到强氧化剂,其水溶液由强碱性逐渐变成弱酸性。
其间的关系如图2-3所示。
图2-3不同价态钒氧化物间的关系
低价氧化钒不溶于水,但遇强酸会形成强酸盐如VCl2、VSO4;
如遇强碱则形成V(OH)2,V(OH)2水解会放出H2。
低价氧化钒在空气中易被氧化成高价氧化钒,反之,五价氧化钒则可借还原性气体还原成四、三、二价的氧化钒。
它们的物理与化学性质以及热力学性质等,见表2-4、表2-5和表2-6。
钒氧的系统相图,见图2-4。
从这个相图中可以看出,除VO外,其他的氧化物都有一个明确的相变点,其中还包括多个氧化物构成的配合物;
而VO则系没有明确的化学计量的配合物,故有多个假稳态点,系统相当复杂。
表2-4钒氧化物的性质
VO
V2O3
VO2
V2O4
V2O5
晶系
面心立方
菱形
单斜
α
斜方
颜色
黑
深蓝
橙黄
5550~5760
4870~4990
4330~4339
3352~3360
1790
1970~2070
1545~1967
650~690
分解温度/℃
1690~1750
生成热Δ/kJ·
-432
-1219.6
-718
-1428
-1551
绝对熵/J·
38.91
98.8
62.62
102.6
131
自由能Δ/kJ·
-404.4
-1140.0
-659.4
-1319
-1420
水溶性
无
微
酸溶性
溶
HF、HNO3
碱溶性
氧化还原性
还原
两性
氧化
酸碱性
碱
表2-5钒氧化物的热容
化合物
cp/kJ·
适用温度T/K
128.2
298
194.81-16.32×
10-3T-55.34×
105T-2
298~熔点
298~345
74.72+7.116×
10-3T-16.58×
345~熔点
103.8
122.8+19.92×
10-3T-22.69×
298~1800
45.47
47.38+13.48×
10-3T-5.27×
298~1700
表2-6钒氧化物的标准生成自由能,ΔG=A+BT
反应式
A/kJ·
适用温度T/K
V(s)+1/2O2(g)=VO(s)
-412.8
0.0817
298~2000
2V(s)+3/2O2(g)=V2O3(s)
-1220
0.2364
600~2000
2V(s)+2O2(g)=V2O4(β)
-1402
0.3066
600~1818
6V(s)+13/2O2(g)=V6O13(s)
-4368.4
1.0042
600~1000
2V(s)+5/2O2(g)=V2O5(s)
-1554.6
0.4224
298~943
图2-4钒氧系相图
2.五氧化二钒
V2O5,是钒氧化物中最重要的,也是最常用钒化工制品。
工业上首先是制取NH4VO3,然后加热至500℃,即可制得V2O5。
其反应如下:
2NH4VO3→2NH3+H2O+V2O5
另一个方法是用VOCl3水解,反应如下:
2VOCl3+3H2O=V2O5+6HCl
V2O5是原子缺失型半导体,其中的缺失型是V4+离子,在700~1125℃,V2O5存在下列可逆反应:
V2O5=V2O5-x+(x/2)O2
式中,x随温度的升高而增大,此一性质使其呈现为催化性质。
V2O5微溶于水,溶解度在0.01~0.08g/L,大小取决于其前期生成的历史。
如果是自水溶液中沉淀生成的,则其溶解度会大些。
V2O5是两性化合物,但其碱性弱,酸性强,易溶于碱性构成钒酸盐,强酸也能溶解V2O5。
在酸、碱溶液中,生成物的形态取决于溶液的钒