浙江高考化学易错知识点总结Word下载.doc
《浙江高考化学易错知识点总结Word下载.doc》由会员分享,可在线阅读,更多相关《浙江高考化学易错知识点总结Word下载.doc(105页珍藏版)》请在冰豆网上搜索。
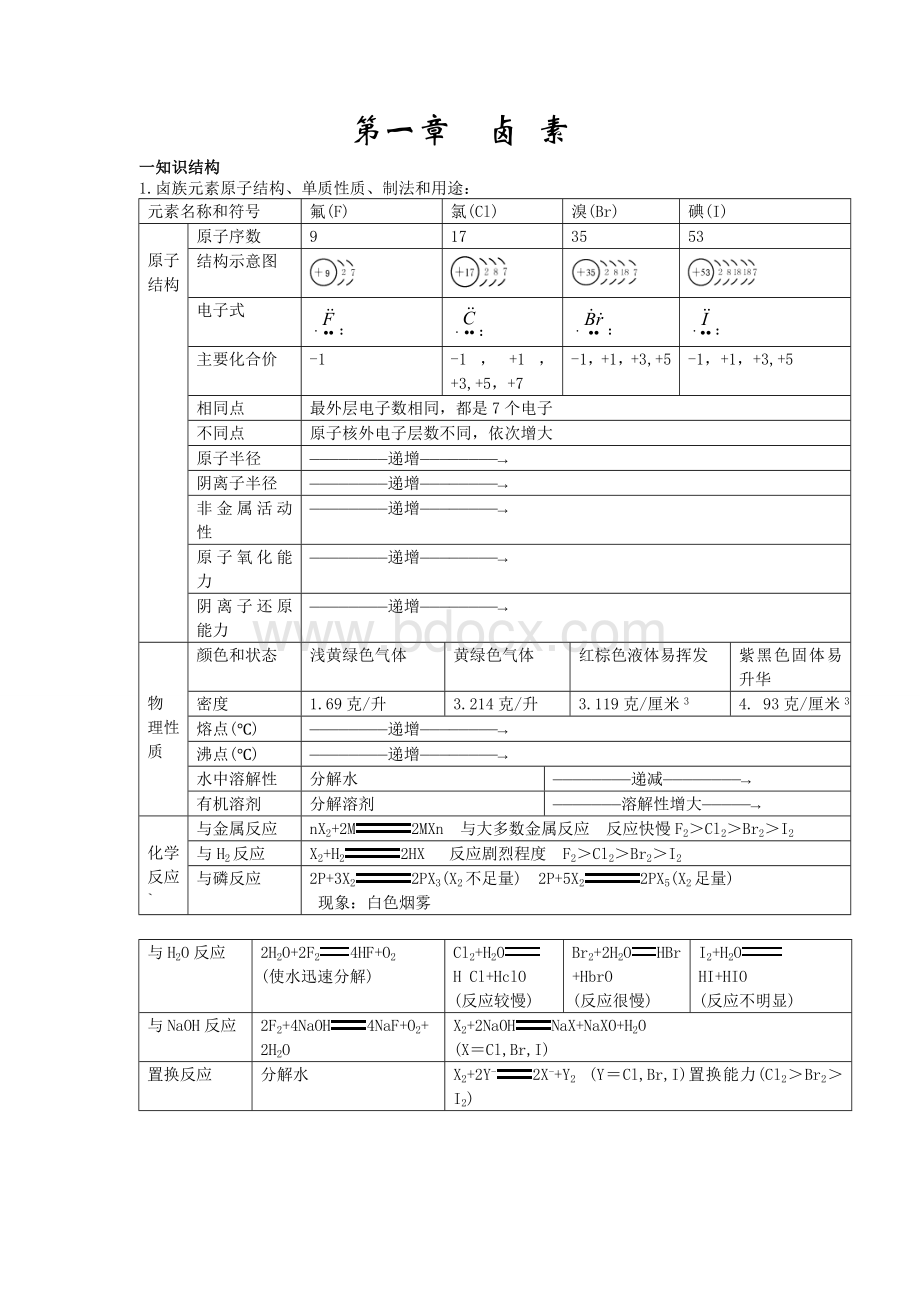
非金属活动性
原子氧化能力
阴离子还原能力
物
理性
质
颜色和状态
浅黄绿色气体
黄绿色气体
红棕色液体易挥发
紫黑色固体易升华
密度
1.69克/升
3.214克/升
3.119克/厘米3
4.93克/厘米3
熔点(℃)
沸点(℃)
水中溶解性
分解水
————————递减————————→
有机溶剂
分解溶剂
———————溶解性增大—————→
化学反应`
与金属反应
nX2+2M2MXn与大多数金属反应反应快慢F2>Cl2>Br2>I2
与H2反应
X2+H22HX反应剧烈程度F2>Cl2>Br2>I2
与磷反应
2P+3X22PX3(X2不足量)2P+5X22PX5(X2足量)
现象:
白色烟雾
与H2O反应
2H2O+2F24HF+O2
(使水迅速分解)
Cl2+H2O
HCl+HclO
(反应较慢)
Br2+2H2OHBr
+HbrO
(反应很慢)
I2+H2O
HI+HIO
(反应不明显)
与NaOH反应
2F2+4NaOH4NaF+O2+
2H2O
X2+2NaOHNaX+NaXO+H2O
(X=Cl,Br,I)
置换反应
X2+2Y-2X-+Y2(Y=Cl,Br,I)置换能力(Cl2>Br2>I2)
2KHF2F2↑+H2↑+2KF
2NaCl+2H2O2NaOH+H2↑+Cl2↑(工业)
MnO2+4HCl(浓)Cl2↑+MnCl2+2H2O(实验室)
2NaBr+Cl22NaCl+Br2
2NaBr+MnO2+3H2SO4Br2↑+2NaHSO4+MnSO4+2H2O
2KI+Cl22KCl+I2
2NaI+H2SO4+MnO2
MnSO4+2NaHSO4+I2+2H2O
F2:
能跟氙、氡等惰性气体反应生成XeF2,KrF2,通入水中产生O2
Cl2:
本身呈黄绿色,氯水常用于杀菌消毒,与AgNO3反应生成AgCl白色沉淀
Br2:
与皮肤接触产生疼痛而难治愈,与AgNO3反应生成淡黄色AgBr沉淀
I2:
使淀粉溶液变蓝,与AgNO3溶液反应生成黄色AgI沉淀
提炼铀
制盐酸、塑料农药、漂白粉
染料工业、制AgBr制溴化物
碘酒、AgI、碘仿制碘化物
HF(氟化氢、氢氟酸)
HCl(氯化氢、氢氯酸)
HBr(溴化氢、氢溴酸)
HI(碘化氢、氢碘酸)
结构与晶体
直线型分子、分子晶体
键的极性
———————极性递减—————→
分子的极性
键能
———————递减—————→
物理性质
稳定性
最稳定
稳定
不太稳定
熔点、沸点
-83.0℃,
19.5℃
-114.6℃,
-84.1℃
-88.5℃
-67℃
-50.9℃
-35.0℃
水溶液酸性
弱酸
强酸
化学性质
盐+H2
与碱性氧化物反应
盐+H2O
与碱反应
与AgNO3反应
不反应
Ag++Cl-AgCl↓(白色)
Ag++Br-AgBr↓(淡黄)
Ag++I-AgI(黄色)
与Ca2+反应
Ca2++2HF
CaF2↓+2H+
X-的还原性
很弱
较强
制法
CaF2+H2SO4(浓)
CaSO4+2HF↑H2+F22HF
2NaCl+H2SO4(浓)
Na2SO4+2HCl↑H2+Cl22HCl
NaBr+H3PO4(浓)
NaH2PO4+HBr↑
H2+Br22HBr
NaI+H3PO4(浓)NaH2PO4+HI↑H2+I2HI(难)
用途
制氢氟酸、工艺业
制盐酸、H2、氯化物
制氢溴酸、溴化物
制氢碘酸、碘化物
特性
银盐
溶于水
不溶于水
钙盐
检验
Ca2++2F-CaF2↓(白)
Ag++Cl-AgCl↓(白)
Ag++I-AgI↓(黄)
2.卤化氢的结构、性质、制法和用途
3.卤化物的性质和制法
项目
制备方法
跟金属反应
(氧化性)
Fe+CuCl2Cu+FeCl2
2FeCl3+Cu2FeCl2+CuCl2
金属与卤
素反应
2Al+3Cl22AlCl3
2Fe+3Cl22FeCl3
跟非金属反应(置换反应)
2NaBr+Cl22NaCl+Br2
2KI+Br22KBr+I2
金属与氢卤酸反应
2Al+6HCl2AlCl3+3H2
Fe+2HClFeCl2+H2
跟碱反应
(复分解反应)
MgCl2+2NaOH2NaCl+
Mg(OH)2↓
CuBr2+2NaOHCu(OH)2↓
+2NaBr
金属氧化物与氢卤酸反应
Fe2O3+6HCl2FeCl3+3H2O
CuO+2HClCuCl2+H2O
跟酸反应(复分解反应)
CaSO4+2HF↑
Na2SO4+2HCl↑
盐与氢卤酸反应
CaCO3+2HClCaCl2+H2O+CO2↑
AgNO3+HClAgCl↓+HNO3
跟盐反应(复分解反应)
NaCl+AgNO3AgCl↓+NaNO3
CaCl2+2NaFCaF2↓+2NaCl
盐与卤素反应
MgSO4+BaCl2MgCl2+BaSO4↓
AgNO3+KBrAgBr↓+KNO3
分解反应
2AgBr2Ag+Br2
2AgI2Ag+I2
碱与氢卤酸反应
NaOH+HClNaCl+H2O
Mg(OH)2+2HBrMgBr2+2H2O
4.氯的含氧酸及其钠盐的性质
化合价
酸分子式
酸的强度
热稳定性
氧化性
盐的化学式
+1
+3
+5
+7
HclO
HClO2
HClO3
HClO4
|
增|
强|
↓
减|
弱|
NaClO
NaClO2
NaClO3
NaClO4
酸<盐
酸>盐
三、知识点、能力点提示
1.次氯酸的性质:
可用来杀菌、消毒、作漂白剂:
(氧化漂白)
是一种强氧化剂。
HXO(F除外)
2.漂白粉:
制取:
Cl2、消石灰
2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
原因:
比次氯酸稳定,易保存
使用:
Ca(ClO)2+CO2+H2OCaCO3↓+2HClO
四、能力训练
1.为实现中国在2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。
已知在溶液中IO3-可和I-发生反应:
IO3-+5I-+6H+3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。
可供选用的
物质有:
①自来水;
②蓝色石蕊试纸;
③碘化钾淀粉试纸;
④淀粉;
⑤食糖;
⑥食醋;
⑦白酒。
进行上述实验时必须使用的物质是()
A.①③B.③⑥C.②④⑥D.①②④⑤⑦
知识点:
碘在生理方面的作用。
能力点:
解决实际问题的能力。
2.用自来水养金鱼,在将水注入鱼缸之前,常需把水在阳光下曝晒一段时间,其目的是()
A.增加水中含氧量B.起到杀菌作用
C.使水中的次氯酸分解D.使水中的硬度减小
氯气与水的反应。
次氯酸的性质。
3.市售“家用消毒液发生器”是以精盐和自来水为原料,通过时发生器内的电极板上产生大量气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不致对人体造成伤害,该发生器配制消毒液所涉及到的化学反应有()
①2NaCl+2H2O2NaOH+H2↑+Cl2↑
②Cl2+2NaOHNaCl+NaClO+H2O
③H2+Cl22HCl
④Cl2+H2OHCl+HClO
⑤2HClO2HCl+O2↑
A.①④⑤B.①②C.③④⑤D.②③④
考查氯气的化学性质
培养学生的分析鉴别能力和联系实际的能力
4.1995年的诺贝尔化学奖授予了致力研究臭氧层被破坏问题的三位化学家。
大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。
氟利昂(如CCl2F2)可在光的作用下分解,产生Cl原子。
Cl原子会对臭氧层产生长久的破坏作用。
有关反应为:
O3O2+OCl+O3ClO+O2ClO+OCl+O2
总反应:
2O33O2
(1)在上述臭氧变为氧气的反应过程中,Cl是()
A.反应物B.生成物C.中间产物D.催化剂
催化剂的定义。
对催化剂的判断能力。
(2)O3和O2是()
A.同分异构体B.同系物C.氧的同素异形体D.氧的同位素
同素异形体的定义。
多个概念的分辨能力。
5.工业上常用氯气给自来水消毒。
某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是()
A.石蕊B.硝酸银C.亚硫酸钠D.氯化铝
氯水中的成分。
氯水中各微粒性质的判断能力。
6.氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。
当这种毒气弹顺风爆炸时,通常可用的防御方法是()
A.人、畜应躲到低洼的地方B.人、畜应到较高的