高三化学复习单元集训检测卷21文档格式.docx
《高三化学复习单元集训检测卷21文档格式.docx》由会员分享,可在线阅读,更多相关《高三化学复习单元集训检测卷21文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
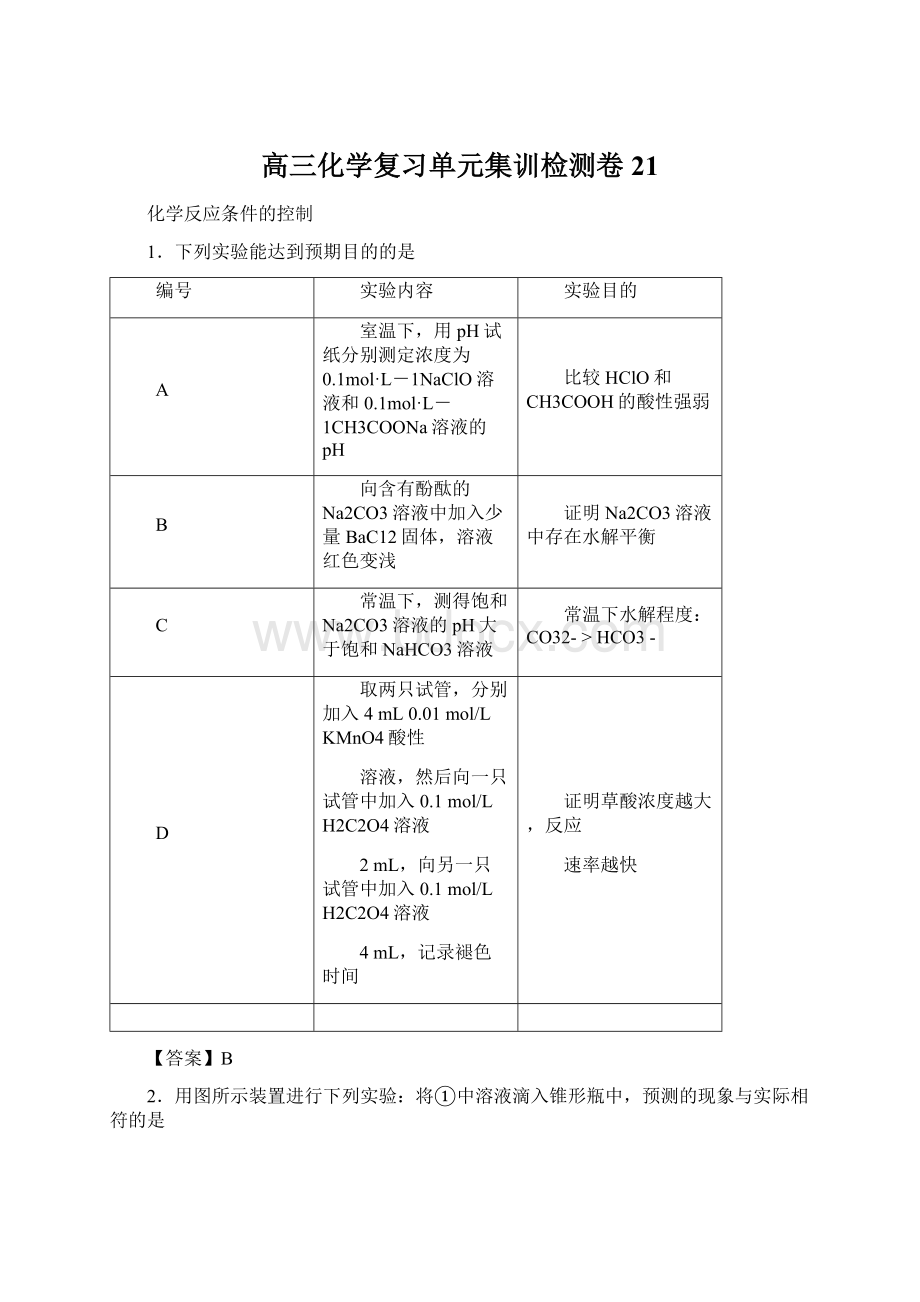
4mL,记录褪色时间
证明草酸浓度越大,反应
速率越快
【答案】B
2.用图所示装置进行下列实验:
将①中溶液滴入锥形瓶中,预测的现象与实际相符的是
选项
①中物质
锥形瓶中物质
预测锥形瓶中的现象
A.
浓盐酸
“84”消毒液
有黄绿色气体产生
B.
浓硝酸
光洁的铁钉
产生红棕色气体
C.
氯化铝溶液
浓氢氧化钠溶液
先有白色沉淀生成,后沉淀又溶解
D.
草酸溶液
酸性高锰酸钾溶液
溶液逐渐褪色,
有黑色沉淀生成
【答案】A
3.下述实验可以达到预期目的的是
【答案】D
4.下列装置或操作能达到实验目的的是
A.图1装置用于中和热的测定
B.图2装置用于高锰酸钾溶液滴定草酸
C.图3装置用于测定氢气的反应速率(单位mL/s)
D.图4装置用于研究不同催化剂对反应速率的影响
5.下列实验的实验目的、图示操作和实验现象均正确的是
A.探究不同催化剂对同一反应速率的影响
B.探究温度对化学平衡的影响
试剂:
淀粉溶液、碘水、
唾液、2mol/LH2SO4溶液
现象:
图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色
2NO2(g)N2O4△H<
烧瓶中各充入等质量的NO2
一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深
C.探究醋酸、碳酸、硼酸的酸性强弱
D.验证外加电流的阴极保护法
0.1mol/L醋酸溶液、饱和硼酸溶液
0.1mol/LNa2CO3溶液
图中左试管内液面产生气泡,右试管无明显现象
酸化的3%的NaCl溶液、
铁氰化钾溶液
一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀
【答案】C
6.下列有关实验现象或结论的描述不正确的是()
A.FeCl2溶液与K3Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+
B.常温下将5mL0.1mol/LNa2S2O3溶液、5mL0.01mol/LNa2S2O3溶液分别与5mL0.1mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响
C.某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大
D.处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀
7.下列图中的实验方案,能达到实验目的的是
实验
方案
目的
验证FeCl3对H2O2分解反应有催化作用
制备Fe(OH)2并能较长时间观察其颜色
除去CO2气体中混有的SO2
比较HCl、H2CO3和H2SiO3的酸性强弱
8.下述实验可以达到预期目的的是
9.下列实验操作与预期实验目的或所得实验结论一致的是
实验操作及现象
实验目的或结论
向1,2两试管中分别加入等浓度H2O2溶液10mL、1mL,再向H2O2溶液中分别滴入等浓度等体积CuSO4、FeCl3溶液;
试管2中产生气体较快
证明FeCl3溶液的催化效率更高
硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失
证明非金属性:
Cl>
Si
测定物质的量浓度相同的盐酸和醋酸溶液的pH;
盐酸pH小于醋酸pH
证明盐酸酸性比醋酸强
取5mL,0.1mol/L的AgNO3溶液于试管中,向试管中加入1-2滴0.1mol/L的NaCl溶液,出现白色沉淀,再向该试管中加入2滴0.1mol/L的KI溶液,出现黄色沉淀(AgI沉淀为黄色)。
证明:
Ksp(AgI)>
Ksp(AgCl)
10.下列实验的操作、现象和结论均正确的是
实验操作
实验现象
实验结论
NaHCO3溶液与NaAlO2溶液混合
生成白色沉淀
结合H+的能力:
CO32-<
AlO2-
常温下,相同的铝片分别投入足量的稀、浓硫酸中
浓硫酸中铝片先溶解完
反应物浓度越大,反应速率越快
向2mL2%的CuSO4溶液中加入0.5mL1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热
未出现砖红色沉淀
有机试剂X中不含醛基
2mL0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液
白色沉淀转化为红褐色沉淀
溶解度:
Mg(OH)2>
Fe(OH)3
11.(14分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
试回答:
①直流电源的a极名称是。
②阴极电极反应式为。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。
相对于电解法,该方法具有的优点是安全、。
(2)Fe3+对H2O2的分解具有催化作用。
利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。
可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是。
(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。
反应的离子方程式是,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol·
L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃)
20
30
40
50
60
70
80
Cu的平均溶解速率
(×
10-3mol·
min-1)
7.34
8.01
9.25
7.98
7.24
6.73
5.76
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是。
【答案】
(1)①正极②O2+2e-+2H2O=H2O2+2OH-③能耗低
(2)①深②H2O2分解放热,使平衡2NO2N2O4向生成NO2方向移动
(3)Cu+H2O2+2H+=Cu2++2H2O;
温度升高,H2O2分解速率加快(每空2分)
12.(16分)
(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。
实验时,通过测定褪色所需时间来判断反应的快慢。
限选试剂与仪器:
0.20mol/LH2C2O4溶液,0.010mol/L酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。
该小组设计了如下的方案。
物理量
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/mol·
L-1
体积/mL
①
0.20
2.0
0.010
4.0
②
25
③
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。
为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:
n(H2C2O4):
n(KMnO4)≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·
L-1·
min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。
其中反应速率最快的阶段是_____,原因是。
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。
可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。
(一)
(1)2:
5或2.5;
(2)
蒸馏水
1.0
(3)0.010或1.0×
10-2;
(4)t1-t2,随着反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
的进行研究,产生的MnSO4作为反应的催化剂使反应速率加快。
(二)根据图(a)可知,H2O2分解放热,使得B瓶中温度升高,据图(b)可知,2NO2(g)N2O4(g)为放热反应,温度升高,平衡逆向移动,从而使NO2浓度增大,颜色加深。
13.(16分)Na2S2O3·
5H2O在化学定量分析中常用作基准物质,实验室制备原理为
2Na2S+Na2CO3+4SO23Na2S2O3+CO2。
设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为。
(2)C中所盛试剂可能是;
若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是。
(3)学生乙在加热A后,发现液面下的铜丝变黑。
对黑色生成物该学生提出如下假设:
①可能是CuO②可能是Cu2O③可能是CuS
学生丙提出假设②一定不成立,依据是;
该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:
2S2O32一+I2=S4O62—+2I-)
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式;
②以淀粉为指示剂,则到达滴定终点的现象是;
③若标液Na2S2O3的浓度0.0030mol·
L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为。
(1)Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑
(2)NaOH溶液(或酸性高锰酸钾溶液)可以将铜丝抽离液面以停止反应
(3)Cu2O为砖红色CuS(4)2BaCrO4+6I-+16H+=3I2+2Ba2++2Cr3++8H2O
滴入最后一滴溶液,锥形瓶内溶液由蓝色变为无色,维持30s不变0.0011mol/L