江苏小高考化学复习资料-全Word下载.doc
《江苏小高考化学复习资料-全Word下载.doc》由会员分享,可在线阅读,更多相关《江苏小高考化学复习资料-全Word下载.doc(27页珍藏版)》请在冰豆网上搜索。
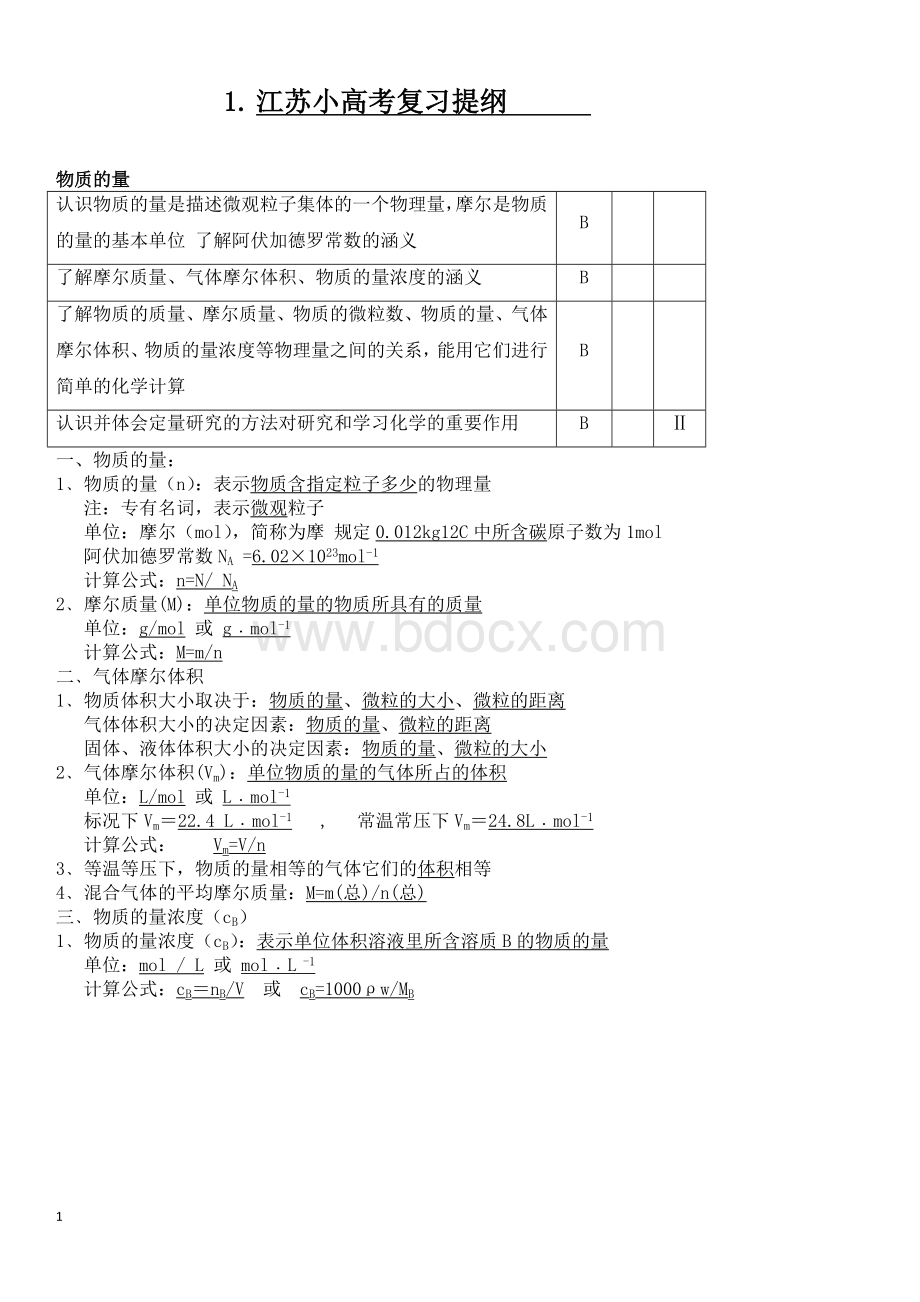
1﹑物质体积大小取决于:
物质的量、微粒的大小、微粒的距离
气体体积大小的决定因素:
物质的量、微粒的距离
固体、液体体积大小的决定因素:
物质的量、微粒的大小
2﹑气体摩尔体积(Vm):
单位物质的量的气体所占的体积
L/mol或L﹒mol-1
标况下Vm=22.4L﹒mol-1,常温常压下Vm=24.8L﹒mol-1
Vm=V/n
3﹑等温等压下,物质的量相等的气体它们的体积相等
4﹑混合气体的平均摩尔质量:
M=m(总)/n(总)
三﹑物质的量浓度(cB)
1﹑物质的量浓度(cB):
表示单位体积溶液里所含溶质B的物质的量
mol/L或mol﹒L-1
cB=nB/V或cB=1000ρw/MB
实验安全
知道化学实验常用仪器的名称、形状、主要用途、使用方法和操作原理,能识别和绘制简单的仪器装置图
A
b
树立安全意识,能识别化学品安全使用标识,知道基本的安全措施和意外事故的紧急处理方法,初步形成良好的实验工作习惯
Ⅲ
一﹑取用药品的注意事项
1、不能用手直接接触药品,不能品尝药品的味道
2、节约药品,严格按要求量取若没有说明用量,液体取1mL~2mL,固体只要盖满试管底部
3、剩余的药品一般不放回,也不乱丢弃,更不能带出实验室,要放在指定容器内(并非所有药品都不能放回原容器,如钠﹑金等)
4、固体药品放在广口瓶里,液体盛放在细口瓶里,见光分解的放在棕色试剂瓶里
5、托盘天平精确到0.1g,量筒精确到0.1mL
二﹑使用酒精灯的注意事项
1、禁止用酒精灯引燃另一盏酒精灯
2、禁止向燃着的酒精灯里添加酒精(用漏斗加)
3、熄灭酒精灯用灯帽
4、酒精灯里的酒精洒出着火,用抹布盖灭
三﹑加热的注意事项
1、可直接加热的仪器:
试管﹑蒸发皿、坩埚、燃烧匙
2、需垫石棉网的仪器:
烧杯﹑烧瓶﹑锥形瓶
3、加热前应将仪器外壁的水擦干,烧的很热的仪器不能用水立即冲洗
四﹑其它注意事项
1、点燃可燃气体前要验纯
2、制备有毒气体要在通风厨中进行,还要进行尾气处理
3、若用加热法制气体,排水法收集时,为防止倒吸,结束时要先移走导管,再熄灭酒精灯在尾气处理中,吸收一些在水中溶解度较大的气体(如氨气),也要防倒吸(常见防倒吸装置有:
倒立漏斗式,安全瓶式等)
五﹑实验事故处理方法
1、酒精等易燃物小面积着火应迅速用湿抹布盖灭,钠﹑磷着火用细沙盖灭,更大火情拨打119
2、眼睛的化学灼伤,应用大量水冲洗,边冲边眨眼若为碱灼伤再用20%硼酸溶液淋洗,若为酸灼伤再用3%碳酸氢钠溶液淋洗
3、误食重金属盐,应立即服用蛋清或牛奶(如氯化钡中毒)
4、汞洒落后,应洒上硫粉,并打开风扇通风
5、浓酸﹑浓碱沾到皮肤上,应先用抹布擦,再用大量水冲洗
熟悉一些常用危险化学品的标志(P4)
分离和提纯、溶液的配制
初步学会使用过滤、蒸发等方法对混合物进行分离和提纯
初步学习蒸馏、萃取等分离和提纯的方法
a
初步学会配制一定物质的量浓度的溶液
一、蒸馏和萃取
1、蒸馏:
利用互溶的液态混合物各组分的沸点不同,分离组分或除去易挥发﹑难挥发的杂质
蒸馏水的制备实验(P8)
2、萃取:
利用溶质在两种互不相溶的容剂中的溶解性不同,将溶质从溶解度较小的溶剂中转移到溶解度较大的溶剂中的方法
碘水的萃取实验(P9)
步骤:
检漏,装液,振荡,静置,分液
二﹑过滤和蒸发
1、粗盐提纯:
溶解
2、过滤:
(一贴﹑二低﹑三靠)主要用于不溶固体与液体的分离
3、蒸发:
用于可溶性固体和液体的分离
六﹑一定物质的量浓度溶液的配制
1﹑仪器:
容量瓶-长颈梨形平底玻璃瓶
规格:
100mL﹑250mL﹑500mL﹑1000mL等
使用:
不可用于固体溶解﹑浓溶液稀释或反应容器,使用前需先检漏
2﹑配制步骤:
计算,称量(或量取),溶解(或稀释),转移,洗涤(2-3次),定容,摇匀
常见物质的检验
了解Cl-、SO42-、CO32-、Fe3+、NH4+、Na+、K+等常见离子的检验方法
D
离子
常用检验方法
Cl—
加入HNO3酸化的AgNO3,有白色沉淀
CO32—
加入HCl产生无色无味的使澄清石灰水变浑浊的气体
SO42—
先加入HCl溶液,再加入BaCl2,有白色沉淀
Na+
焰色反应为黄色
K+
透过蓝色钴玻璃焰色为紫色
Ag+
加入HCl溶液有白色沉淀
Fe3+
滴加KSCN溶液呈血红色或加NaOH溶液有红褐色沉淀
Fe2+
滴加NaOH溶液,先生成白色沉淀再变成灰绿色最后变成红褐色
常见金属
关注钠、铝、铁、铜等金属及其重要化合物在生产、生活中的应用实例,通过对钠、铝、铁、铜等金属及其重要化合物性质的实验探究,增强学习化学的兴趣,发展科学探究能力
了解钠、铝、铁、铜等金属及其重要化合物的主要物理性质
了解钠、铝、铁、铜等金属分别与氧气、水、酸、碱、盐等物质反应的情况
了解氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物分别与水、酸、碱等物质反应的情况
了解氢氧化铝的两性了解氢氧化铝、氢氧化铁、氢氧化铜的受热分解
比较碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应
初步学会鉴别碳酸钠和碳酸氢钠的方法
了解Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化
了解钠、钾的焰色反应
能列举钢、铝合金等合金材料的重要应用
Ⅰ
通过对钠、铝、铁、铜及其化合物之间转化关系的比较和归纳,体会学习元素化合物知识的一般方法
一、钠
1、钠的物理性质:
银白色、有金属光泽的固体,热、电的良导体,质软、密度小、熔点低
2、钠与水反应的现象及解释:
①浮:
(说明钠的密度比水的密度小)
②熔:
(说明钠的熔点低该反应为放热反应)
③游:
(说明有气体H2产生)
④响:
(说明有气体产生)
⑤红:
溶液中滴入酚酞显红色(说明生成的溶液碱性)
3、钠与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑
离子方程式为2Na+2H2O=2Na++2OH-+H2↑
4、与氧气反应:
4Na+O2==2Na2O2Na+O2=点燃=Na2O2
5、4Na+TiCl4==4NaCl+Ti
6、Na的用途
①制取纳的重要化合物
②作为中子反应堆的热交换剂
③冶炼Ti.铌锆钒等金属
④钠光源
7、碳酸钠与碳酸氢钠的比较
名称
碳酸钠
碳酸氢钠
化学式
Na2CO3
NaHCO3
俗名
纯碱苏打
小苏打
颜色、状态
溶解性
溶解度比碳酸钠小
热稳定性
———
2NaHCO3==Na2CO3+H2O+CO2↑
与盐酸反应
Na2CO3+2HCl==2NaCl+H2O+CO2↑
比Na2CO3剧烈NaHCO3+HCl==NaCl+H2O+CO2↑
与NaOH反应
NaHCO3+NaOH==NaCO3+H2O
相互转化
8、除杂
Na2CO3固体(NaHCO3)加热
Na2CO3溶液(NaHCO3)NaOH
9、鉴别碳酸钠和碳酸氢钠的方法:
加热出现气体是碳酸氢钠或着加酸先出现气体的是碳酸氢钠,后出现气体的是碳酸钠
10、转化关系
二、铝
1、铝是地壳中最多的金属元素,主要是以化合态存在,铝土矿主要成分是Al2O3
2、铝的物理性质:
银白色金属固体,密度2.70g/cm3,较强的韧性、延展性,良好的导热导电性
3、化学性质:
铝是比较活泼的金属,具有较强的还原性
①与氧气反应
常温下与空气中的氧气反应生成坚固的氧化膜,所以铝有良好的抗腐蚀能力
4Al+3O2====2Al2O3
②铝与冷水不反应,与热水缓慢反应
2Al2O3+6H2O=====2Al(OH)3↓
一般情况下铝表面的氧化膜阻止了与水的反应
③与非氧化性酸反应
2Al+6HCl==2AlCl3+3H2↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
常温下铝与浓硫酸浓硝酸钝化
④与强碱反应
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
⑤铝热反应
2Al+Fe2O3===2Fe+Al2O3(焊接铁轨)
4、Al2O3为两性氧化物
①与硫酸反应Al2O3+3H2SO4==Al2(SO4)3+3H2O
②与氢氧化钠Al2O3+2NaOH==2NaAlO2+H2O
离子方程式Al2O3+2OH-==2AlO2-+H2O
5、Al(OH)3两性氢氧化物
①与盐酸反应Al(OH)3+3HCl==3AlCl3+3H2O
②与烧碱反应Al(OH)3+NaOH==NaAlO2+2H2O
离子反应:
Al(OH)3+OH-==AlO2-+2H2O
③受热分解2Al(OH)3==Al2O3+3H2O
6、将NaOH滴加入AlCl3溶液中至过量现象:
先有白色沉淀后沉淀消失
7、实验室常用铝盐与足量氨水制取Al(OH)3
8、明矾:
十二水合硫酸铝钾[KAl(SO4)2·
12H2O]易溶于水,溶于水后显酸性,是因为Al3++3H2O==AL(OH)3+3H+,因此明矾常用作净水剂,是因为铝离子水解生成氢氧化铝、而氢氧化铝具有吸附性,吸收了水中悬浮物而下沉
9、转化关系
三、铁
1、金属铁
铁的物理性质:
有金属光泽的银白色金属,质软,有良好的导电、导热性,具有延展性,能被磁铁吸引
化学性质
①与非金属反应2Fe+3Cl2==2FeCl3,Fe+SFeS与纯氧反应3Fe+2O2Fe3O4
②与水蒸气反应3Fe+4H2O(g)Fe3O4+4H2(g)
③与非氧化性酸反应Fe+H2SO4==FeSO4+H2↑Fe+2HCl==FeCl2+H2↑
④与盐反应Fe+CuSO4==FeSO4+Cu2FeCl3+Fe═3FeCl2
2、铁的重要化合物转化关系
Fe的氧化物:
Fe2O3俗名铁红
与HCl反应:
Fe2O3+6H+=2Fe3++3H2O
Fe的两种氢氧化物
Fe(OH)2
Fe(OH)3
颜色
白→灰绿→红褐色
①