届一轮复习人教版 元素周期律和元素周期表 学案Word下载.docx
《届一轮复习人教版 元素周期律和元素周期表 学案Word下载.docx》由会员分享,可在线阅读,更多相关《届一轮复习人教版 元素周期律和元素周期表 学案Word下载.docx(12页珍藏版)》请在冰豆网上搜索。
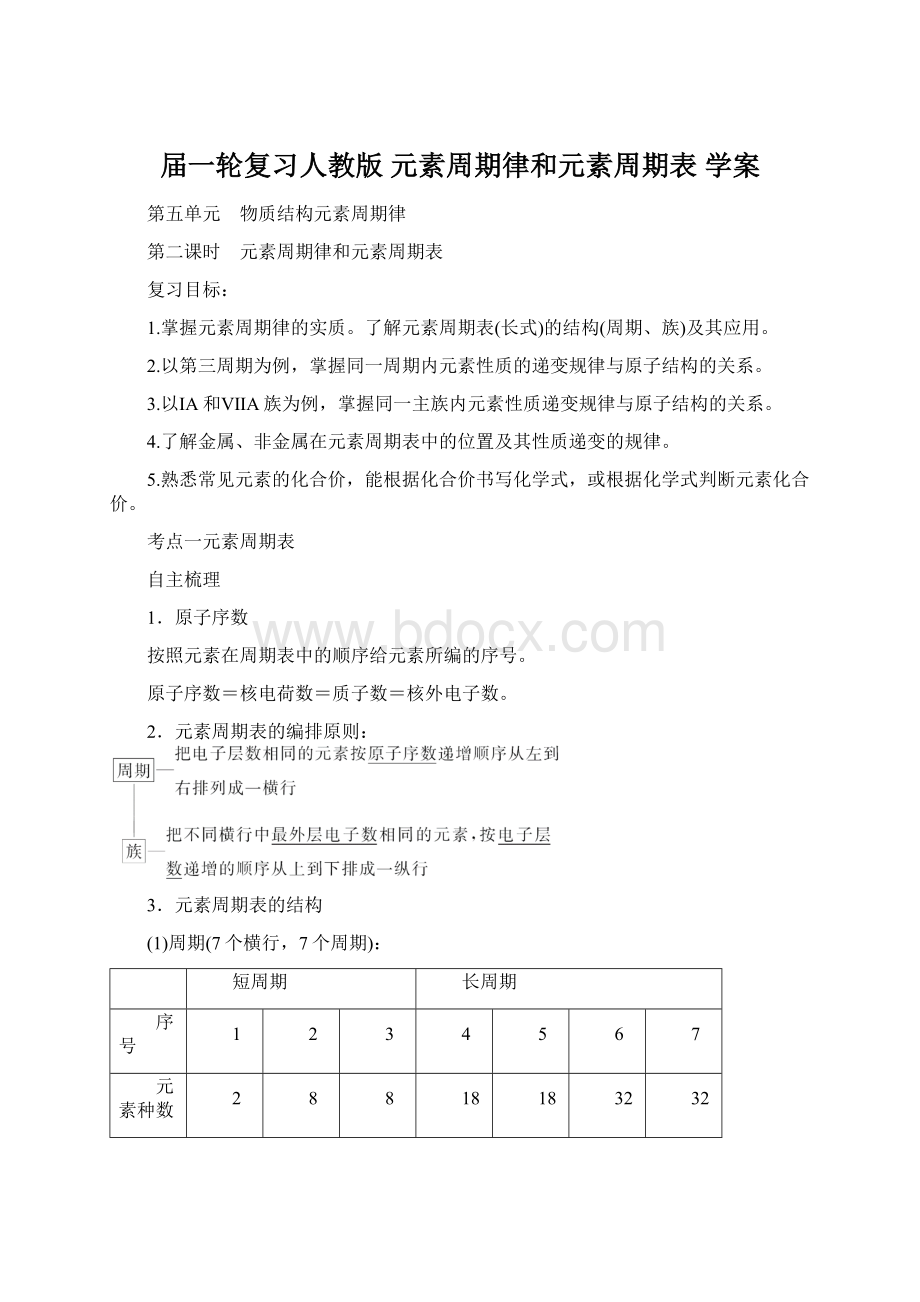
8
18
32
0族元素原子序数
10
36
54
86
118
(2)族(18个纵行,16个族):
主族
列
13
14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
11
12
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第8、9、10,共3个纵行
0族
第18纵行
注:
元素周期表中的特殊元素位置
①过渡元素:
元素周期表中部从ⅢB族到ⅡB族10个纵行共六十多种元素,这些元素都是金属元素。
②镧系:
元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
③锕系:
元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
④超铀元素:
在锕系元素中92号元素铀(U)以后的各种元素。
⑤碱金属元素:
ⅠA(氢除外)。
卤族元素(ⅦA),氧族元素(ⅥA),氮族元素(ⅤA),碳族元素(ⅣA)。
【深度思考】
(1)最外层电子数为1或2的元素一定是ⅠA或ⅡA族吗?
具体说明。
(2)同一周期ⅡA族与ⅢA族的原子序数之差一定是1吗?
请解释?
【答案】
(1)最外层电子数为1或2的元素,可能为ⅠA、ⅡA族,也可能是某些过渡元素或稀有气体元素He。
最外层电子数为3~7的元素一定属于主族。
(2)同一周期ⅡA族与ⅢA族的原子序数可能相差1(2、3周期)或11(4、5周期)或25(6、7周期)。
例1、已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。
则下列说法不正确的是( )
Y
X
Z
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31
D.X、Y、Z一定为短周期元素
【答案】D
【解析】X与上、下相邻差可能为8、18、32等,故A、B、C正确;
若X、Y、Z为短周期元素,则Y为He,不是主族元素,D不正确。
【发散类比1】如图A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系)。
下列说法不正确的是( )
A.A、E原子序数之差可能为2
B.D、E原子序数之差可能是8、18或32
C.若E原子序数为x,则A、B、C、D、E原子序数之和可能为5x+10
D.B、D原子序数之差不可能是7
【答案】A
【归纳总结】元素周期表中原子序数的有关规律
(1)同主族、邻周期元素的原子序数之差:
①元素周期表中左侧元素(ⅠA、ⅡA族):
同主族相邻两元素中,R(下)=R(上)+上一周期元素所在周期的元素种类数目;
②元素周期表中右侧元素(ⅢA~ⅦA族):
同主族相邻两元素中,R(下)=R(上)+下一周期元素所在周期的元素种类数目。
(2)同周期的ⅡA和ⅢA的原子序数差可能为1、11、25。
元素在周期表中位置的确定
例2、根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
【答案】C
【解析】L层电子数为偶数时,可能有2、4、6、8,当为2、4、6时,该元素所在族的序数等于L层电子数;
当为8时,元素的原子可能存在M层、N层等,其所在族的序数无法确定。
【发散类比2】下列有关第114号和第116号两种元素的说法错误的是( )
A.两种元素位于同一周期
B.116号元素位于ⅥA族
C.两种元素都是活泼的非金属元素
D.114号元素与Si元素在同一主族
【归纳总结】“0族”法确定元素位置
(1)熟记0族元素的相应周期数和原子序数
元素符号
He
Ne
Ar
Kr
Xe
Rn
Uuo
原子序数
周期数
一
二
三
四
五
六
七
(2)确定主族元素在周期表中位置的方法:
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
考点二元素周期律
1.元素周期律:
2.主族元素的周期性变化规律
内容
同周期(从左到右)
同主族(从上到下)
原子
结构
电子层数
相同
依次增加
最外层电子数
依次增加1个
原子半径
逐渐减小
逐渐增大
元素
的性质
金属性
逐渐减弱
逐渐增强
非金属性
主要化合价
一般,最高正价:
+1→+7
负化合价:
主族序数-8
最高正价数=主族序数(O、F除外)
化合物性质
最高价氧化物对应水化物
酸性逐渐增强
碱性逐渐减弱
酸性逐渐减弱
碱性逐渐增强
氢化物稳定性
【深度思考】判断正误,正确的划“√”,错误的划“×
”
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)电子层数越多,半径越大( )
(3)在主族元素中,最高正化合价均等于主族序数( )
(4)元素的原子得电子越多,非金属性越强;
失电子越多,金属性越强( )
(5)元素的氧化物对应的水化物酸性越强,非金属性越强;
碱性越强,金属性越强( )
(6)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱( )
(7)在Mg、Al、NaOH溶液构成的原电池中,因为Al作负极,Mg作正极,所以Al的金属性大于Mg( )
(8)原子的最外层有2个电子的元素一定是ⅡA族元素( )
(9)元素所在的主族序数与最外层电子数相等的元素都是金属元素( )
(10)原子序数为29的元素位于元素周期表的第四周期ⅠB族( )
(1)×
(2)×
(3)×
(4)×
(5)×
(6)×
(7)×
(8)×
(9)×
(10)√
例3、运用元素周期律分析下面的推断,其中错误的是( )
A.已知Ra是第七周期第ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期第ⅤA族的元素,故AsH3的稳定性比NH3的稳定性弱
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的非金属性比S的强,故HClO的酸性比H2SO3的强
【发散类比3】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。
A.原子半径:
Z>W>X>Y
B.最高价氧化物对应水化物的酸性:
X>W>Z
C.最简单气态氢化物的热稳定性:
Y>X>W>Z
D.元素的最高化合价:
Z<
W=X<
【解析】从元素周期表的局部图可知X、Y、Z、W为二、三周期元素,W位于第三周期,W原子的质子数是其最外层电子数的三倍,故W是P元素,据此推出X、Y、Z分别是氮、氧、硅。
其中Z、W、X的最高价为+4、+5、+5,Y为氧,氧无正价。
【归纳总结】
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧、氟正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子的多少。
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。
(4)主族元素金属离子的氧化性越强相应金属的金属性越弱。
同理非金属离子的还原性越强,相应非金属的非金属性越弱。
例4、下列实验操作不能达到实验目的的是( )
选项
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入氨气
比较镁、铝的金属性强弱
C
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH
比较碳、硫非金属性强弱
D
Fe、Cu分别与稀盐酸反应
比较铁、铜金属性强弱
【答案】B
【解析】A项,Cl2、Br2分别与H2反应,根据反应条件的难易,即可判断出氯、溴的非金属性强弱;
B项,向MgCl2、AlCl3溶液中分别通入氨气,MgCl2与NH3·
H2O反应生成Mg(OH)2,AlCl3与NH3·
H2O反应生成Al(OH)3,但无法比较二者的金属性强弱;
C项,测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH,根据pH可判断出Na2CO3与Na2SO4水解程度的大小,即可判断出酸性H2CO3<
H2SO4,从而判断出碳、硫的非金属性强弱;
D项,利用Fe、Cu分别与稀盐酸反应现象的不同即可判断出Fe、Cu的金属性强弱。
【发散类比4】下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是( )
A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少
B.气态氢化物溶于水后的酸性X比Y强
C.X的最高正价比Y的最高正价高
D.X单质能与Y的氢化物反应生成Y单质
【归纳总结】比较金属性和非金属性的强弱,主要有以下三种方法:
1.结构比较法:
最外层电子数越少,电子层数越多,元素金属性越强;
最外层电子数越多,电子层数越少,非金属性越强。
2.位置比较法:
3.实验比较法:
考点三元素周期表和元素周期律的应用
1.元素周期表中元素的分区:
2.元素周期表在科研、生产等方面的指导作用
(1)科学预测:
为新元素的发现及预测它们的原子结构和性质提供了线索。
(2)寻找新材料:
。
(3)工农业生产:
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
(1)同周期ⅡA与ⅢA族的元素原子序数之差一定为1。
( )
(2)同主族第三周期与第四周期的元素原子序数之差一定为18。
(3)因为非金属性Cl>
S,故HClO的酸性比H2SO4的强。
(4)Fe、Co、Ni均属于第四周期ⅧB族。
(5)I的原子半径大于Br,HI比HBr的热稳定性强。
(6)P的非金属性强于Si,H3PO4比H2SiO3的酸性强。
(7)因为r(Na)>
r(Cl),故r(Na+)>
r(Cl-)。
(8)HF、HCl、HBr、HI的热稳定性和还原性依次增强。
(9)酸性:
HClO4>
HBrO4与热稳定性:
HCl>
HBr,二者均可证明非金属性:
Cl>
Br。
(10)