李家中学高中化学选修4教材化学实验报告18个汇总Word格式文档下载.docx
《李家中学高中化学选修4教材化学实验报告18个汇总Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《李家中学高中化学选修4教材化学实验报告18个汇总Word格式文档下载.docx(27页珍藏版)》请在冰豆网上搜索。
实验原理
1、0.50mol·
L-1盐酸和0.55mol·
L-1NaOH溶液的密度都约为1g·
cm-3,所以50mL0.50mol·
L-1盐酸的质量m1=50g,50mL0.55mol·
L-1NaOH溶液的质量m2=50g。
2、中和后生成的溶液的比热容c=4.18J·
(g·
℃)-1,由此可以计算出0.50mol·
L-1盐酸与0.55mol·
L-1NaOH溶液发生中和反应时放出的热量为(m1+m2)·
c·
(t2-t1)=0.418(t2-t1)kJ又因50mL0.50mol·
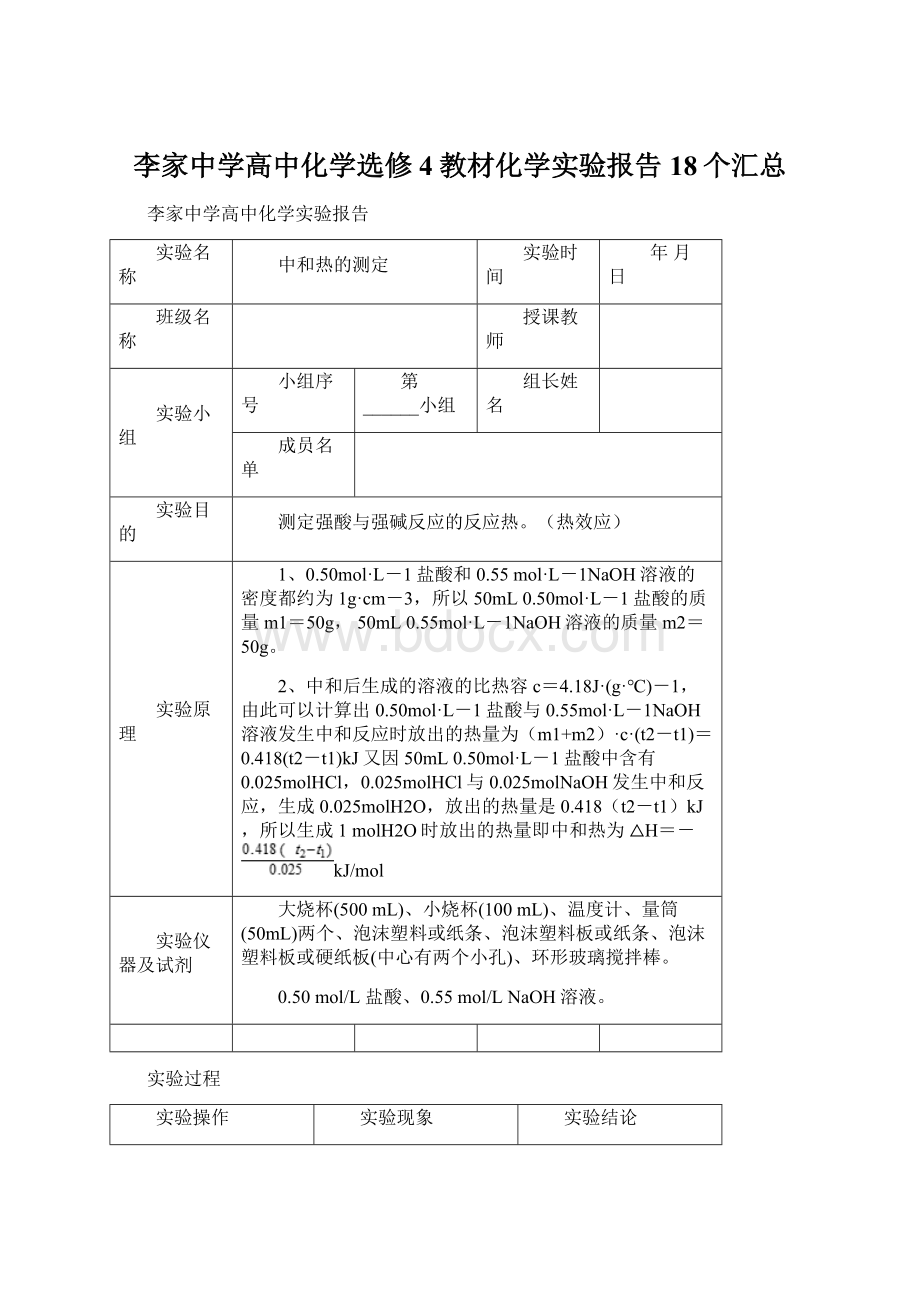
L-1盐酸中含有0.025molHCl,0.025molHCl与0.025molNaOH发生中和反应,生成0.025molH2O,放出的热量是0.418(t2-t1)kJ,所以生成1molH2O时放出的热量即中和热为△H=-kJ/mol
实验仪器及试剂
大烧杯(500mL)、小烧杯(100mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50mol/L盐酸、0.55mol/LNaOH溶液。
实验过程
实验操作
实验现象
实验结论
1.在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
2.用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
3.用另一个量筒量取50mL0.55mol/LNaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次(防止造成热量损失)倒入小烧杯(注意不要洒到外面)。
用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入表格中。
5.重复实验步骤2至4三次
6.根据实验数据计算中和热。
温度
实验次数
实验起始温度t1/℃
终止温度
t2/℃
温度差
(t2-t1)/℃
HCl
NaOH
平均值
1
2
3
7.三次测量所得数据的平均值,作计算依据。
起始温度t1/℃
终止温度t2/℃
温度差(t2-t1)/℃
8.计算反应热△H=
学生自评
教师评价
A
B
C
D
评价时间
锌铜原电池
探究锌铜原电池
Zn-2e-=Zn2+,Cu2++2e-=Cu
烧杯2个,铜片,锌片,导线,电流表、盐桥;
CuSO4溶液;
ZnSO4溶液
将锌片和铜片用导线连接起来插入CuSO4溶液、ZnSO4溶液,两烧杯用盐桥连接,并在中间串联一个电流表,观察现象;
锌片
铜片
溶液颜色
(说明现象并写出方程式)
氯化铜溶液的电解实验
探究氯化铜溶液的电解
U形管,石墨棒,湿润的碘化钾淀粉试纸,电流表,导线,学生电源;
CuCl2溶液
在U形管中注入CuCl2溶液,插入两根石墨棒作电极,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近。
接通直流电源,观察U形管内的现象和试纸颜色变化。
阳极
阴极
试纸颜色
(说明现象并写出方程式)
铁的吸氧腐蚀实验
探究铁在中性环境中的腐蚀
铁生锈时消耗了氧气,使具支试管中压强减小,因此导管中的水柱高度有变化
具支试管、小试管、经过酸洗除锈的铁钉,塞子;
饱和食盐水、蒸馏水
将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入具支试管中。
几分钟后,观察导管中水柱的变化。
观察到铁,右边试管中导管内的水柱;
方程式:
;
牺牲阳极的阴极保护法验证实验
用实验验证牺牲阳极的阴极保护法
烧杯、铁片、锌片、导线、电压计;
经过酸化的3﹪NaCl溶液;
K3[Fe(CN)6]溶液
将铁片和锌片放入盛有经过酸化的3﹪NaCl溶液的烧杯中,用导线连接并串联一个电压计。
观察现象;
往铁电极附近滴入几滴K3[Fe(CN)6]溶液
现象:
电压计指针;
Fe电极有;
往铁电极附近滴入几滴K3[Fe(CN)6]溶液,溶液,说明溶液中不存在离子,证明铁未被腐蚀。
电极反应方程式
正极:
负极:
测量锌与硫酸反应速率
探究金属钠的物理性质和化学性质
根据锌与稀硫酸放出氢气,比较二者收集10mLH2所用的时间,以此来测量同质量的锌与不同物质的量浓度的硫酸反应的速率。
100mL量筒2个,铁架台(带铁夹),60mL医用针筒2个,秒表1个、托盘天平、球形分液漏斗2个、100mL锥形瓶2个;
1mol/L硫酸、4mol/L硫酸
按如图所示装置安装2套装置,在锥形瓶内各盛2g锌粒(颗粒大小基本相同),通过分液漏斗分别加入40mL1mol/L和40mL4mol/L的硫酸。
比较二者收集10mLH2所用的时间,以此来测量同质量的锌与不同物质的量浓度的硫酸反应的速率。
加入试剂
反应时间/min
反应速率(mol·
L-1·
min-1)
1mol/LH2SO4
思考:
请另写出至少一种测化学反应速率的方法?
(控制变量)
浓度对反应速率的影响
探究浓度对反应速率的影响
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
两支试管、10mL量筒、秒表;
0.01mol/LKMnO4溶液、0.1mol/LH2C2O4(草酸)溶液、0.2mol/LH2C2O4(草酸)溶液
取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向一支试管中加入0.1mol/LH2C2O4(草酸)溶液2mL,记录溶液褪色所需的时间;
向另一支试管中加入0.2mol/LH2C2O4(草酸)溶液2mL,记录溶液褪色所需的时间
0.2mol/LH2C2O4(草酸)溶液
0.1mol/LH2C2O4(草酸)溶液
褪色时间
结论
温度对反应速率的影响
探究温度对反应速率的影响
Na2S2O3+H2SO4Na2SO4+S↓+SO2↑+H2O
4支试管、试管架、大烧杯、玻璃棒、秒表;
0.1mol/LNa2S2O3、冷水、热水、蒸馏水
取两支试管各加入5mL0.1mol/LNa2S2O3;
另取两支试管各加入5mL0.1mol/LH2SO4;
将四支试管分成两组(各有一支试管盛有Na2S2O3和H2SO4的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合搅拌,记录出现浑浊的时间。
试剂种类及用量
0.1mol/LNa2S2O35mL
0.1mol/LH2SO45mL
实验温度
出现浑浊时间
催化剂对反应速率的影响
探究催化剂对反应速率的影响
2H2O22H2O+O2↑
锥形瓶(带双孔胶塞)、漏斗、短导管、木条、酒精灯、火柴;
MnO2、5%H2O2
实验装置如图所示,锥形瓶内盛有5%的H2O2,双孔胶塞上插有短导管和漏斗,短导管里插有带余烬的木条,开始时