人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳Word格式.doc
《人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳Word格式.doc》由会员分享,可在线阅读,更多相关《人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳Word格式.doc(4页珍藏版)》请在冰豆网上搜索。
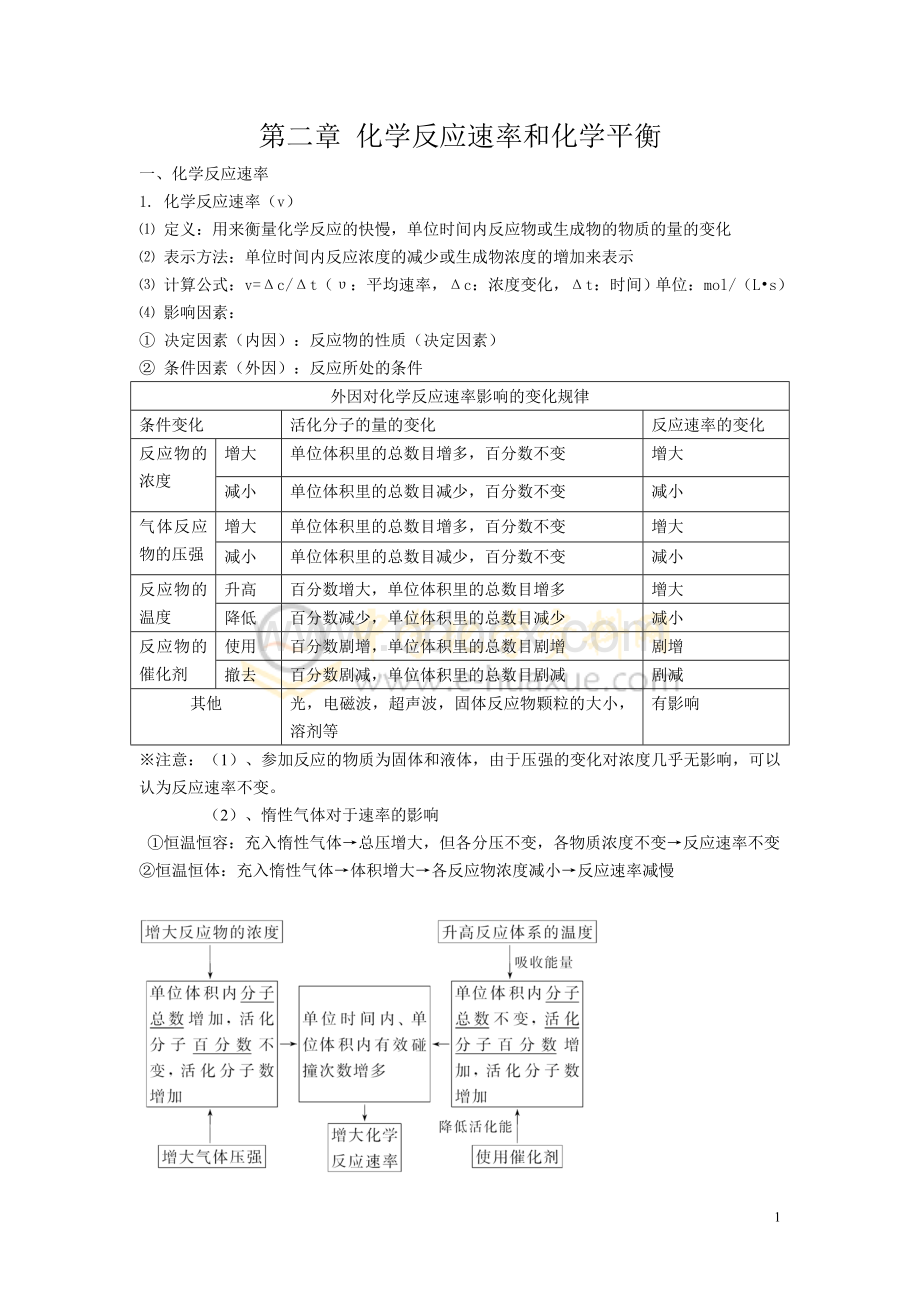
反应所处的条件
外因对化学反应速率影响的变化规律
条件变化
活化分子的量的变化
反应速率的变化
反应物的浓度
增大
单位体积里的总数目增多,百分数不变
减小
单位体积里的总数目减少,百分数不变
气体反应物的压强
反应物的温度
升高
百分数增大,单位体积里的总数目增多
降低
百分数减少,单位体积里的总数目减少
反应物的催化剂
使用
百分数剧增,单位体积里的总数目剧增
剧增
撤去
百分数剧减,单位体积里的总数目剧减
剧减
其他
光,电磁波,超声波,固体反应物颗粒的大小,溶剂等
有影响
※注意:
(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响
①恒温恒容:
充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变
②恒温恒体:
充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢
二、化学平衡
(一)1.定义:
一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征
逆(研究前提是可逆反应);
等(同一物质的正逆反应速率相等);
动(动态平衡)
定(各物质的浓度与质量分数恒定);
变(条件改变,平衡发生变化)
3、判断平衡的依据
判断可逆反应达到平衡状态的方法和依据
例举反应
mA(g)+nB(g)C(g)+qD(g)
混合物体系中
各成分的含量
①各物质的物质的量或各物质的物质的量的分数一定
平衡
②各物质的质量或各物质质量分数一定
③各气体的体积或体积分数一定
④总体积、总压力、总物质的量一定
不一定平衡
正、逆反应
速率的关系
①在单位时间内消耗了mmolA同时生成mmolA,即V(正)=V(逆)
②在单位时间内消耗了nmolB同时消耗了pmolC,则V(正)=V(逆)
③V(A):
V(B):
V(C):
V(D)=m:
n:
p:
q,V(正)不一定等于V(逆)
④在单位时间内生成nmolB,同时消耗了qmolD,因均指V(逆)
压强
①m+n≠p+q时,总压力一定(其他条件一定)
②m+n=p+q时,总压力一定(其他条件一定)
混合气体平均相对分子质量Mr
①Mr一定时,只有当m+n≠p+q时
②Mr一定时,但m+n=p+q时
温度
任何反应都伴随着能量变化,当体系温度一定时(其他不变)
体系的密度
密度一定
如体系颜色不再变化等
(二)影响化学平衡移动的因素
1、浓度对化学平衡移动的影响
(1)影响规律:
在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;
增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动
(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动
(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2、温度对化学平衡移动的影响
影响规律:
在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。
3、压强对化学平衡移动的影响
其他条件不变时,增大压强,会使平衡向着体积缩小方向移动;
减小压强,会使平衡向着体积增大方向移动。
注意:
(1)改变压强不能使无气态物质存在的化学平衡发生移动
(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似
4.催化剂对化学平衡的影响:
由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。
但是使用催化剂可以影响可逆反应达到平衡所需的_时间_。
5.勒夏特列原理(平衡移动原理):
如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。
三、化学平衡常数
(一)定义:
在一定温度下,当一个反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数比值。
符号:
K
(二)使用化学平衡常数K应注意的问题:
1、表达式中各物质的浓度是变化的浓度,不是起始浓度也不是物质的量。
2、K只与温度(T)关,与反应物或生成物的浓度无关。
3、反应物或生产物中有固体或纯液体存在时,由于其浓度是固定不变的,可以看做是“1”而不代入公式。
4、稀溶液中进行的反应,如有水参加,水的浓度不必写在平衡关系式中。
(三)化学平衡常数K的应用:
1、化学平衡常数值的大小是可逆反应进行程度的标志。
K值越大,说明平衡时生成物的浓度越大,它的正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越高。
反之,则相反。
2、可以利用K值做标准,判断正在进行的可逆反应是否平衡及不平衡时向何方进行建立平衡。
(Qc:
浓度积)
Qc〈K:
反应向正反应方向进行;
Qc=K:
反应处于平衡状态;
Qc〉K:
反应向逆反应方向进行
3、利用K值可判断反应的热效应
若温度升高,K值增大,则正反应为吸热反应
若温度升高,K值减小,则正反应为放热反应
*四、等效平衡
1、概念:
在一定条件下(定温、定容或定温、定压),只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的百分含量均相同,这样的化学平衡互称为等效平衡。
2、分类
(1)定温,定容条件下的等效平衡
第一类:
对于反应前后气体分子数改变的可逆反应:
必须要保证化学计量数之比与原来相同;
同时必须保证平衡式左右两边同一边的物质的量与原来相同。
第二类:
对于反应前后气体分子数不变的可逆反应:
只要反应物的物质的量的比例与原来相同即可视为二者等效。
(2)定温,定压的等效平衡
只要保证可逆反应化学计量数之比相同即可视为等效平衡。
五、化学反应进行的方向
1、反应熵变与反应方向:
(1)熵:
物质的一个状态函数,用来描述体系的混乱度,符号为S.单位:
J•••mol-1•K-1
(2)体系趋向于有序转变为无序,导致体系的熵增加,这叫做熵增加原理,也是反应方向判断的依据。
.
(3)同一物质,在气态时熵值最大,液态时次之,固态时最小。
即S(g)〉S(l)〉S(s)
2、反应方向判断依据
在温度、压强一定的条件下,化学反应的判读依据为:
ΔH-TΔS〈0反应能自发进行
ΔH-TΔS=0反应达到平衡状态
ΔH-TΔS〉0反应不能自发进行
(1)ΔH为负,ΔS为正时,任何温度反应都能自发进行
(2)ΔH为正,ΔS为负时,任何温度反应都不能自发进行
4