届高三化学二轮复习理论综合化学反应原理专题训练Word格式文档下载.docx
《届高三化学二轮复习理论综合化学反应原理专题训练Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《届高三化学二轮复习理论综合化学反应原理专题训练Word格式文档下载.docx(12页珍藏版)》请在冰豆网上搜索。
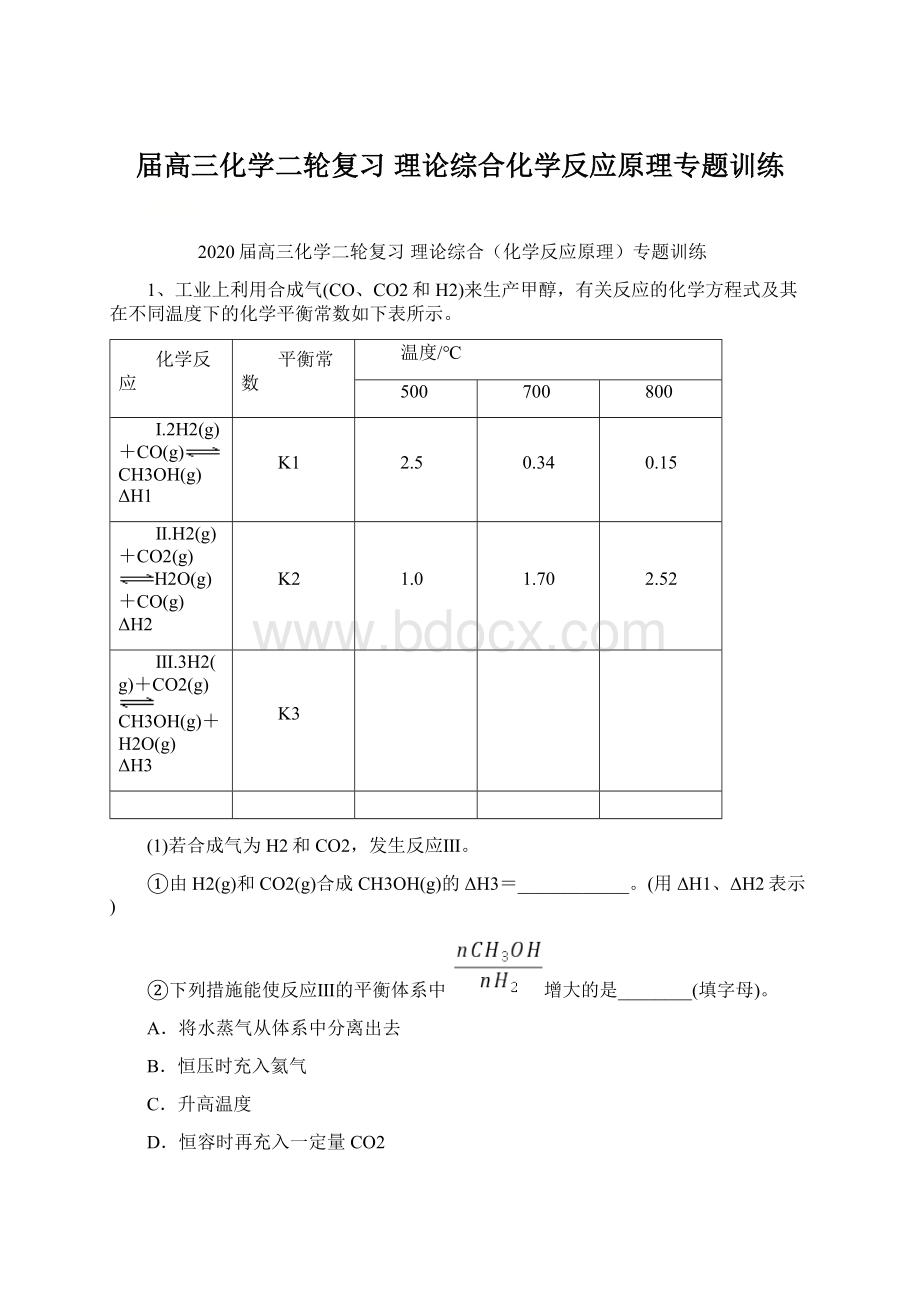
1.0
1.70
2.52
Ⅲ.3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH3
K3
(1)若合成气为H2和CO2,发生反应Ⅲ。
①由H2(g)和CO2(g)合成CH3OH(g)的ΔH3=____________。
(用ΔH1、ΔH2表示)
②下列措施能使反应Ⅲ的平衡体系中增大的是________(填字母)。
A.将水蒸气从体系中分离出去
B.恒压时充入氦气
C.升高温度
D.恒容时再充入一定量CO2
③500℃测得反应Ⅲ在10min时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为2mol·
L-1、1.0mol·
L-1、0.6mol·
L-1,则此时v正______(填“>
”“=”或“<
”)v逆。
从开始到该时刻,用H2表示反应的平均速率为v(H2)=________________________________。
(2)用合成气H2、CO和CO2生产甲醇。
当=a时,体系中CO平衡转化率[α(CO)]与温度和压强关系的一些散点如图1所示。
520K、压强为p时,α(CO)处于C点。
①若保持温度不变,增大压强,则可能是图中的________点(填字母,下同)。
②若保持压强不变,升高温度,则可能是图中的________点。
(3)利用甲醇燃料电池进行电解的装置如图2,其中A、B、D均为石墨电极,C为铜电极。
工作一段时间后断开K,此时A、B两极上生成等物质的量的气体。
①乙中B电极为________(填“阴极”或“阳极”),该电极上生成的气体在标准状况下的体积为________________________________________________________________________。
②丙装置溶液中金属阳离子的物质的量(n)与转移电子的物质的量[n(e-)]变化关系如图3,则图中c线表示的是________(填离子符号)的变化。
答案
(1)①ΔH1+ΔH2 ②AD ③>
0.18mol·
L-1·
min-1
(2)①D ②I (3)①阴极 2.24L ②Cu2+
解析
(1)①反应Ⅰ.2H2(g)+CO(g)CH3OH(g)ΔH1,反应Ⅱ.H2(g)+CO2(g)H2O(g)+CO(g)ΔH2,根据盖斯定律,将反应Ⅰ+反应Ⅱ得反应Ⅲ:
3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH3=ΔH1+ΔH2。
2、Ⅰ.已知:
①NaHCO3(s)===Na+(aq)+HCO(aq) ΔH=+18.81kJ·
mo1-1
②Na2CO3(s)===2Na+(aq)+CO(aq) ΔH=-16.44kJ·
mol-1
③2NaHCO3(s)===Na2CO3(s)+CO2(g)+H2O(l) ΔH=+92.34kJ·
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因______________________________________
________________________________________________________________________。
(2)NaHCO3溶液中主要存在2种化学平衡:
a.HCO+H2OH2CO3+OH-,
b.2HCOCO+H2O+CO2。
根据理论计算0.10mol·
L-1NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):
①计算25℃0.10mol·
L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为_______mol·
L-1。
②加热蒸干NaHCO3溶液最后得到的固体是________。
③25℃时0.10mol·
L-1的NaHCO3溶液的pH=8.3,加热到4min时溶液沸腾,后保温到7min。
已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c/mol·
L-1
饱和
0.20
0.10
0.010
0.0010
pH
12.1
11.8
11.5
11.1
10.6
请在图2中作出NaHCO3溶液的pH随时间变化的曲线。
Ⅱ.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图3:
(1)T1℃时,向1L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为________;
上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol·
s-1的平均速率增多,经ts后再次达到平衡,且平衡时,c(CH4)=2c(C2H4),则t=________s。
(2)列式计算反应2CH4(g)C2H2(g)+3H2(g)在图3中A点温度时的平衡常数K=________(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
(3)由图3可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有____________________________________________。
答案 Ⅰ.
(1)2HCO(aq)===CO(aq)+CO2(g)+H2O(l) ΔH=+38.28kJ·
mol-1,反应需要的能量比固体小
(2)①1.7×
10-3 ②Na2CO3 ③
Ⅱ.
(1)66.7% 5
(2)5.0×
104 (3)充入适量的乙烯
3、“低碳经济”已成为全世界科学家研究的重要课题。
为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:
①CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-41kJ·
②C(s)+2H2(g)CH4(g) ΔH=-73kJ·
③2CO(g)C(s)+CO2(g) ΔH=-171kJ·
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
______________________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。
为探究该反应原理,在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=____________________________。
②下列措施一定不能使CO2的平衡转化率增大的是________(填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。
已知在催化剂存在条件下反应:
CO(g)+H2O(g)H2(g)+CO2(g)中CO的平衡转化率随及温度变化关系如图所示:
①上述反应的正反应方向是________(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=____________________(填表达式,不必代数计算);
如果提高,则Kp________(填“变大”“变小”或“不变”)。
使用铁镁催化剂的实际工业流程中,一般采用400℃左右、=3~5,采用此条件的原因可能是___________。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。
下列关于该电池的叙述错误的是________(填字母)。
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
答案
(1)CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-162kJ·
(2)①0.1125mol·
min-1 ②ACD
(3)①放热 ② 不变 催化剂的活性温度在400℃左右;
投料比太低,CO的平衡转化率不高,而400℃左右,投料比为3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算
(4)A
4、甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
Ⅰ.利用甲醇(CH3OH)制备甲醛
脱氢法:
CH3OH(g)===HCHO(g)+H2(g)
ΔH1=+92.09kJ·
氧化法:
CH3OH(g)+O2(g)===HCHO(g)+H2O(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3=-483.64kJ·
mol-1,则ΔH2=__________________________________________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为______________________________
(3)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。
曲线________(填“a”或“b”)对应脱氢法,判断依据为__________________。
Ⅱ.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。
若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为________。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。
若反应过程中有CO2产生,则该反应的离子方程式为_____________________________________________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。
一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_____________________________
________________________________________________________________________,
当电路中转移4×
10-4mol电子时,传感器内参加反应的HCHO为________mg。
答案
(1)-149.73kJ·
(2)脱氢法的反应为吸热反应,氧化法的反应为放热反应,放热反应在热力学上趋势较大
(3)b 脱氢吸热
(4)3∶2
(5)2Ni2++HCHO+H2O===2Ni+CO2↑+4H+
(6)O2+4e-+4H+===2H2O 3
5、Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3—SCR技术是去除NOx最为有效的技术之一