新疆乌鲁木齐市高三化学100综合题题冲刺训练word含答案Word格式.docx
《新疆乌鲁木齐市高三化学100综合题题冲刺训练word含答案Word格式.docx》由会员分享,可在线阅读,更多相关《新疆乌鲁木齐市高三化学100综合题题冲刺训练word含答案Word格式.docx(100页珍藏版)》请在冰豆网上搜索。
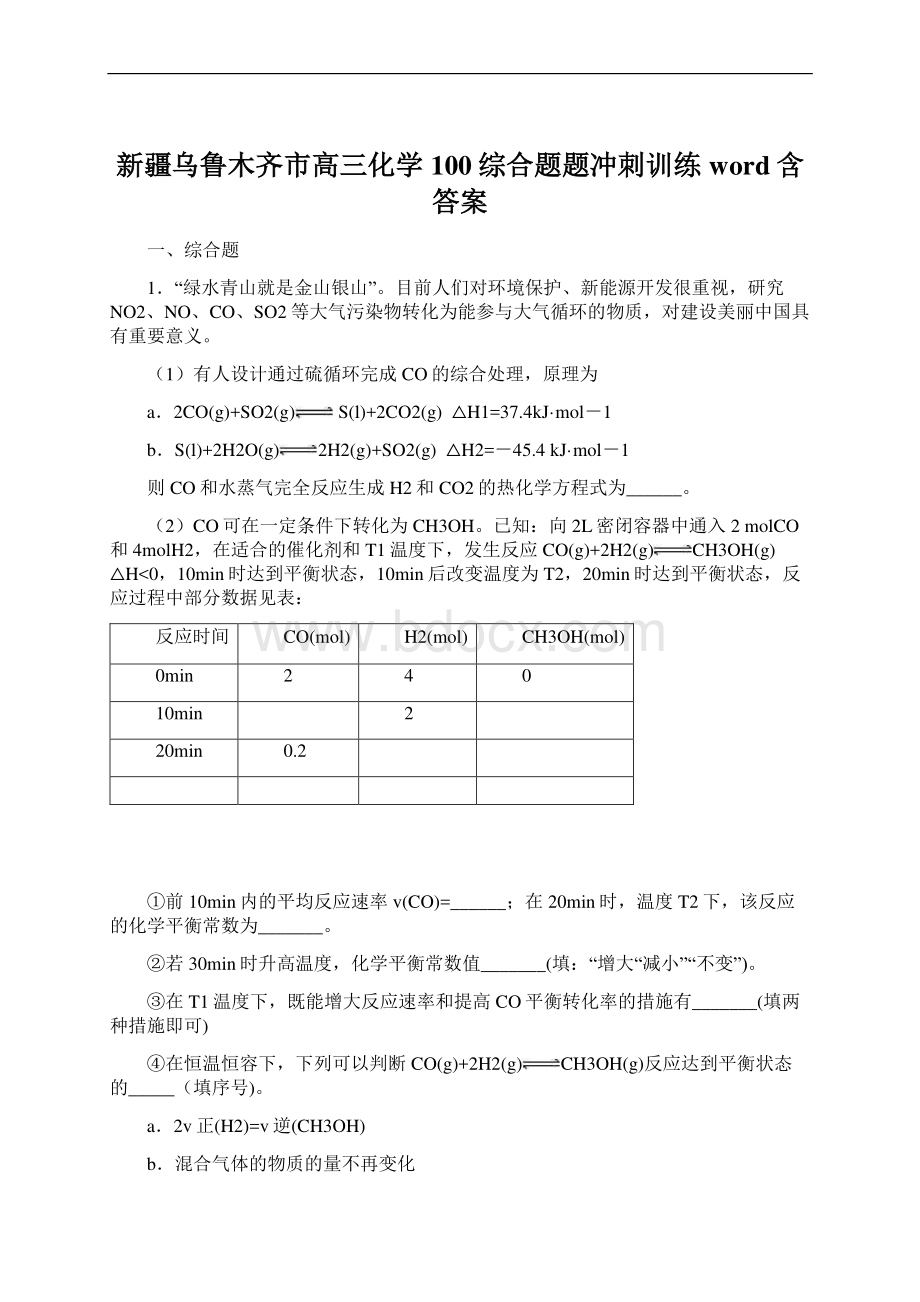
在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_(填两种措施即可)在恒温恒容下,下列可以判断CO(g)+2H2(g)CH3OH(g)反应达到平衡状态的_(填序号)。
a2v正(H2)=v逆(CH3OH)b混合气体的物质的量不再变化c单位时间内有1molCO消耗同时消耗2molH2d混合气体的平均相对分子质量不变(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
则k1=_,m=_,n=_。
2
(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)H1=-574kJ/molCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)H2CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)H3=-867kJ/mol则H2=_。
(2)甲醇催化脱氢可制得重要的化工产品甲醛,制备过程中能量的转化关系如图所示。
写出上述反应的热化学方程式_。
反应热大小比较:
过程I_过程II(填“大于”、“小于”或“等于”)。
上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH):
n(空气)=_。
(已知:
H2(g)+O2(g)=H2O(g)H=-akJ/mol,空气中O2的体积分数为0.2)(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
CO(g)+2H2(g)CH3OH(g)H0当混合气体的组成固定时,CO平衡转化率()与温度和压强的关系如图所示。
图中的压强由大到小顺序为_,判断理由是_;
试解释CO平衡转化率随温度升高面减小的原因是_。
3化台物J是一种重要的有机中间体,可以由苯合成:
(1)B中含氧官能团名称为_
(2)DE的反应类型为_(3)C的分子式为C10H12O2,经取代反应得到D;
写出C的结构简式_。
(4)写出同时满足下列条件的J的一种同分异构体的结构简式_属于芳香族化合物;
不能与金属钠反应;
有3种不同化学环境的氢原子。
(5)已知:
(R表示烃基,R1、R2表示氢或烃基)。
请写出以为原料制备的合成路线图。
(无机试剂任用,合成路线流程图示例见本题题干)。
_4砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为_,基态As原子电子占据最高能级的电子云轮廓图为_形。
(2)第一电离能As_Se(填“”或“”),原因是_。
As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)AlH4-的中心原子的杂化方式为_,其空间构型为_,写出一种与AlH4-互为等电子体的分子的化学式_。
AsH3分子中HAsH键角_109.5(填“”、“=”或“”)。
AsH3沸点低于NH3,其原因是_。
(4)有机砷是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为_(填字母编号)。
a离子键b键c键d碳碳双键(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度为_gcm-3(列式即可,不必化简)。
5运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
ICO还原NO的脱硝反应:
2CO(g)2NO(g)2CO2(g)N2(g)H
(1)已知:
CO(g)NO2(g)CO2(g)NO(g)H1=226kJmol-1N2(g)2O2(g)2NO2(g)H2=68kJmol-1N2(g)O2(g)2NO(g)H3=183kJmol-1脱硝反应H=_,有利于提高NO平衡转化率的条件是_(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,若不使用CO,温度超过775,发现NO的分解率降低,其可能的原因为_;
在n(NO)/n(CO)1的条件下,应控制最佳温度在_左右。
用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:
_。
NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。
已知NO2的水解常数K=210-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2)和c(HNO2)的比值为_。
IIT时,在刚性反应器中发生如下反应:
CO(g)NO2(g)CO2(g)NO(g),化学反应速率v=kPm(CO)Pn(NO2),k为化学反应速率常数。
研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
(3)若反应初始时P(CO)=P(NO2)=akPa,反应tmin时达到平衡,测得体系中P(NO)=bkPa,则此时v=_kPas-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_(Kp是以分压表示的平衡常数)。
6浓度均为0.1molL1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的c(H)分别为a、b、c,则它们的大小关系是_。
(2)分别用三种酸中和等物质的量的NaOH溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是_。
(3)等体积的三种酸分别与足量的锌粒反应,若它们的反应速率分别为a、b、c,则反应开始时它们的大小关系是_。
(4)等体积的三种酸分别与足量的锌粒反应,在相同条件下,若产生气体的体积为a、b、c,则它们的关系是_。
7二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
l.二甲醚的生产:
二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i2CH3OH(g)CH3OCH3(g)+H2O(g)H1
(1)已知:
甲醇、二甲醚的气态标准燃烧热分别为761.5kJmol1、1455.2kJmol1,且H2O(g)=H2O
(1)H=44.0kJmol1。
反应i的H1=_kJmol1。
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如图1所示,生产时,选择的最佳催化剂是_。
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图2所示。
经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii2CH3OH(g)C2H4(g)+2H2O(g)H2=29.1kJmol1工业上生产二甲醚的温度通常在270300,高于330之后,甲醇转化率下降,根据化学平衡移动原理分析原因是_;
根据化学反应速率变化分析原因是_。
某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
则反应i中,CH3OH(g)的平衡转化率=_,反应i的平衡常数Kp=_(用平衡分压代替平衡浓度计算;
结果保留两位有效数字).二甲醚的应用:
(4)图3为绿色电源“直接二甲醚燃料电池”的工作原理示意图:
该电池的负极反应式为:
_;
若串联该燃料电池电解硫酸钠溶液,消耗4.6g二甲醚后总共可在电解池两极收集到13.44L(标况)气体,该套装置的能量利用率为_。
(保留3位有效数字)8二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)C(s)+2H2O(g),再电解水实现O2的循环利用,350时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
若反应起始和平衡时温度相同(均为350),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的H_0(填“”或“”);
其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是_。
图是反应平衡常数的对数与温度的变化关系图,m的值为_。
(2)CO2在Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
.CO2(g)+3H2(g)CH3OH(g)+H2O(g)H10保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
若反应I、II均达平衡时,p0=1.4p,则表中n=_;
反应1的平衡常数Kp=_(kPa)2。
(用含p的式子表示)(3)Al-CO2电池是一种以低温熔融盐Al2(CO3)3为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。
正极反应为:
3CO2+4e=2CO32+C,则生成Al的反应发生在_极(填“阳”或“阴”),该电池充电时反应的化学方程式为_。
9钪(Sc)是一种典型的稀散元素,具有重要的工业利用价值,从钛尾矿(mSc2O3nTiO2xFeOySiO2)中提取Sc2O3的流程如下:
(1)“焙烧”时,为提高焙烧效率,下列措施中无效的是_(填标号)a.不断搅拌b.进一步粉碎固体颗粒c.增大压强d.适当升高温度
(2)“酸浸”时,需在80条件下进行,则适宜的加热方式为_。
(3)“萃取”时,使用伯胺N1923的煤油溶液作为萃取液,萃取率受振荡时间和萃取剂浓度的影响,椴据下表1和表2数据,萃取时适宜的振荡时间和萃取剂浓度分别为_min、_%。
(4)“酸洗”后滤液中存在的金属阳离子有Na+、Sc3+、Ti4+、Fe2+,且浓度均小于0.100molL1,“反萃取”时,加氢氧化钠溶液调节溶液pH=_时,可使Sc3+沉淀完全(当离子浓度减小至105molL1时,可认为沉淀完全),从滤渣中可以回收的金属元素名称为_。
(已知;
lg2=0.3,1g5=0.7;
室温下,Ti4+完全沉淀的pH为1.05,KspFe(OH)2=4.01017,KspSc(OH)3=1.251033)(5)草酸钪Sc2(C2O4)3在空气中“灼烧”的化学方程式为_。
(6)若从1吨该钛尾矿中提取得到110.4gSc2O3,则该矿中含钪的质量分数为_。
10锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收