化工工艺学题库Word格式.doc
《化工工艺学题库Word格式.doc》由会员分享,可在线阅读,更多相关《化工工艺学题库Word格式.doc(13页珍藏版)》请在冰豆网上搜索。
0.005,出口温度应为1000℃左右。
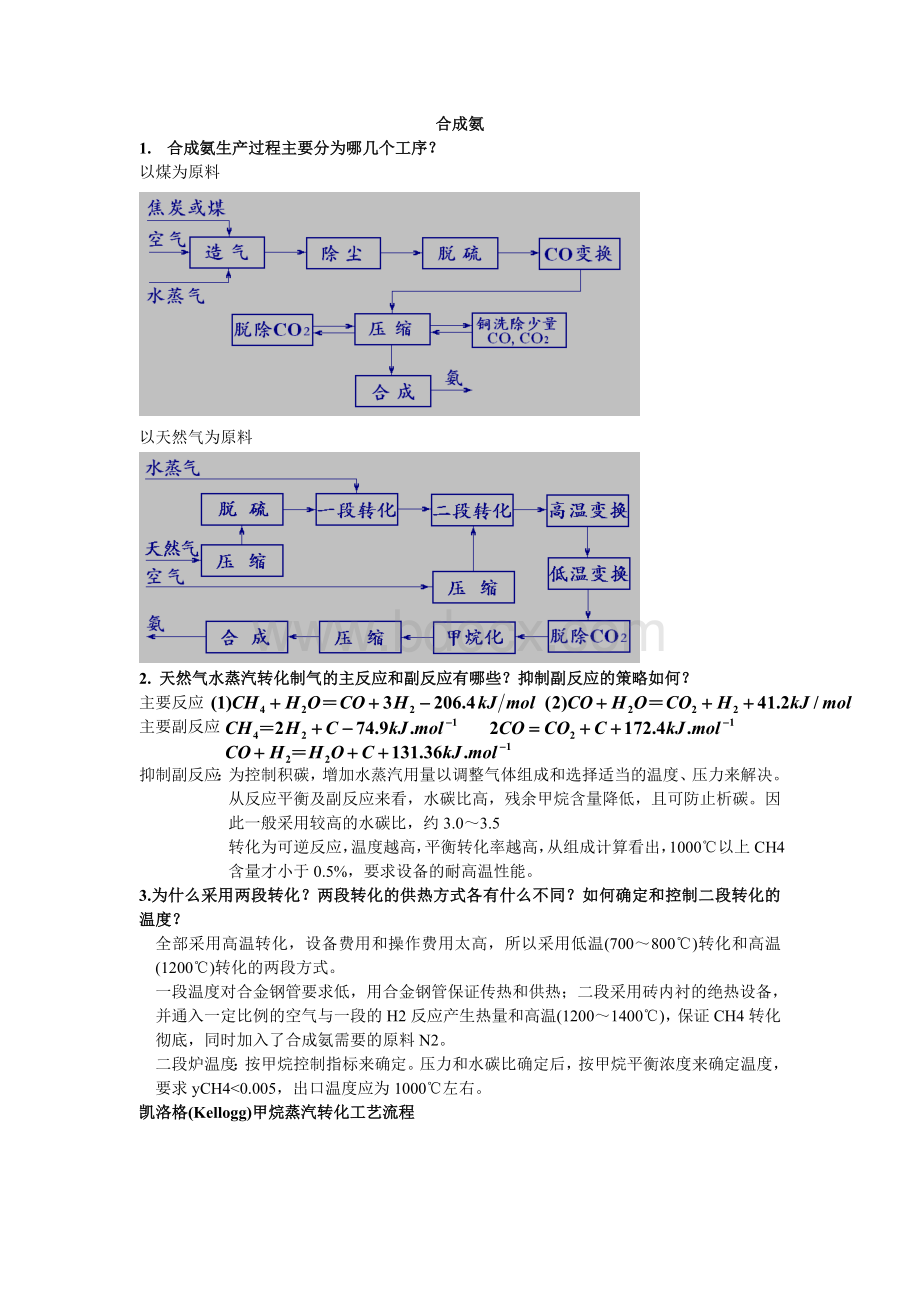
凯洛格(Kellogg)甲烷蒸汽转化工艺流程
1-钴钼加氢反应器;
2-氧化锌脱硫罐;
3-对流段;
4-辐射段(一段炉);
5-二段转化炉;
6-第一废热锅炉;
7-第二废热锅炉;
8-汽包;
9-辅助锅炉;
10-排风机
4.天然气中的硫成分有哪些?
干法脱硫和湿法脱硫的主要方法有哪些?
其适用范围有何区别?
硫化氢(H2S),同时此外还可能有一些有机硫化物,如硫醇(C2H5SH)、硫醚(CH3SCH3)及噻吩(C4H4S)、二硫化碳(CS2)等。
•干法脱硫:
一般适用于含S量较少的情况氧化锌法、钴钼加氢法、氢氧化铁法、活性碳法等
•湿法脱硫:
一般适用于含S量较大的场合化学吸收法、物理吸收法和化学物理综合吸收法等
5.氧化锌脱硫的工作原理是什么?
其工艺流程和工艺条件如何?
氧化锌脱硫法也可以脱除硫醇、硫醚等有机硫,但反应速度较慢,一般选择较高的温度350~400℃,才能获得较快的反应速度。
反应式如下:
在有H2存在时,一些有机硫可先转化为H2S,再被氧化锌所吸收,反应式如下:
流程1:
硫含量较高流程2:
硫含量较低
6.变换工序的反应原理和主要任务是什么?
为什么要分中温变换和低温变换?
是将原料气中的CO变成CO2和H2。
H2是合成氨需要的原料成份,CO2在后面的脱碳和甲烷化两个工序中除去,作为生产尿素或食品级CO2的原料。
变换反应为放热反应,温度升高,平衡常数减小。
为了变换过程进行彻底,要求尽可能低的反应温度;
但温度低,反应速度必然减缓
7.苯菲尔脱碳的主要化学反应和脱碳原理是什么?
再生指数(碳化度)的定义是什么?
原理:
CO2的吸收过程是CO2与K2CO3反应生成KHCO3。
但是由于受反应速度的限制,气体中CO2与溶液中K2CO3的反应速度较慢。
为了加快CO2在K2CO3溶液中的吸收速度,通常在K2CO3溶液中又添加了一种催化剂二乙醇胺
再生指数(碳化度)的定义:
每摩尔K2CO3所已经吸收的CO2摩尔数,即溶液中K2CO3转化为KHCO3的转化度。
化肥
1.描述由NH3和CO2合成尿素的化学反应过程与相态。
(重点)
上述两个反应中,第一个反应为快速放热反应,反应程度很大,生成溶解态的氨基甲酸铵;
第二个脱水生成尿素的反应为慢速吸热反应,且为显著可逆反应。
2.尿素合成反应过程的主要副反应及控制措施。
(熟悉就行)
当温度在60℃以下时,尿素水解缓慢;
温度到100℃时尿素水解速度明显加快;
温度在145℃以上时,水解速度剧增。
尿素浓度低时,水解率大。
氨也有抑制尿素水解的作用,氨含量高的尿素溶液的水解率低。
3.尿素生产的氨汽提法流程中,合成塔出来的尿素溶液主要经过了那些设备,溶液的温度、压力、组成如何?
(常识了解)
设备:
气提塔,降膜分解器,
目前,工业合成尿素的方法都是在液相中由NH3和CO2反应合成的,
温度的影响:
温度较低时平衡转化率随温度升高而增加,在190℃时达最大,温度进一步升高,平衡转化率反而下降。
一般选择尿素合成温度为180~190℃
组成的影响:
CO2过量对转化率影响很小,氨过量则明显提高转化率。
氨碳比的影响如右图。
水碳比增加0.1,转化率下降约1%。
不同工艺选择的合成过程物料比不同。
如:
水溶液全循环法氨碳比4.0,水碳比0.65~0.7;
汽提法工艺氨碳比2.9~3.1,水碳比0.3~0.4。
压力的影响:
压力对液相反应的影响很小。
但由于体系存在惰性气体和气液平衡,操作压力应该大于平衡压力
4.硝酸铵的主要用途是什么?
1.硝铵是重要的氮肥,特别适用于温度低的旱田。
还是制造复合肥料的原料。
2.硝铵是炸药的主要原料。
3.硝铵还是制麻醉剂(N2O,笑气)的原料。
5.湿法磷酸是用磷酸为催化剂、硫酸溶液分解磷矿的过程,磷矿以Ca5F(PO4)3为主,还有Si、Fe、Al等杂质元素,试分析一下反应过程的主、副反应及其产物,并说明副反应对反应过程的影响。
主反应:
一步反应过程
两步反应过程:
副反应:
副反应不仅损失磷,而且沉淀会包裹在矿石表面,阻止酸分解反应的进一步进行,产生“钝化现象”。
硫酸和硝酸
1.工业上曾经氧化SO2制硫酸的方法有哪些?
写出其主要反应式。
亚硝基法和接触法
亚硝基法
接触法
S+O2→SO22SO2+O2→2SO32SO3+H2O→H2SO4
2.硫铁矿的主要成分是什么?
焙烧硫铁矿的主要化学反应有哪些?
FeS2
2FeS2=2FeS+S2S2+O2=SO2
3.焙烧硫铁矿的设备是什么?
根据物料状态,设备内可分几个区域?
各区域的物料特点是什么?
t/℃
lgk
441560727977
沸腾培烧炉
460~560℃为第一阶段,斜率大,活化能大。
温度升高,反应速率增加很快。
化学反应受动力学(速度)控制。
560~720℃为过渡阶段,反应速度受温度影响较小。
>
720℃为第三阶段,反应速度随温度升高再增加,但增加幅度小。
实验证明,第三阶段活化能较小,焙烧反应主要受氧扩散的控制。
4.SO2氧化为SO3的温度、压力、SO2含量等工艺条件如何?
温度:
在催化剂活性温度范围内催化剂床层温度应沿最佳温度线变化,即先高后低
压力:
二氧化硫氧化反应是体积减小的反应,提高压力可提高平衡转化率
SO2含量:
根据硫酸生产总费用最低的原则来确定二氧化硫的起始浓度,最适宜的最终转化率与所采用的工艺流程、设备和操作条件有关。
5.SO3的吸收过程通常采用发烟硫酸或/和浓硫酸吸收,为什么采用浓度为98.3%的浓硫酸?
浓度太高、太低有什么影响?
确定吸收塔操作温度主要考虑哪些方面的因素?
如图所示,在任何温度下选择浓度为98.3%的硫酸作为吸收液比较合适。
若吸收酸浓度太低,因水蒸气分压增高,易形成酸雾;
但若吸收酸浓度太高,则液面上SO3分压较高,气相中的不能完全被吸收。
因为标准发烟硫酸游离SO3浓度为21%。
从上表看出,在气体中SO3浓度为7%时,则说明吸收酸温不能超过80℃。
不同转化气SO3浓度下,SO3吸收率与温度的关系如右图所示,其中7.4%的曲线与上表数据一致。
可见,温度升高,吸收率下降;
气相SO3浓度增加,吸收率上升。
6.制硝酸氨氧化的主要反应,其相态、热效应、反应平衡、催化剂等有什么特点?
主要副反应有哪些?
主反应
副反应
在反应温度下,上述反应的平衡常数都很大。
如果对反应不加控制,氨和氧反应的最终产物必然是N2。
要得到希望的产物NO,不能从反应热力学去改变化学平衡来达到目的,只能从反应动力学方面去着手。
即寻找一种选择性的催化剂,抑制不希望的反应。
目前最好选择性的催化剂是铂。
纯碱和烧碱复习思考题
1.纯碱中的重碱是什么意思?
密度为0.95~1.07g/cm-3的纯碱
2.氨碱法制纯碱的主要原料有哪些?
制碱过程的主要反应有哪些?
主要副产物是什么?
原料:
氯化钠(NaCl)和碳酸钙(CaCO3)
主要反应
主要副产物CaONH4Cl
3.从干盐相图分析,为什么在P1点NaHCO3的结晶析出最多?
且Na利用率最高?
如何控制操作点的位置。
升高温度对最佳操作点P1、Na利用率和NaHCO3结晶有什么影响?
右图中,ⅠP2、P2Ⅱ、P2P1、P1Ⅲ、P1Ⅳ为饱和线;
1,2,3区为NaHCO3、NH4HCO3、NH4Cl的析出区;
P1点可析出三种结晶。
氨盐水碳酸化后的组成在AC线上。
如果只需析出NaHCO3时,组成应R-S线内,超过S析出NH4HCO3,超过R析出NaCl。
如果总组成在X点,T点为饱和溶液,结晶与溶液比为TX:
XD,比值越大,析出结晶越多。
可见P1点操作最好。
4.氨盐水碳化是在什么设备中进行的?
CO2经氨盐水吸收,生成氨基甲酸铵、碳酸氢铵、最终生成碳酸氢纳,各步骤的速度、温度有何特点?
氨盐水碳酸化是在碳酸化塔中进行
随着CO2的不断溶解,溶液中过量的氨基甲酸铵进一步发生水解反应。
甲铵水解是慢反应,是碳酸化的控制步骤:
当PH值>
10.5的强碱性时,碳酸氢盐也存在下述离解反应
当氨盐水被碳酸化达到一定程度,HCO3-积累超过溶度积,析出碳酸氢钠:
氨盐水进塔温度约30~50℃,中部温度升到60℃左右,中部不冷却,但下部要冷却,控制塔底温度在30℃以下,保证结晶析出。
碳化塔中部温度高,一方面反应本身有一些热量放出,另一方面主要是考虑结晶初期温度高一点对晶粒长大有利,可形成较大晶体以利过滤。
同时冷却速度不宜过快,过快可能形成结晶浆,难于过滤分离。
5.工业生产烧碱的方法有哪些?
电解法生产烧碱的原料、电极反应、总化学反应是什么?
精制食盐水时,其中的镁、硫酸根杂质如何去除?
方法:
生产氢氧化钠通常用电解法(NaCl为原料)、苛化法(Na2CO3为原料)。
NaCl水溶液
电极反应:
总反应:
除去杂质:
去除镁离子的方法用OH-而沉淀Mg(OH)2出来:
少量硫酸盐对电解过程影响大,在这一步也要除去:
煤的化学加工
1.煤的结构及煤气化原理。
煤的基本结构单元为缩合芳烃及环烷烃及多种侧链,杂原子及官能团。
网络结构模型-整体平均结构单元模型-有机质
煤气化原理:
煤气化是煤与气化剂作用生成气体混合物的反应过程。
目的是将煤转化成可
燃气体。
煤气化过程包含煤的热解、半焦的气化等过程。
2.煤气化主要方法及能量利用。
煤气化方法有多种,气化炉也有多种。
可分为固定床、沸腾床、气流床三种形式。
3.费托合成原理。
化学反应
基本反应:
nCO+2nH2(CH2)n+nH2O
△H=-158kJ/mol