浙江省稽阳联谊学校届高三联考化学试题Word格式文档下载.docx
《浙江省稽阳联谊学校届高三联考化学试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《浙江省稽阳联谊学校届高三联考化学试题Word格式文档下载.docx(28页珍藏版)》请在冰豆网上搜索。
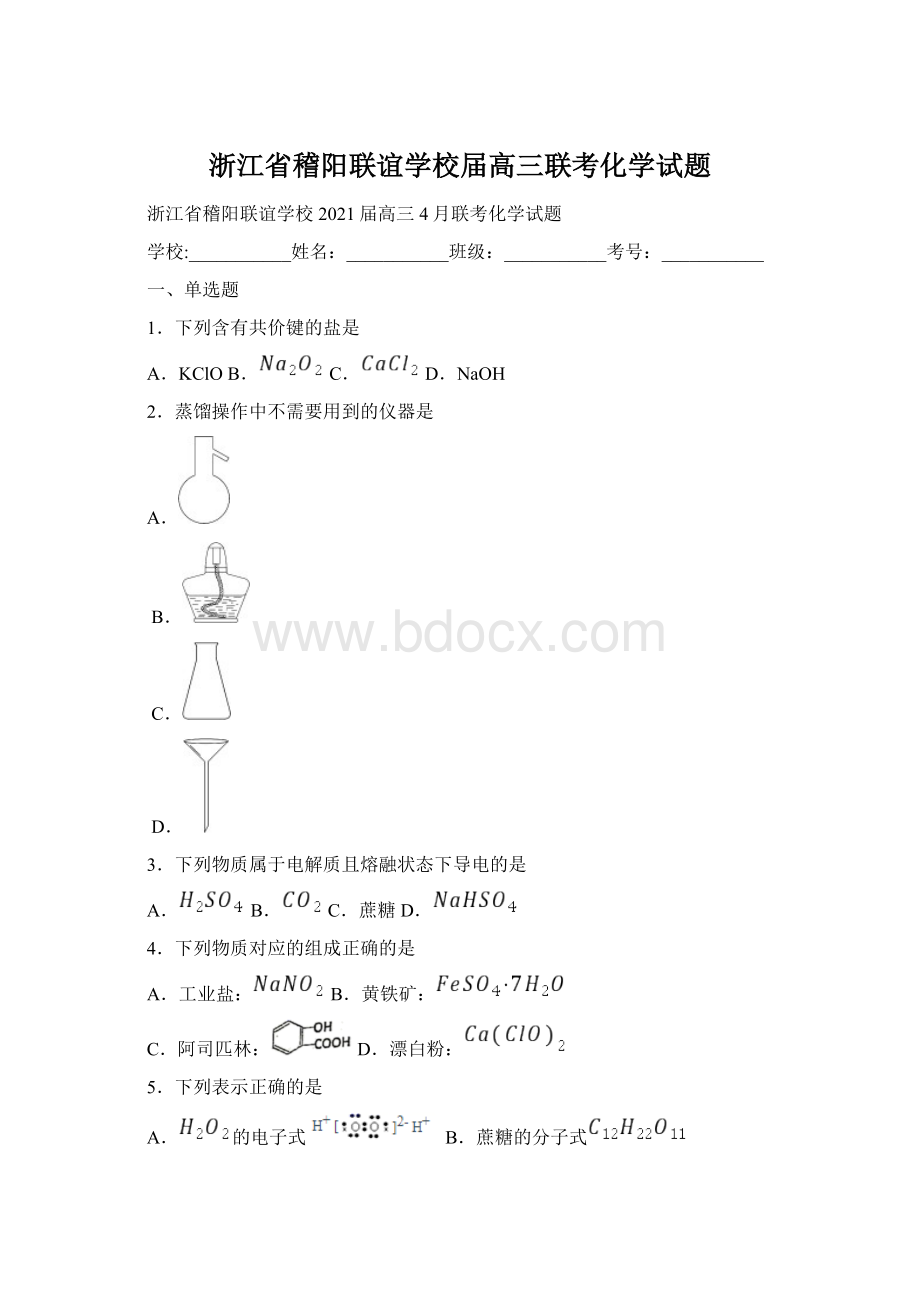
C.乙炔的比例模型D.甲酸甲酯的键线式
6.下列说法正确的是
A.储热材料可用于光—热能的转换
B.石油裂化和裂解的目的均是为了将长链烃转化为短链气态烃
C.天然气的主要成分是甲烷,它是最简单的有机物
D.煤的气化、液化和干馏是煤综合利用的主要方法,属于物理变化
7.下列说法不正确的是
A.与互为同素异形体B.邻二甲苯不存在同分异构体
C.与不可能互为同系物D.与互为同位素
8.下列说法不正确的是
A.胶体呈红褐色,可用于净水
B.铝合金作为耐火材料,常用于建筑业、交通运输业及电子行业
C.铵盐能与碱反应放出氨气,因此应避免将铵态氨肥与碱性肥料混合施用
D.高压钠灯,发出黄光、透雾能力强,常用于道路和广场的照明
9.下列说法正确的是
A.工业上通过电解可制取金属镁
B.工业上或实验室用亚硫酸钠与70%的浓硫酸反应制备二氧化硫
C.工业上以纯碱、石膏和石英为原料制取玻璃
D.往海水晒盐的母液中通入氯气,再用有机溶剂萃取,可以得到溴单质
10.关于反应,下列说法不正确的是
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为2:
1
C.每生成1mol,转移8mol电子
D.相同条件下,每吸收5就会放出1.25
11.下列说法不正确的是
A.受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗
B.用冷却结晶的方法提纯含有少量KCl的晶体
C.如图将浸有水溶液的滤纸悬挂于浓硫酸中,滤纸由粉红色变为蓝色
D.探究影响与稀反应速率的因素时,可通过观察产生气泡快慢判断
12.下列“推理”正确的是
A.氯气能使湿润的pH试纸褪色,可推出氯气具有漂白性
B.NaC1固体与浓加热可制HCl,可推出NaI固体与浓加热制HI
C.将钠投入水中,观察到钠浮在水面且熔成小球,可推出钠密度比水小且反应放出热量
D.,可推出酸性强弱:
13.下列离子方程式正确的是
A.苯酚钠溶液中通入少量:
B.含、、的溶液中通入氯气:
C.将过量的通入到氨水中:
D.在硫酸铜溶液中加入足量溶液:
14.下列说法不正确的是
A.工业上常通过油脂在碱性条件下的水解反应生产高级脂肪酸、肥皂和甘油
B.氨基酸以两性离子的形态存在时,水中溶解度最小,可以形成晶体析出
C.将脱脂棉加入深蓝色的铜氨溶液中可以制备铜氨纤维
D.在葡萄糖溶液中,链状的葡萄糖分子几乎全部转变为环状结构
15.光刻胶是制芯片过程中用到的一种功能性胶水,其中一种胶水的主要成份是聚乙烯醇肉桂酸酯,可通过如下反应制得:
下列有关说法正确的是
A.该反应属于缩聚反应B.聚乙烯醇的单体是乙烯醇
C.肉桂酸的9个碳原子不可能共平面D.聚乙烯醇肉桂酸酯可溶于NaOH溶液中
16.中国科学院院士张青莲教授曾主持测定了铟()等9种元素相对原子质量的新值,被采用为国际新标准。
铟与铷()同周期,下列说法正确的是
A.原子半径:
B.的中子数与电子数的差值为27
C.In是第四周期第ⅢA族元素D.碱性:
17.25℃时,下列说法正确的是
A.向冰醋酸中加水,氢离子浓度减小
B.的醋酸溶液和的醋酸溶液,酷酸浓度前者是后者的10倍
C.浓度均为0.1的三种溶液:
NaClO、、,pH依次增大
D.的盐酸和的MOH溶液等体积混合后,恰好完全反应,所用盐酸的浓度等于MOH溶液的浓度
18.设为阿伏加德罗常数的值,下列说法正确的是
A.100mL18的溶液中含有数为3.6
B.个分子形成的晶体中电子对数目为4
C.NaH+H2O=NaOH+H2,则每生成1molNaOH转移电子数为
D.30克甲醛和乙酸的混合物,完全燃烧转移电子数为2
19.为探究对分解是否有催化作用,分别取10mL30%(约10)于四支试管中,控制其它条件相同,进行实验获得如下表数据(氧气为标准状况下的体积):
实验编号
所加药品
控制温度/℃
生成氧气平均速率()
第1个3min
第2个3min
第3个3min
①
1mL1.0
20
2.4
2.7
2.8
②
30
9
10
③
40
90
63
28
④
1mL
1.0
1.2
1.3
下列有关说法不正确的是
A.对分解有催化作用
B.对分解催化效率可能随温度升高而提高
C.实验③第1个3min的平均反应速率约为
D.为得到更可靠的结论,实验①②③还需排除
20.M经光照可转化成N,转化过程如下:
,下列说法正确的是
A.N的能量低,N相比M更稳定
B.M生成N的过程中会形成过渡态,过渡态和N的能量差就是该反应的活化能
C.碳碳单键的键能为akJ/mol,碳碳双键的键能为bkJ/mol,
D.M和N的标准燃烧热相同
21.高能燃料乙硼烷是一种强还原性物质,结构与乙烷不同,性质很活泼,在空气中自燃且易水解,下列有关说法正确的是
A.的结构简式为
B.可用和稀硫酸反应制备:
C.可以与发生反应:
D.可与甲醇反应:
22.电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子;
在经一系列水解、聚合及氧化过程,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。
下列说法不正确的是
A.若铁为阳极,则阳极电极方程式为和
B.阴极电极反应式为
C.每产生1molO2,整个电解池中理论上转移电子大于4mol
D.若铁为阳极,则在处理废水的过程中阳极附近只发生:
23.常温下,将0.1NaOH演到0.1溶液中,混合溶液的pH与离子浓度变化关系如图所示,下列叙述不正确的是
A.常温下,醋酸的电离平衡常数
B.在的过程中水的电离是先抑制后促进
C.C点的溶质可能为和
D.当0.1NaOH和0.1溶液以体积比1:
2混合时,
24.恒容绝热的密闭容器中充入反应物,在一定条件下分别发生四个不同的反应,平衡常数与压强随反应进行变化情况合理,且在高温下能自发进行的是
25.下列方案设计、现象和结论都正确的是
目的
方案设计
现象和结论
A
检验某溶液中可能含有的、
取少量该溶液于试管中,先加溶液(若有沉淀则滤去),再加溶液
若加入溶液有沉淀则有,过滤后加溶液后有沉淀则有
B
探究速率的影响因素
金属钠与浓盐酸、与水反应进行对照实验
金属钠与浓盐酸反应比金属钠与水反应速率更慢,则浓盐酸中较小
C
检验火柴头中的氯元素
摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加、稀
若观察到白色沉淀,则含氯元素
D
检验某未知溶液中是否有蛋白质
取少量该溶液于试管中,加入双缩脲试剂
溶液出现紫玫瑰色,该溶液不一定含有蛋白质
A.AB.BC.CD.D
二、填空题
26.
(1)甲烷和苯都不能使酸性高锰酸钾溶液褪色,甲苯却可以使其褪色,主要原因是_______。
(2)常温下硝酸为液体且易挥发,尿素为固体,两者沸点高低差异的可能原因是_______。
三、计算题
27.某实验小组制备,取1.12g实验制得的产物(已知的相对分子质量为158.6)加水溶解,配成100mL溶液,用移液管取出25.00mL于锥形瓶中,滴入几滴作指示剂,已知为砖红色沉淀,用浓度为0.100的硝酸银标准溶液滴定,重复滴定三次测得硝酸银标准溶液用量分别为19.98mL、18.00mL、20.02mL。
(1)产物的纯度为_______(保留三位有效数字);
(2)写出简要计算过程:
_______。
四、元素或物质推断题
28.由三种短周期元素组成的化合物X是易挥发的无色液体,存在如下转化关系。
其中未用硫酸酸化且恰好完全反应,沉淀A是混合物,G的结构与相似。
请回答:
(1)组成X的三种元素是_______(填元素符号)。
(2)写出化合物X与溶液反应的化学方程式_______。
(3)G遇水反应生成沉淀、气体,写出反应的化学方程式_______。
(4)①将灼烧至红热的铁丝迅速伸入盛有气体C的集气瓶中,观察到的现象是_______。
②向反应后的集气瓶中加适量水,充分振荡,滴入几滴KSCN,观察到溶液变血红色,能说明反应生成了+3价铁吗?
说明原因_______。
五、原理综合题
29.乙烷在一定条件可发生如下反应:
。
已知平衡分压可以代替平衡浓度计算平衡常数,分压总压物质的量分数。
(1)每1mol下列物质分解为气态基态原子消耗的能量(单位为kJ)分别为
2816
2267
436
则_______。
(2)下列说法不正确的是_______。
A.加压和升温都能提高该反应的转化率
B.寻找合适的催化剂,可以提高一定时间内乙烷的分解率
C.乙烯和氢气的物质的量比值不再改变,可以判断该反应达平衡
D.等物质的量的乙烷和氢气,等压(p)发生反应,乙烷的平衡转化率为,平衡常数
(3)高温下,丁烷生成乙烷的反应如下:
。
该反应的正逆反应速率可以表示为:
v正=k正×
,v逆=k逆×
,k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。
①对于该反应,乙烷生成速率逐渐_______(填写“增大”、“减小”或“不变”),理由是_______。
②一定温度下,1L恒容密闭容器中加入2mol发生上述反应,测得丁烷和乙烷物质的量浓度随时间变化如图,则图中a点正、逆反应速率之比v正:
v逆=_______。
(4)一定温度和压强下,、、的比热容分别为1.73、1.57和14.0。
当消耗1mol时,反应物的能量随温度T的变化如图,请画出生成物的总能量随温度变化的示意图_______。
六、工业流程题
30.锌焙砂(主要成分是ZnO,含较多的Fe及少量Cu、S、Cl等杂质)制备和Zn的主要流程如下:
已知:
①生成黄钾铁矾的反应是:
②黄钾铁矾难溶于水,且易于结晶,其形成与pH和温度的关系如图
金属离子
pH
开始沉淀
完全沉淀
5.4
8.2
1.5
5.5
8.3
4.2
6.7
(1)步骤③是的操作I是_______,步骤⑤中的操作是_______。
(2)步骤④需控制,为什么?
(3)下列说法正确的是_______。
A.工业上用铝作阴极,铅银合金作阳极,直接电解浸出液获得锌
B.蒸发浸出液获取时,需要加少量稀,抑制水解
C.步骤①研磨后的矿粉中要加入少量,目的是浸出时将氧化为
D.步骤④的目的是将铁元素转化为更易沉降的黄钾铁矾,并回收固液混合物中的锌元素,提高产率
(4)锌有优良的大气抗腐蚀性能,因而常用于生产含锌喷涂材料及钢铁铸件的表面防腐。
但镀锌层的厚度对耐蚀性能有直接影响。
下表是某班级课堂实验时获得的一组数据:
长/cm
宽/cm
与酸反应前质量/g
与酸反应后质量/g
镀锌铁皮A
7.00
5.70
17.933
17.760
镀锌铁皮B
6.80
5.30
16