第二章溶液Word文件下载.docx
《第二章溶液Word文件下载.docx》由会员分享,可在线阅读,更多相关《第二章溶液Word文件下载.docx(33页珍藏版)》请在冰豆网上搜索。
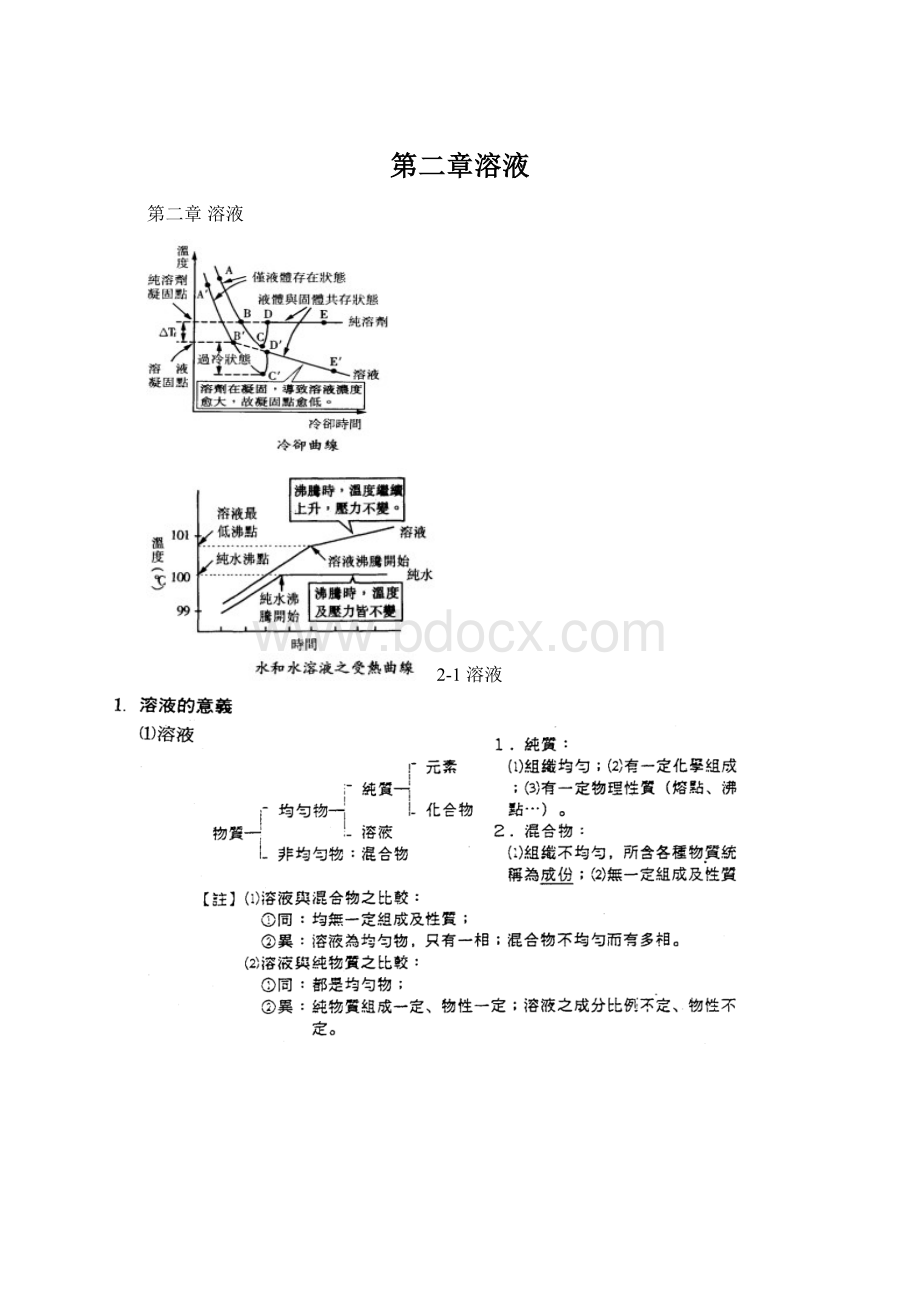
VmL=溶質mmol數
【例4】
【類3】
(Ans.0.2M)
【例5】
【類4】
(Ans.)
【例6】
※使用於溫度變化大的實驗。
【例7】
【類5】
(Ans.0.5m)
【例8】
【類6】
(Ans.0.853m)
【例9】
【類7】
(Ans.0.05)
【例10】
甲醇水溶液中甲醇的莫耳分率為0.40,乙之甲醇為2莫耳,試求溶液中水的莫耳數?
【類8】
(Ans.5.56mol)
【例11】
【類9】
(Ans.90mL)
或1m3混合氣體中,某氣體之mL數。
【例12】
※濃度有涉及體積者會隨溫度變化而改變其值
3.配製溶液
【例13】
如何配製1.00M硫酸銅水溶液1升?
(Cu=64,S=32)
【類10】
(Ans.秤取4.14克Pb(NO3)2,以適量水完全溶解後,移入25mL容量瓶中再加水至刻度線為止)
【例14】
※體積無加成性,質量才有加成性
4.濃度換算
2.(%、Cm、X)內之互換,不需知道溶液比重;
但(%、CM、X)與CM間之互換,則
需知道溶液比重。
【例15】
【例16】
【例17】
【例18】
※甘油C3H5(OH)3=92;
葡萄糖C6H12O6=180;
蔗糖C12H22O11=342;
尿素CO(NH2)2=60
【例19】
【例20】
【類11】
(ans.0.0574)
【類12】
(Ans.0.0177)
【類13】
(Ans.
【類14】
(Ans.0.221)
【類15】
(Ans.
【類16】
(Ans.D)
5.溶液的稀釋
【例21】
【類17】
(Ans.
(1)0.10M
(2)0.25M(3)1:
3)
【例22】
2-3溫度、壓力對溶解度的影響
(3)
(4)過飽和溶液的配製法
a.
b.AgI+乾冰實施人造雨的原理:
乾冰用以冷卻水蒸氣;
AgI作為晶種,
使過飽和水蒸氣得以凝結。
【例23】
【例24】
【例25】
【例26】參考例21之溶解度曲線作答
三、再結晶
1.原理:
利用不同物質「溶解度之溫度依存性」的不同進行物質之純化(分離)。
2.方法:
高溫時利用溶劑把要再結晶之物質(溫度依存性很大者)完全溶解趁熱過濾(溫度依存性很小者可能濾除一部分)濾液冷卻至低溫。
※趁熱過濾之要領:
(溶液過濾速度愈快愈好)
(1)濾紙摺成波浪形;
(2)使用無莖幹漏斗;
(3)漏斗先泡溫熱水。
【例27】
【例28】
【類18】
(Ans.98.5%)
四、溶質發生化學反應時之溶解與結晶
【例29】
【例30】
五、影響溶解度之因素
(2)溫度因素
固體溶質:
A.大部分固體溶質溶於水為吸熱反應,所以溶解度隨溫度之升高而增大。
此類物質可用危及救冰袋之材料,如NH4NO3;
氣體溶質
氣體溶質溶於水均為放熱反應,所以溶解度隨溫度之升高而降低。
(此因溫度上升時,氣體分子動能增大,可以掙脫溶劑束縛而返回氣相)
【例31】
四、亨利定律
(因氣體碰撞液面之頻率該氣體分壓)
c=kHP(c:
溶解的氣體濃度;
kH:
亨利常數;
P:
氣體溶質之分壓)
※亨利常數(mM/atm)值:
溫度愈低、分子引力愈大(沸點愈高),則亨利常數愈大
N2
O2
CO
Ar
He
0℃
1.1
2.5
1.6
0.41
25℃
0.67
1.3
0.96
1.5
0.40
30℃
0.89
0.44
1.0
0.38
(HCl之kH=12M/atm)
打開汽水或可樂瓶蓋,即湧出大量氣泡。
【例32】
【例33】
【類19】
(Ans.93mL)
【例34】
【例35】
2-4溶液中離子的反應
(CaSO4、Ca(OH)2微溶)
【例36】
三、沉澱及水溶液中的離子之顏色、焰色試驗
(1)白色:
AgCl,Hg2Cl2,PbCl2,Mg(OH)2,Al(OH)3,PbSO4,SrSO4,BaSO4
,MgCO3,CaCO3,ZnS
淡黃色:
AgBr
黃色:
AgI,PbI2,PbCrO4,BaCrO4,CdS
黑色:
CuS,PbS,Ag2S,HgS
磚紅色:
Ag2CrO4
藍色:
Cu(OH)2
綠色:
Cr(OH)3
黑褐色:
Ag2O
黃褐色:
Fe(OH)3
(2)MnO4-紫色,MnO42-綠色,Mn2+淡紅色,Cr2O72-橙色,CrO42-黃色,Cr3+綠色,
Fe3+淡黃色,Fe2+淡綠色,Cu2+藍色,Cu(NH3)42+深藍色
(3)焰色:
Li+紅,Na+黃,K+紫,Ca2+磚紅,Sr2+深紅,Ba2+黃綠
四、水溶液中離子的鑑別
【例37】
【類20】
(Ans.D)
【類21】
(Ans.B)
【例38】
【類22】
(Ans.DE)
故Al3+Be2+Al(OH)3(s)Be(OH)2(s)Al(OH)4-Be(OH)42-
Zn2+Cr3+Zn(OH)2(s)Cr(OH)3(s)Zn(OH)42-Cr(OH)4-
Sn2+Pb2+Sn(OH)2(s)Pb(OH)2(s)Sn(OH)42-Pb(OH)42-
※Al2S3、Cr2S3與水反應生成H2S及Al(OH)3、Cr(OH)3,故水中無法生
成Al2S3、Cr2S3沉澱(而是生成Al(OH)3、Cr(OH)3沉澱)
(合為灰色)
PbCl2(s)Pb2++2Cl-(溶解)
【註】Ag(NH3)2++Cl-+2H+AgCl(s)+2NH4+
5.可溶於氨水NH3(aq)之氫氧化物或氧化物:
Co(OH)2,Ni(OH)2,Cu(OH)2,Zn(OH)2,Ag2O,Cd(OH)2
故:
Co2+Ni2+Co(OH)2Ni(OH)2Co(NH3)62+Ni(NH3)62+
Cu2+Zn2+Cu(OH)2Zn(OH)2Cu(NH3)42+Zn(NH3)42+
Ag+Cd2+Ag2OCd(OH)2Ag(NH3)2+Cd(NH3)42+
6.AgF,BeF2可溶;
IIA氟化物(BeF2除外)難溶。
7.CaCrO4,SrCrO4微溶;
BaCrO4,RaCrO4,PbCrO4,Ag2CrO4難溶。
【例39】
【例40】
【例41】
【例42】
【類23】
【例43】
分別加入K2CrO4(aq)(E)Zn2+(aq)和Al3+(aq)分別加入NaOH(aq)
【例44】
如何辨別
(1)Ag+、Pb2+
(2)Hg2+、Zn2+(3)Ca2+、K+(4)Na+、K+(5)Pb2+、Zn2+、Ca2+
六、藉沉澱法分離離子(定性分析)
【例45】
【例46】
【例47】
寫出分離Ag+,Pb2+,Hg22+之流程
【例48】
【類24】
(Ans.A:
AgBr、CuBr;
B:
FeS;
C:
CaCO3)
【類25】
(Ans.C)
【類26】
(Ans.沉澱:
A.AgCl、PbCl2,B.PbCl2,C.AgCl,D.Cu(OH)2、Fe(OH)2,
E.Fe(OH)2,F.CuS,G.BaCO3;
濾液:
B.Ag(NH3)2+,E.Cu(NH3)42+)