初中化学流程题知识点总结含答案Word文档下载推荐.docx
《初中化学流程题知识点总结含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《初中化学流程题知识点总结含答案Word文档下载推荐.docx(17页珍藏版)》请在冰豆网上搜索。
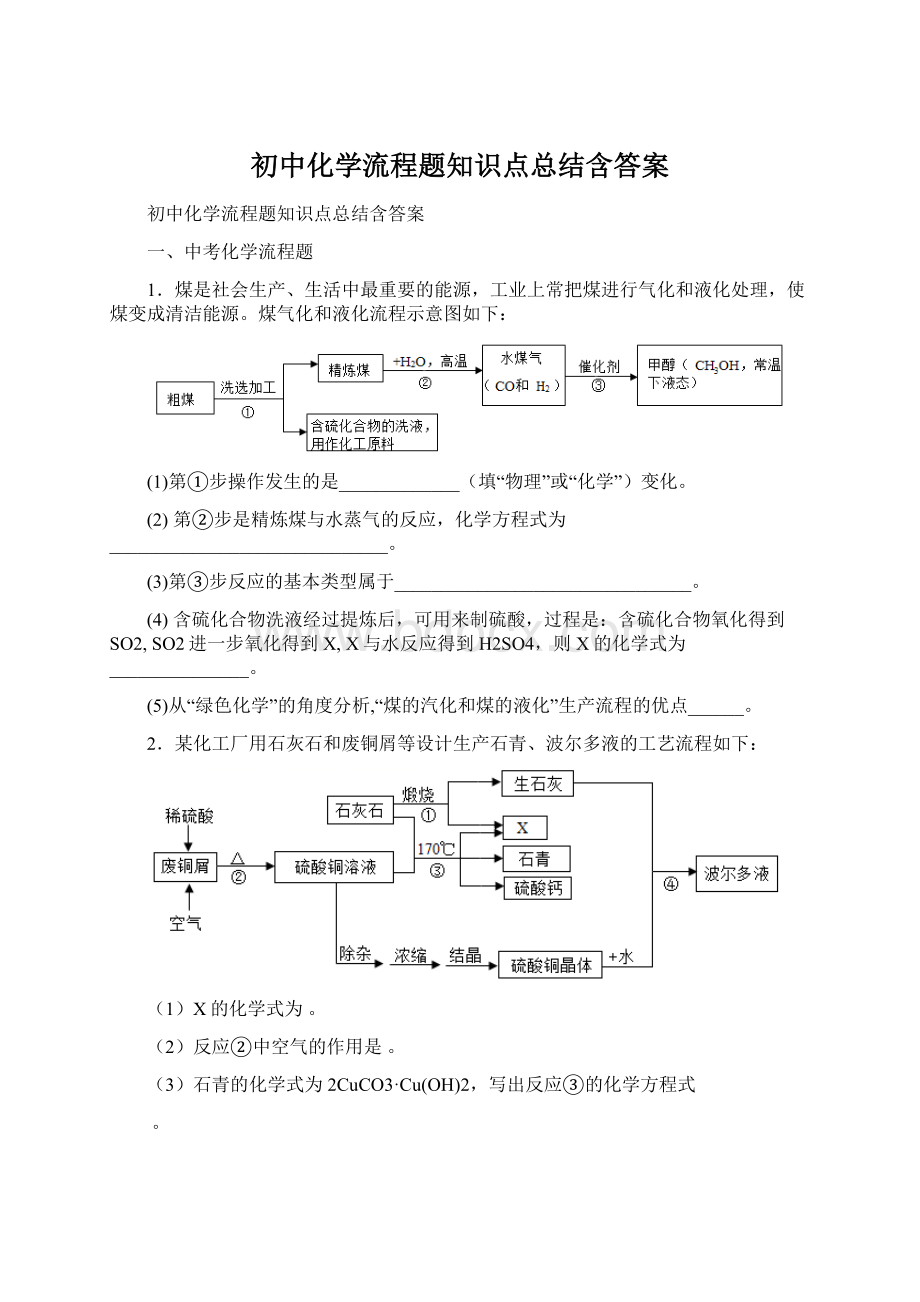
3.工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如图(部分产物略去):
(1)X的化学式是__________,Y的名称是_________;
图中①用过量空气的目的是_______________;
(2)①~④中属于化合反应的是________________;
(3)Zn_____________(填“能”或“不能”)与PbC12溶液反应。
(4)写出反应③中生成ZnO的化学方程式__________________;
(5)结合下表数据设计,从粗锌中分离出纯锌的方案是:
_____________________;
物质
Zn
Pb
C
沸点℃
907
1749
4827
4.我国的领海主权不容侵犯,南海是我国的固有领海,蕴藏着丰富的海洋资源。
(1)南海不仅蕴含着大量的煤、石油、天然气等常规能源,还蕴藏着大量的可燃冰。
可燃冰(主要成分是CH4)被科学家誉为“未来能源”,CH4燃烧的化学方程式是________。
可燃冰作为能源与煤、石油相比的优点是_________、燃烧后几乎不产生任何残渣或废气。
(2)南海某岛利用资源优势,建成海水综合利用基地,生产各种产品。
①从海水中获取淡水,目前能规模化和产业化淡化海水的方法主要是_______和_______。
②从海水中获得氯化钠。
③从海水中得到金属镁。
用苦卤制取金属镁的流程图如下:
苦卤本身含有MgC12,又经历了步骤Ⅰ,Ⅱ的转化过程,其目的是________。
电解无水MgC12制取镁的能量转化为________。
④以海水中获得食盐为原料制取纯碱。
a经过流程Ⅰ过滤后得到沉淀是________。
b流程Ⅱ中发生的总反应为________。
c如果加入氨气不是为了产生氯化铵,那么氨气在制碱过程中作用是_______。
5.我国煤炭资源丰富,煤除了可作燃料外,更是重要的化工原料。
工业上以煤和空气为原料生产尿素(CO(NH2)2)的一种流程如图。
(1)在煤和水蒸气反应前需先将煤粉碎,这样做的目的是____________。
(2)水煤气在铜催化下实现CO的转化:
,其中x的化学式为____________,你推测的依据是______________。
(3)上述流程中合成尿素的同时还有一种无色液体生成,该反应的化学方程式为____________。
(4)从液体空气中分离出N2是____________变化(填“物理”或“化学”);
在上述流程的合成②中,参加反应的N2与H2的质量比为____________;
实际生产中,N2和H2不可能全部化为NH3,上述流程中可回收利用的物质有______________________。
(5)以CO2和H2为原料可合成醇类(分子中碳、氢、氧原子成一定规律的物质,如甲醇(CH4O)、乙醇等),如生成甲醇的化学方程式为。
调整CO2和H2的比例和反应条件还可以合成丙醇(C3H8O),则当CO2和H2个数比为____________可合成丙醇。
6.地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.同学们在学习过程中得知:
工业上把海水晒制后得到的晶体称为粗盐,剩余的液体称为苦卤,小亮等同学对海水晒盐后的苦卤产生了浓厚的兴趣.
查阅资料得知:
①苦卤中含有氯化镁、氯化钠、溴化钾、氯化钾等;
②可以综合利用海水资源制备金属镁,如图是化工厂利用苦卤生产镁的流程,工业上为了使海水中的MgCl2完全反应,要加入过量的石灰乳.
(1)操作a的名称是______,在实验室中进行此项操作,其中玻璃棒的作用是____.
(2)操作a后得到的溶液A的pH_____7(填“<、=、>”);
(3)步骤②中发生反应的化学反应方程式:
__,石灰乳参加化学反应的化学反应方程式___.
(4)海水中提取MgCl2时,经历了“MgCl2—Mg(OH)2—MgCl2”的转化过程,这样做的目的是____。
7.工业上以空气、煤等为原料经过一定步骤合成尿素[CO(NH2)2]的流程图(部分产物已略去)。
第一步:
分离空气分离空气的常用方法有以下两种:
方法Ⅰ.将空气液化后再气化。
①液态空气气化时首先分离出氮气,则沸点:
N2________O2(选填“高于”、“等于”、“低于”)。
在此过程中,氧分子和氮分子_________改变(选填“发生”或“不发生”)。
此分离空气法属于_________变化(填“物理”或“化学”)。
方法Ⅱ.用碳分子筛分离。
资料:
1、碳分子筛对不同气体的吸附强度不同,由于氧分子通过碳分子筛微孔系统的狭窄空隙的扩散速度比氮分子快得多。
因此,当加压时它对氧优先吸附。
2、气压越大,碳分子筛吸附能力越强,反之越弱。
3、碳分子筛可以再生,能重复使用。
②碳分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:
N2________O2(选填“大于”、“等于”、“小于”)。
③根据资料,碳分子筛再生的方法是__________。
第二步:
合成尿素:
④根据流程图写出利用NH3合成尿素和水的符号表达式:
___________。
⑤上述过程生产的尿素样品标签如下图,则该尿素样品中氮元素的质量为________kg(结果保留至0.1)。
此尿素样品__________纯净的尿素(选填是或不是)。
8.氯化铜晶体(CuCl2·
2H2O,为结晶水合物)常用作玻璃、陶瓷着色剂和饲料添加剂等。
它在潮湿空气中易潮解。
易溶于水,能溶于乙醇,受热容易失去结晶水。
一种以辉铜矿石为原料制备CuCl2·
H2O晶体的工艺流程如下:
查阅相关资料得知:
①辉铜矿主要含有硫化亚铜(Cu2S)、还有Fe2O3,SiO2及一些不溶性杂质。
②常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子
Fe3+
Cu2+
氢氧化物开始沉淀时的pH
1.9
4.7
氢氧化物完全沉淀时的pH
3.2
6.7
回答问题:
(1)高温焙烧中有黑色固体生成,反应的化学方程式为______。
(2)焙烧时产生的二氧化硫对环境有污染,会导致______。
(3)滤液1中加入试剂X可以调节溶液pH,控制pH的取值范围为______,从而除去Fe3+而不引入杂质,试剂X可选用下列物质中的______(填字母)。
ACuOBNaOHCCuDCu(OH)2
(4)操作a包含蒸发浓缩、______、过滤、洗涤、干燥等,洗涤CuCl2晶体时,用乙醇代替蒸馏水的目的是______。
(5)用含Cu2S80%的辉铜矿a吨,按上述流程最多可制得CuCl2·
2H2O的质量为______吨(列出算式即可)。
(6)氯化铜可用于制取氢氧化铜,一定温度下,往含一定量氯化铜的溶液中加入适量氢氧化钠,再经过滤、洗涤得到氢氧化铜,为探宄获得较高氢氧化铜转化率条件,该同学进行如下对比实验,数据如下:
实验编号
CuCl2溶液溶质质量分数
反应温度/℃
Cu(OH)2转化率/%
a
10%
30
27.06
b
15%
56.77
c
40
69.64
d
60
54.30
e
20%
60.60
由实验可知,能够得到最多Cu(OH)2的实验组是______(填编号),为探究获得更高Cu(OH)2晶体转化率条件,下列设计合理的是______(填字母)。
A氯化铜浓度15%,温度35℃
B氯化铜浓度15%,温度45℃
C氯化铜浓度20%,温度40℃
D氯化铜浓度10%,温度40℃
9.工业上用纯碱和石灰石为原料制备烧碱的简要反应流程如下图所示,请回答:
(1)以上工艺流程中操作①、操作②用到的玻璃仪器除烧杯、玻璃棒外还有___。
(2)溶液A和纯碱溶液发生反应的化学方程式是____。
以上流程中没有涉及的化学反应基本类型有__。
(3)兴趣小组的同学对溶液C的成分进行探究。
(提出问题)溶液C中的溶质是什么?
(猜想)I.氢氧化钠II.氢氧化钠和碳酸钠III.__
(实验探究)
实验步骤
实验现象
实验结论
①取样品于试管中,向其中滴加几滴纯碱溶液
若___
猜想III不成立
②取样品于试管中,向其中不断滴加_溶液
若_
猜想II成立
10.某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。
用该矿石制备Mg(OH)2的工艺流程简图如图所示:
回答下列问题:
(1)步骤①和步骤②均用到的操作是_________________,该操作中用到的玻璃棒的作用是_______。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和_________(填离子符号)。
步骤①中发生反应的化学方程式是(只要求写出一个)_______________。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子
Mg2+
开始沉淀时的pH
4.2
9.1
完全沉淀时的pH
11.1
步骤②加入熟石灰,调节溶液的pH范围为_______________,固体C中所含成分的化学式为___________。
(4)步骤③中制得Mg(OH)2的化学方程式为_____。
在医药上,氢氧化镁可用来____。
11.为实现废物“资源化利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3]为原料制备KClO3,其主要流程如图所示:
(已知:
Cl2有毒,Ca(OH)2微溶于水)
(1)氯化过程,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中Ca(ClO3)2和CaCl2化学计量数比为1:
5
①生成Ca(ClO3)2的化学方程式为________;
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有___________(填标号)。
A适当减缓通Cl2速率
B充分搅拌浆料
C加水使Ca(OH)2完全溶解
(2)步骤甲的操作名称为________;
加活性炭的目的是__________。
(3)向步骤甲得到的溶液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,该反应的基本反应类型为_________。
12.氢氧化镁是一种重要的化工原料。